2. 河南太龙药业股份有限公司, 郑州 450000
2. Henan Tailong Pharmaceutical Shareholding Co., Ltd., Zhengzhou 450000, China
六神曲(Massa Medicata Fermentata)为辣蓼、青蒿、杏仁、苍耳草等药加入面粉混合后经发酵而成的曲剂[1-2],是传统发酵类中药中应用最广泛的一种,具有消食化积、健脾和胃的功效,用于胸痞腹胀、饮食停滞、呕吐泄利、小儿食积等症[3-4]。目前国内各个地区的六神曲制备工艺不同,且无统一的质量标准,市场应用混乱,直接影响临床疗效,给患者带来用药风险[2]。
苦杏仁苷、青蒿素分别是杏仁和青蒿的特征性成分,苦杏仁苷具有免疫调节、抗溃疡、抗氧化、止咳和镇痛等作用[5],青蒿素具有抗疟、抑菌等作用[6];辣蓼和苍耳草含有黄酮类成分(芦丁、金丝桃苷、槲皮苷、槲皮素、山柰酚)[7-8]和酚酸类成分(香草酸、阿魏酸)[9-10],均具有抗炎、抗菌等作用,槲皮素可用于治疗腹泻肠炎等症[11]。目前,六神曲质量标准研究多集中在黄酮类成分[11-12],马维维等[13]采用HPLC测定六神曲发酵前后苦杏仁苷及青蒿素含量变化,未见报道同时测定六神曲中青蒿素和苦杏仁苷的含量,其黄酮类和酚酸类成分含量同时测定亦未见报道。本文采用波长切换HPLC法测定六神曲中苦杏仁苷、青蒿素、香草酸、芦丁、金丝桃苷、阿魏酸、槲皮苷、槲皮素、山柰酚9个成分含量,方法学考察表明,该方法操作简便,重复性好,可为制定六神曲的质量标准和规范提供科学依据。
1 仪器与试药Waters Alliance 2695高效液相色谱仪,Waters 2996二极管阵列检测器,Waters自动进样器,Empower色谱工作站;METTLER AE240十万分之一分析天平;Shimadzu LIBROR L-160DTP万分之一分析天平;KT-350W超声波清洗机。
1.2 试药六神曲由河南太龙药业股份有限公司提供,为四川千方中药饮片有限公司、四川辅正药业股份有限公司、四川科星药业有限公司、四川百胜药业有限公司4家生产企业共A-J 10批次样品,李江华经副主任药师鉴定为中药六神曲。
对照品苦杏仁苷(批号110820-201607)、青蒿素(批号100202-201004)、香草酸(批号110776-200402)、阿魏酸(批号110773-201611)购自中国食品药品检定研究院,纯度均大于99.0%;对照品金丝桃苷(批号MUST―16102605)购自成都曼斯特生物科技有限公司,纯度为99.76%;对照品芦丁(批号wkq16031602)、槲皮苷(批号wkq16080402,)、槲皮素(批号wkq16063005)、山柰酚(批号wkq15122003)购自四川维克奇生物有限公司,纯度均大于98%。乙腈为色谱纯(Fisher公司),磷酸、甲醇为分析纯,水为超纯水。
2 方法与结果 2.1 色谱条件与系统适用性采用Agela Venusil XBP C18(2)硅胶色谱柱(250 mm×4.6 mm,5 µm),柱温为30 ℃,以乙腈为流动相A,0.08%磷酸水溶液为流动相B,梯度洗脱(0~12 min,10%A→15%A;12~26 min,15%A→27%A;26~42 min,27%A→40%A;42~43 min,40%A→52%A;43~62 min,52%A;62~63 min,52%A→100%A;63~73 min,100%A;73~76 min,100%A→10%A),流速为1 mL·min-1,分段变波长:210 nm(0~15 min,46~62 min,检测苦杏仁苷、青蒿素)、258 nm(15~24.9 min,27~46 min,检测香草酸、芦丁、金丝桃苷、阿魏酸、槲皮苷、槲皮素、山柰酚)、218 nm(24.9~27 min,检测阿魏酸)。进样量10 µL。在上述条件下,各组分分离度良好,见图 1。
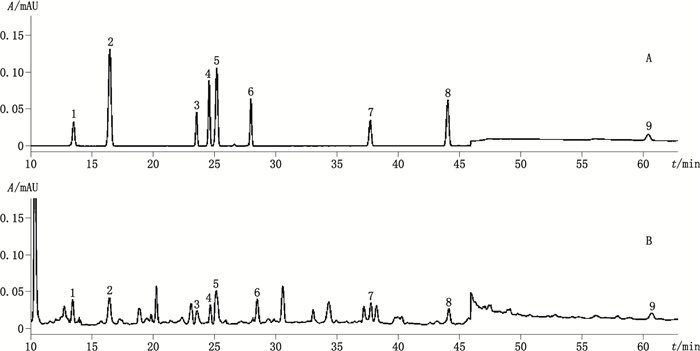
|
1.苦杏仁苷(amygdalin)2.香草酸(vanillic acid)3.芦丁(rutin)4.金丝桃苷(hyperoside)5.阿魏酸(ferulic acid)6.槲皮苷(quercitrin)7.槲皮素(quercetin)8.山柰酚(kaempferol)9.青蒿素(artemisinin) 图 1 对照品(A)、样品(B)HPLC色谱图 Fig.1 HPLC chromatograms of reference substances(A)and sample(B) |
精密称取苦杏仁苷、青蒿素、香草酸、芦丁、金丝桃苷、阿魏酸、槲皮苷、槲皮素、山柰酚对照品适量,加甲醇配制成质量浓度分别为31.95、595.00、17.82、17.27、20.88、75.60、15.93、8.70、13.20 µg·mL-1的混合对照品溶液。
2.2.2 供试品溶液取六神曲粉末20.0 g(过2号筛),精密称定,置于250 mL的锥形瓶中,精密加入甲醇200 mL,20 ℃以下超声提取30 min,放至室温,用甲醇补足减失的量,滤过,取续滤液150 mL,于35 ℃下减压蒸干。残渣加甲醇溶解,并定容至10 mL。
3 方法学考察 3.1 线性关系考察精密吸取“2.2.1”项下混合对照品溶液各1、2、4、8、12、16、20 µL,注入液相色谱仪,记录峰面积,以各对照品进样量(X,µg)为横坐标,峰面积Y为纵坐标,各成分回归方程及线性范围见表 1。
|
|
表 1 回归方程、相关系数和线性范围(n=6) Tab.1 Regression equation, correlation coefficient and linear range |
取混合对照品溶液10 µL,连续进样6次,测定苦杏仁苷、青蒿素、香草酸、芦丁、金丝桃苷、阿魏酸、槲皮苷、槲皮素、山柰酚峰面积的RSD分别为0.72%、0.94%、0.15%、0.33%、0.41%、0.21%、0.37%、0.55%、0.84%,表明精密度良好。
3.3 稳定性试验取同一供试品溶液,室温放置,分别在制备后0、2、4、8、16、24 h按“2.1”项色谱条件进样,测定分析物的峰面积。苦杏仁苷、青蒿素、香草酸、芦丁、金丝桃苷、阿魏酸、槲皮苷、槲皮素、山柰酚峰面积的RSD分别为1.2%、0.98%、1.0%、1.2%、0.92%、1.2%、1.4%、1.0%、1.4%,表明供试品溶液在24 h基本稳定。
3.4 重复性试验取同一批六神曲样品(编号:D)20 g,共6份,精密称定,按“2.2.2”项方法制备供试品溶液,进样10 µL,测定峰面积,分别计算苦杏仁苷、青蒿素、香草酸、芦丁、金丝桃苷、阿魏酸、槲皮苷、槲皮素、山柰酚的含量,其平均含量分别为35.417、289.542、4.921、26.464、11.733、46.889、16.167、5.324、1.083 µg·mL-1,RSD分别为1.2%、1.5%、0.89%、0.93%、1.2%、0.77%、0.96%、1.6%、2.0%。
3.6 加样回收率试验取已知含量的六神曲(编号D)粉末10 g,共6份,精密称定,分别置250 mL具塞锥形瓶中,分别加入苦杏仁苷361.85 µg·mL-1、香草酸51.48 µg·mL-1、芦丁265.11 µg·mL-1、金丝桃苷117.79 µg·mL-1、阿魏酸468.82 µg·mL-1、槲皮苷161.53 µg·mL-1、槲皮素53.86 µg·mL-1、山柰酚µg·mL-1)的混合对照品溶液1 mL,青蒿素1.45 mg·mL-1的对照品溶液2 mL,按“2.2.2”项方法操作,按“2.1”项色谱条件进样10 µL测定,计算回收率,结果苦杏仁苷、青蒿素、香草酸、芦丁、金丝桃苷、阿魏酸、槲皮苷、槲皮素、山柰酚的平均加样回收率(n=6)分别为100.2%、100.0%、102.2%、100.5%、101.4%、99.2%、98.4%、100.9%、100.1%,RSD分别为1.7%、2.3%、2.3%、1.9%、0.98%、2.3%、2.0%、2.5%、2.3%。
4 样品含量测定取10批六神曲,分别按“2.2.2”项方法制备供试品溶液,按“2.1项色谱条件进行含量测定,采用外标法计算六神曲中各成分的含量,结果见表 2。
|
|
表 2 10批六神曲的含量测定结果(µg·g-1,n=3) Tab.2 Contents in ten batches of Massa Medicata Fermentata |
为了优化提取效果,分别考察了乙酸乙酯、甲醇、无水乙醇的提取效率,结果表明甲醇的提取效果最佳。加入10倍量甲醇,比较超声提取15、30、60 min,结果表明经超声提取30 min和60 min时溶液中各成分已提取完全且差别不大,故选择超声提取30 min。
5.2 测定波长的选择本研究对检测波长进行了考察,通过3D紫外光谱图发现:检测波长为258 nm,香草酸、芦丁、金丝桃苷、阿魏酸、槲皮苷、槲皮素、山柰酚有较大吸收;检测波长218 nm,阿魏酸有较大吸收;检测波长为210 nm,苦杏仁苷和青蒿素有较大吸收,且末端吸收下基线较稳定,参考文献[14-15],选择上述2个波长切换测定。
5.3 色谱条件的考察本研究考察了乙腈-水、甲醇-水、甲醇-0.8%磷酸水及乙腈-0.8%磷酸水4种流动相系统,结果采用乙腈-0.08%磷酸水系统,各类成分均得到较好的分离。分别对Agela Venusil XBP C18(2)(250 mm×4.6 mm,5 µm)、Agela Venusil ASB C18(250 mm×4.6 mm,5 µm)和Water SunFireTM C18(250 mm×4.6 mm,5 µm)等色谱柱进行考察,最终选择Agela Venusil XBP C18(2)硅胶色谱柱,各色谱峰分离效果最佳。
5.4 柱温的选择其他色谱条件不变的情况下,设定柱温为30、35、40 ℃,结果显示30 ℃分离效果良好,本实验选择柱温30 ℃。
6 小结建立波长切换HPLC法同时测定六神曲中苦杏仁苷、青蒿素、香草酸、芦丁、金丝桃苷、阿魏酸、槲皮苷、槲皮素、山柰酚共9个成分的含量;其含量测定结果表明,方法稳定可靠,重复性好,可用于六神曲的质量控制。
实验结果显示10批六神曲中9个成分含量差异较大,有3批次未检出青蒿素。原因可能是:①不同药品标准中,六神曲处方原料入药方式及配比不一,制法不一[2];②六神曲在发酵工艺中存在着差异,如发酵时间长短、原料药材的质量差异等[6];③六神曲的质量评价无统一的标准。表明保证成品质量,必须要有规范化的生产过程和合理的质量控制指标。本研究旨在探索六神曲的质量控制方法,为工业化生产提供参考。
| [1] |
中华人民共和国药典2015年版.四部[S]. 2015: 419 ChP 2015. Vol Ⅳ[S].2015: 419 |
| [2] |
张鹏, 陈冰, 李宝银, 等. 六神曲的质量调查与评价研究[J]. 北京中医药, 2017, 36(7): 658. ZHANG P, CHEN B, LI BY, et al. The quality investigation and evaluation of Massa Medicata Fermentata[J]. Beijing J Tradit Chin Med, 2017, 36(7): 658. |
| [3] |
刘振启, 刘杰. 道地"六神曲"的工艺与混乱品的鉴别[J]. 首都医药, 2009, 16(1): 40. LIU ZQ, LIU J. The production process of chinese drugs of Massa Medicata Fermentata and the identification of chaos[J]. Cap Med, 2009, 16(1): 40. DOI:10.3969/j.issn.1005-8257.2009.01.019 |
| [4] |
任巧玲, 宋潇潇. 六神曲的质量情况分析[J]. 中国现代药物应用, 2010, 4(10): 113. REN QL, SONG XX. Analysis of the quality of Massa Medicata Fermentata[J]. Chin J Mod Drug Appl, 2010, 4(10): 113. DOI:10.3969/j.issn.1673-9523.2010.10.104 |
| [5] |
王彬辉, 章文红, 张晓芬, 等. 苦杏仁苷提取工艺及药理作用研究新进展[J]. 中华中医药学刊, 2014, 32(2): 381. WANG BH, ZHANG WH, ZHANG XF, et al. New research progress on extraction process and harmacological effects of amygdalin[J]. Chin Arch Tradit Chin Med, 2014, 32(2): 381. |
| [6] |
刘冲, 刘荫贞, 乐智勇, 等. 高效液相色谱-蒸发光散射检测器法测定六神曲中青蒿素的含量[J]. 中南药学, 2017, 15(2): 225. LIU C, LIU YZ, LE ZY, et al. HPLC-ELSD determination of artemisinin in Liushenqu[J]. Cent South Pharm, 2017, 15(2): 225. |
| [7] |
陈静, 陈铭阳, 孙宇峰, 等. 六神曲中辣蓼的本草考证[J]. 中国现代中药, 2017, 19(1): 116. CHEN J, CHEN MY, SUN YF, et al. Herbal textual of Laliao in Liushenqu[J]. Mod Chin Med, 2017, 19(1): 116. |
| [8] |
何立美, 陈玉婷, 刘洪梅, 等. 高效液相色谱法同时测定水辣蓼提取物中6种黄酮成分的含量[J]. 广东农业科学, 2014, 13: 94. HE LM, CHEN YT, LIU HM, et al. Simultaneous determination of six kinds of flavonoid in extract of Polygonum hydropiper L. by HPLC[J]. Guangdong Agric Sci, 2014, 13: 94. |
| [9] |
刘娟秀, 罗益远, 刘训红, 等. 不同采收期苍耳草中酚酸类及蒽醌类成分的动态积累分析[J]. 中草药, 2016, 47(7): 1204. LIU JX, LUO YY, LIU XH, et al. Dynamic changes of phenolic acids and anthraquinones in aerial parts of Xanthium sibiricum from different collection periods[J]. Chin Tradit Herb Drugs, 2016, 47(7): 1204. |
| [10] |
付小梅, 刘德鸿, 孙艳朝, 等. 蒙古苍耳草化学成分研究[J]. 中药材, 2016, 39(6): 1308. FU XM, LIU DH, SUN YC, et al. Chemical constituents from Xanthium mongolicum[J]. J Chin Med Mater, 2016, 39(6): 1308. |
| [11] |
谢彦博, 徐云, 孙盛, 等. HPLC测定六神曲中青蒿素、芦丁和槲皮素含量[J]. 中国酿造, 2014, 33(10): 140. XIE YB, XU Y, SUN S, et al. Determination of artemisinin, rutin and quercetin in Massa Medicata Fermentata by HPLC[J]. China Bre, 2014, 33(10): 140. DOI:10.11882/j.issn.0254-5071.2014.10.034 |
| [12] |
王丽芳, 高文远, 徐鑫, 等. 鲜干品组方六神曲发酵前后指标成分的LC-MS测定及指纹图谱分析[J]. 中国实验方剂学杂志, 2017, 24(1): 8. WANG LF, GAO WY, XU X, et al. Determination of index components and fingerprint about medicated leaven composed of fresh or dry medicines before and after fermentation by LC-MS[J]. Chin J Exp Tradit Med Form, 2017, 24(1): 8. |
| [13] |
马维维, 戚岑聪, 张艳聪, 等. 六神曲固态协同发酵工艺优化及物质动态变化研究[J]. 中华中医药学刊, 2017, 35(5): 1290. MA WW, QI CC, ZHANG YC, et al. Optimization of medicated leaven Solid-state fermentation process and research of material change in the process[J]. Chin Arch Tradit Chin Med, 2017, 35(5): 1290. |
| [14] |
练晶军.六神曲质量特征及发酵变化研究[D].北京: 北京中医药大学, 2011 LIAN JJ. Study on the Quality Characteristics and Fermentation Changes of Massa Medicata Fermentata[D]. Beijing: Beijing University of Chinese Medicine, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10026-1011117669.htm |
| [15] |
唐亮, 谭淑珍, 华坤鹏, 等. RH-HPLC法测定青蒿素中脱氢青蒿素及9-表-青蒿素的含量[J]. 湖南文理学院学报(自然科学版), 2016, 28(1): 24. TANG L, TAN SZ, HUA KP, et al. Determination of artemisitene and 9-epi- artemisinin in artemisinin raw material by RH-HPLC[J]. J Hunan Univ Arts Sci(Sci Technol), 2016, 28(1): 24. |
 2019, Vol. 39
2019, Vol. 39 