核磁共振(NMR)是有机物定性的有力工具,由于1H NMR中的共振峰面积或峰高与该共振峰质子数成正比,使得该方法也可用于定量分析。高强度磁场和傅里叶变换技术的应用使仪器性能得到较大改善,其测定准确度、重复性和灵敏度能满足定量要求。目前国内外已经有大量的研究和报道[1-8],很多国家和地区已将NMR技术用于药物的定量分析和检测[9],2015年《中华人民共和国药典》四部也对核磁共振波谱定量方法进行了详细的阐述[10]。
二对甲苯磺酸缘生替尼是针对人表皮生长因子受体-1(human epidermal growth factor receptor-1,HER-1)和人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)可逆的酪氨酸激酶抑制剂,乳腺癌分子靶向新药。其同类药物葛兰素史克公司生产的拉帕替尼的临床试验显示,其对过度表达HER-2的复发或顽固性炎症性乳癌有效,对乳癌脑转移亦有效[11-15]。作为创新药,二对甲苯磺酸缘生替尼无市售对照品,且本品含有磷,高温下易生成复杂不挥发物质干扰炽灼残渣测定,因此采用质量平衡法测定存在一定误差,需要其他不同原理的定值方法进行复核[7]。采用定量核磁共振氢谱(1H qNMR)内标法,建立一种快速、专属、简单的纯度测定方法,对于新药二对甲苯磺酸缘生替尼原料药及其制剂的质量监控和质量标准的建立具有重要意义。
1 仪器与试药Bruker AV-400超导核磁共振谱仪(Bruker公司),5 mm DUL探头,5 mm核磁共振样品管。溶剂:氘代二甲亚砜(DMSO)(Tenglong Weibo technology,Inc.,氘代度99.8%,含0.03%(v/v)四甲基硅烷)。定量内标:顺丁烯二酸(含量99.5%,上海紫一试剂厂);二对甲苯磺酸缘生替尼对照品(批号150501)由江苏康缘研究院自制,经中国药科大学分析测试中心鉴定。
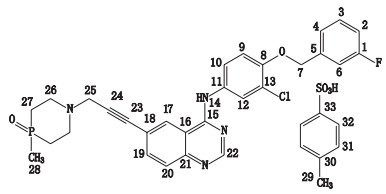
2 方法与结果 2.1 二对甲苯磺酸缘生替尼核磁共振谱归属和特征峰的选择通过对二对甲苯磺酸缘生替尼在氘代DMSO溶液中的氢谱、重水交换谱、碳谱、DEPT谱、COSY谱、HSQC谱和HMBC谱分析,对氢谱进行了归属。根据检查结果,H7(2H s)与H25(2H s)均为孤立的单峰,峰两侧基线平坦且其他信号对其无干扰,适宜作为特征峰进行定量考察。但H7(2H s)比H25(2H s)响应值高,且与内标峰更接近,所以选择H7(2H s)作为特征峰进行定量考察。二对甲苯磺酸缘生替尼结构见图 1,氢谱测定结果见表 1。
|
图 1 二对甲苯磺酸缘生替尼结构 Fig.1 The structure of yunsintinib ditosylate |
|
|
表 1 二对甲苯磺酸缘生替尼氢谱测定结果 Tab.1 1H NMR data of yunsintinib ditosylate |
脉冲宽度:P1=10.0 μs;脉冲延迟时间:D1=1 s;扫描次数:n=32。
2.3 内标溶液的制备精密称取顺丁烯二酸适量,加入氘代DMSO溶解并稀释制成每1 mL约含1 mg的溶液,即得。
2.4 供试品溶液的制备精密称取二对甲苯磺酸缘生替尼对照品约为10 mg,置于核磁样品管中,加入内标溶液0.5 mL溶解,摇匀,即得。
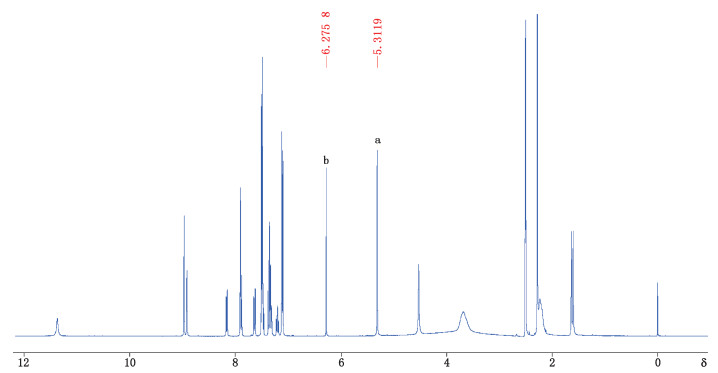
2.5 测定方法测定核磁共振氢谱中二对甲苯磺酸缘生替尼的定量峰a(δ=5.31)的面积Ax,顺丁烯二酸定量峰b(δ=6.28)的面积As,按
|
图 2 二对甲苯磺酸缘生替尼(a)和顺丁烯二酸(b)的1H qNMR图 Fig.2 The 1H qNMR spectrum of yunsintinib ditosylate(a)and maleic acid(b) |
精密称取顺丁烯二酸适量,加氘代DMSO溶解并稀释制成质量浓度为1.124 mg·L-1的内标溶液。再精密称取二对甲苯磺酸缘生替尼适量,加内标液溶解并稀释制成质量浓度为43.52 mg·L-1的储备液,精密量取该储备液62.5、125、250、375、500 μL分别置核磁管中,再分别加入内标溶液定量配制成0.5 mL的溶液,得系列供试溶液。按“2.2”项下方法测定,以二对甲苯磺酸缘生替尼与顺丁烯二酸的质量比为横坐标(X),峰a与峰b的积分面积比值为纵坐标(Y),做线性回归,计算出回归方程:
Y=0.1 281X−0.000 4 r=0.999 9
表明供试品与内标物质量比值在4.857~38.857范围内与两者定量峰面积比值呈良好的线性关系。
2.7 精密度试验精密称取约10 mg对照品,置核磁样品管中,精密精密加入内标溶液0.5 mL,摇匀,作为供试溶液,在选定的同一试验条件下连续测定6次,峰a与峰b的积分面积比值计算,RSD为0.20%,表明精密度良好。
2.8 稳定性试验取“2.7”项下的供试溶液,按“2.2”项下方法测定,分别于0、1、2、4、6、8 h测定,峰a与峰b的积分面积比值计算,RSD为0.50%,表明样品溶液在8 h内测定稳定。
2.9 重复性试验分别精密称取约10 mg对照品6份,分别置核磁样品管中,各精密加入内标溶液0.5 mL,摇匀,即得。按“2.5”项下方法计算二对甲苯磺酸缘生替尼的含量平均值为98.54%,RSD为0.2%,显示该方法具有良好的重复性。
2.10 质量平衡法测定结果HPLC面积归一化法测定结果为99.88%,干燥失重检查结果为1.06%,残留溶剂检查结果为0.007%。质量平衡法计算结果为(100%-干燥失重%-残留溶剂%)×HPLC面积归一化法测定结果%=98.81%。采用(1H qNMR)内标法检查结果为98.54%,两者差异不大。
3 讨论 3.1 内标物的选择按NMR含量测定的要求(内标法),内标应具有较高的纯度,所含质子数较少,主要吸收峰与所测的样品峰之间无干扰,且不与样品发生反应。按照上述要求,本实验选择了顺丁烯二酸作为内标物。
3.2 氘代试剂的选择因二对甲苯磺酸缘生替尼和顺丁烯二酸在DMSO中溶解性良好,且DMSO的溶剂峰处于较高场与对照品和内标物的吸收峰无干扰,因此,本实验以氘代DMSO为溶剂。
3.3 延迟时间(D1)的选择D1是定量实验中非常重要参数,要选择足够长时间(≥5×T1)使原子核完全弛豫,从而使被积分的信号强度与原子核数目成正比。通过测定,峰a与峰b的T1值分别为0.093 s和0.092 s,因此D1定为1 s。
4 结论试验结果表明核磁共振波谱法测定二对甲苯磺酸缘生替尼对照品的含量,线性关系、精密度、稳定性和重复性良好,具有快速、简便、不破坏样品的特点,最大的优点是在难以得到被测物样品的对照品时,可以选用其他化合物对照品的定量峰进行定量测定。
| [1] |
张才煜, 吴建敏, 李憬. 核磁共振法定量测定氢溴酸东莨菪碱的绝对含量[J]. 药物分析杂志, 2012, 32(2): 327. ZHANG CY, WU JM, LI J. Quantitative nuclear magnetic resonance determination of the absolute content of scopolamine hydrobromide[J]. Chin J Pharm Anal, 2012, 32(2): 327. |
| [2] |
蒋孟虹, 于小波, 毛黎顺. 核磁共振法测定10-O-(N, N-二甲氨基乙基)-银杏内酯B甲磺酸盐标准物质的含量[J]. 中国药科大学学报, 2013, 44(4): 339. JIANG MH, YU XB, MAO LS. Quantitative determination of 10-O-N, N-dimethylaminoethyl-ginkgolide B methanesulfonate by nuclear magnetic resonance[J]. J China Pharm Univ, 2013, 44(4): 339. |
| [3] |
张琪, 朱红波, 杨化新. 核磁共振法定量影响因素探析[J]. 中国药品标准, 2014, 15(6): 404. ZHANG Q, ZHU HB, YANG HX. Discussion on the factors influencing quantitative nuclear magnetic resonance determination[J]. Drug Stand China, 2014, 15(6): 404. |
| [4] |
刘阳, 魏宁漪, 张琪. 19F核磁共振定量技术测定酒石酸吉米格列汀倍半水合物含量[J]. 药物分析杂志, 2014, 34(7): 1197. LIU Y, WEI NY, ZHANG Q. Quantitative analysis of gemigliptin tartrate sesquihydrate by 19 Fquantitative NMR(19F-qNMR)[J]. Chin J Pharm Anal, 2014, 34(7): 1197. |
| [5] |
马晓丽, 邹萍萍, 雷伟. 定量核磁技术参数的优化及其在中草药定量分析领域的应用[J]. 药学学报, 2014, 49(9): 1248. MA XL, ZOU PQ, LEI W. Optimization of experimental parameters for quantitativeNMR(qNMR)and its application in quantitative analysis of traditional Chinese medicines[J]. Acta Pharm Sin, 2014, 49(9): 1248. |
| [6] |
周晓力, 马迅, 陈华. 1H NMR法定量测定奥沙西泮杂质Ⅰ对照品的含量[J]. 药物分析杂志, 2016, 36(9): 1696. ZHOU XL, MA X, CHEN H. Determination of impurity Ⅰ reference substance of oxazepam by 1H NMR[J]. Chin J Pharm Anal, 2016, 36(9): 1696. |
| [7] |
吴先富, 张琪, 马玲云. 定量核磁共振法测定去水卫矛醇的含量[J]. 药物分析杂志, 2017, 37(1): 181. WU XF, ZHNG Q, MA LY. Quantitative determination of dianhydrogalactitol by proton nuclear magnetic resonance[J]. Chin J Pharm Anal, 2017, 37(1): 181. |
| [8] |
孙煌, 付璀莹, 周润宏. 核磁共振和液相色谱-质谱法对苯丙哌林未知杂质的结构分析[J]. 药物分析杂志, 2017, 37(11): 2000. SUN H, FU CY, ZHOU RH. Structural analysis of unknown impurities in benproperine by NMR spectroscopy and liquid chromatography-mass spectrometry[J]. Chin J Pharm Anal, 2017, 37(11): 2000. |
| [9] |
BP 2013[S]. 2013: Appendix ⅡC
|
| [10] |
中华人民共和国药典2015年版.四部[S]. 2015: 52 ChP 2015. Vol Ⅳ[S]. 2015: 52 |
| [11] |
娄莹, 黄韬. 乳腺癌靶向治疗进展[J]. 肿瘤学杂志, 2009, 15(9): 788. LOU Y, HUANG T. Progress in target therapy for breast cancer[J]. J Chin Oncol, 2009, 15(9): 788. |
| [12] |
吴慧芳, 王海琳, 冯焕荣. 拉帕替尼联合顺铂对人卵巢癌细胞SKOV3生长的影响[J]. 中国现代医药杂志, 2012, 14(4): 12. WU HF, WANG HL, FENG HR. The effections of lapatinib combination with cisnlatin on human ovarian cancer cell SKOV3[J]. Mod Med J China, 2012, 14(4): 12. DOI:10.3969/j.issn.1672-9463.2012.04.004 |
| [13] |
何祥萌, 张凌岩, 李英. 吉非替尼和拉帕替尼对HEL细胞增殖的抑制作用[J]. 中国实验血液学杂志, 2012, 20(2): 372. HE XM, ZHANG LY, LI Y. Inhibitory effect of gefitinib and lapatinib on proliferation of HEL cells[J]. J Exp Hematol, 2012, 20(2): 372. |
| [14] |
陈伟, 刘永梅. 拉帕替尼:作用于表皮生长因子受体的靶向抗肿瘤新药[J]. 药品评价, 2012, 9(12): 10. CHEN W, LIU YM. Lapatinib:a novel anti-tumor drug targeting human epidermal growth factor receptors[J]. Drug Eval, 2012, 9(12): 10. DOI:10.3969/j.issn.1672-2809.2012.12.002 |
| [15] |
冯焕荣, 李青, 王海琳. 新型靶向治疗药物拉帕替尼的研究进展[J]. 现代生物医学进展, 2012, 12(4): 746. FENG HR, LI Q, WANG HL. The research progress of new targeted therapy drugs lpatinib[J]. Prog Mod Biomed, 2012, 12(4): 746. |
 2019, Vol. 39
2019, Vol. 39 
