疏螺旋体素(borrelidin)又称抗螺旋体链丝菌素、抗包柔氏螺旋体素,是一种能够通过多种途径抑制血管生成的药物。1949年,在一株娄彻氏链霉菌Streptomyces rochei的代谢产物中发现该化合物,以其抑菌活性及青霉素增效能力而被首次报道,并因其独特的抗包柔氏螺旋体活性而被命名[1-2]。疏螺旋体素呈现良好的抗菌活性,其抗菌机制主要是对苏氨酰tRNA合成酶(ThrRS)的抑制[3]。疏螺旋体素并不是与ThrRS的活性中心结合,而是结合到疏水非活性中心-簇A。簇A的氨基酸残基一般是保守的,因此,其存在于很多原核生物和真核生物体内,而这些生物体对疏螺旋体素都是非常敏感的[4-7]。
近年报道疏螺旋体素可以抑制血管的生成。最先是在一个大鼠主动脉培养模型上发现疏螺旋体素具有血管生成抑制作用[8]。血管生成抑制疗法已经被广泛应用[9-10],有关研究基础机制研究也已经比较成熟,发掘开发疏螺旋体素及其类似物的研究,具有很大的前景。
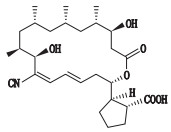
疏螺旋体素的结构上属于含有十八元环的大环内酯类化合物,化学式为C28H43NO6,相对分子质量489.6,结构式如图 1,含有9个手性中心,含有共轭二烯、环戊酸、氰基结构[11]。
|
图 1 疏螺旋体素的化学结构 Fig.1 Chemical structure of borrelidin |
目前关于疏螺旋体素类化合物的发酵及纯化工艺研究报道较少。在疏螺旋体素的生产过程设计菌种选育、发酵工艺优化、纯化工艺研究等中需要建立迅速、精确、适用于发酵液样品的疏螺旋体素含量分析方法。本研究利用HPLC实现发酵液中疏螺旋体素含量的快速分析,减少实验成本,提高工作效率。
1 仪器与试剂仪器:高效液相色谱分析仪LC-20A(岛津公司),Agilent 6545 Q-TOF LC/MS(Agilent公司),高速台式离心机TGL-16G(上海安亭科学仪器厂)。
试药:疏螺旋体素对照品(含量98%,Cayman chemical公司)、乙腈(色谱纯,默克公司)、甲醇(分析纯,国药集团化学试剂有限公司)、三氟乙酸(分析纯,国药集团化学试剂有限公司)、甲酸(分析纯,国药集团化学试剂有限公司)、水为自制超纯化水。
2 方法与结果 2.1 色谱和质谱条件 2.1.1 高效液相色谱色谱柱:Agilent ZORBAX SB-C18色谱柱(5 µm,4.6 mm×250 mm);流动相:乙腈-0.1%三氟乙酸溶液(50:50);流速:1.5 mL·min-1;进样量:10 μL;检测波长:257 nm;采用时间:30 min;采用峰面积计算含量。
2.1.2 HPLC-Q-TOF-MS分析色谱条件:采用Agilent Eclipse Plus C18 RRHD色谱柱(2.1 mm×50 mm,1.8 μm),流动相为乙腈-水(0.1%甲酸)(50:50),流速0.4 mL·min-1,柱温40 ℃,进样量0.5 μL。质谱条件:飞行时间质谱采用电喷雾正离子模式,鞘气温度350 ℃,鞘气流速11.0 L·min-1,喷嘴电压1.0 kV,毛细管电压3.5 kV,雾化气压力0.24 MPa,干燥气温度320 ℃,干燥气流速8.0 L·min-1,喷雾室电流4.39 μA,毛细管电流0.068 μA,fragmentor电压175 V,Skimmer电压65 V,八极杆电压750 V,质谱测定数据采用全扫描模式采集,数据采集范围m/z 100~1 000。
2.2 溶液的制备对照品溶液:准确称取疏螺旋体素对照品4.00 mg置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,制成质量浓度为400 μg·mL-1对照品储备液。
发酵液样品溶液:取发酵液10 mL,加入10 mL甲醇,振荡混匀20 min,10 000 r·min-1离心5 min,取上清液备用。
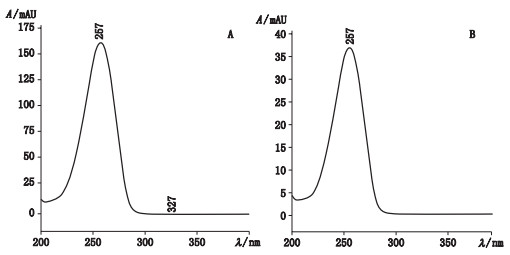
2.3 发酵液中疏螺旋体素确认将疏螺旋体素对照品与发酵液样品经光电二极管阵列检测器200~400 nm紫外扫描表明二者紫外吸收图谱基本一致(见图 2),均在257 nm处有最大吸收。按色谱条件测定,结果发酵液样品色谱中相应峰与疏螺旋体素对照品色谱峰保留时问相同,初步判断该峰为疏螺旋体素。
|
图 2 对照品(A)和发酵液样品(B)疏螺旋体素紫外吸收图谱 Fig.2 The UV absorption spectra of borrelidin (A)and fermentation broth(B) |
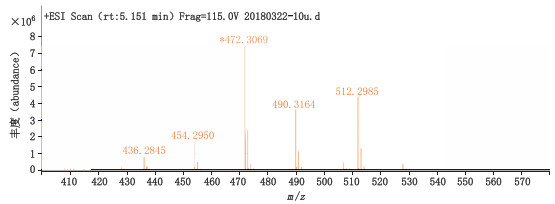
为了进一步确证样品,采用HPLC-Q-TOF-MS分析技术对目标质荷比进行ESI正离子选择监测,提取离子流显示疏螺旋体素对照品与发酵液中疏螺旋体素出峰时间一致,质谱图如图 3所示,已知疏螺旋体素的分子式为C28H43NO6,精确理论相对分子质量为489.309 0,质谱检测结果显示样品的准分子离子峰[M+H]+为490.315 6,钠加合离子峰[M+Na]+为512.297 9,钾加合离子峰[M+K]+为528.265 3,提示其相对分子质量与已知疏螺旋体素相对分子质量相符,基本可以确认发酵液中目标组分为疏螺旋体素。
|
图 3 HPLC-Q-TOF-MS图谱 Fig.3 The HPLC-Q-TOF-MS spectrum of borrelidin |
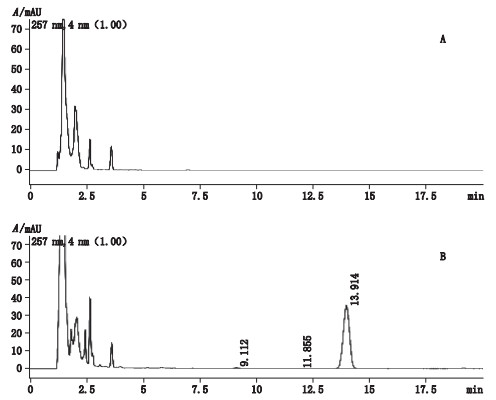
将空白发酵液(未接种培养基相同条件培养)与产疏螺旋体素的发酵液样品色谱图进行比较(见图 4);由图 4可知,发酵液中的培养基组分不干扰疏螺旋体素的测定。
|
图 4 空白发酵液(A)和发酵液样品(B)色谱图 Fig.4 Chromatograms of blank fermentmion broth sample(A) and fermentation broth sample(B) |
准确称取疏螺旋体素对照品4.00 mg于10 mL量瓶中,用甲醇溶解,配成质量浓度为400 μg·mL-1的对照品溶液,采用2倍稀释法精确吸取该对照品溶液适量,用甲醇稀释成12.5、25、50、100、200 μg·mL-1的系列溶液,分别取10 µL注入HPLC仪,以质量浓度(X,μg·mL-1)为横坐标,峰面积积分值(Y)为纵坐标,线性回归方程:
Y=3.174×104X-1.193×105 r2=0.999 7
结果表明,疏螺旋体素质量浓度在12.5~200 μg·mL-1的范围内,与峰面积线性关系良好。
2.6 精密度试验 2.6.1 仪器精密度同一发酵液样品,按“2.2”项下样品的制备方法操作,制备发酵液样品溶液,在上述色谱条件下连续进样分析6次,疏螺旋体素含量的RSD(n=6)为0.42%。
2.6.2 方法重复性精密量取同一发酵液样品6份,按“2.2”项下样品的制备方法操作,制备发酵液样品溶液,在上述色谱条件下进样分析,疏螺旋体素的平均含量(n=6)为61.11μg·mL-1,RSD为1.3%。
2.7 稳定性色谱系统稳定后,对同一发酵液样品溶液分别在0、2、4、6、8、10、12 h时进样10 µL测定,含量测定结果的RSD(n=7)为1.2%,表明疏螺旋体素在12 h以内稳定性良好。
2.8 加样回收率试验取己知含量的发酵液样品9份,每份精密量取0.5 mL,平分为3组,每组按低、中、高浓度分别精密加入一定量的对照品溶液,按“2.2”项下操作,在上述色谱条件下进行HPLC分析,结果见表 1。回收率实验符合要求,加样回收率为97.0%~105.5%,平均回收率(n=9)102.8%,回收率相对标准偏差RSD为0.86%(< 2.0%)。
|
|
表 1 回收率试验结果(n=9) Tab.1 Test results of recovery |
通过线性关系考察试验、系统精密度试验、加样回收率试验及稳定性试验等可以看出,采用高效液相色谱法对链霉菌发酵生产疏螺旋体素过程进行定量分析,样品重复性以及结果的准确性均符合要求。取3批发酵液样品处理后按照上述方法进行HPLC检测,结果3批发酵液中疏螺旋体素的含量分别为61.18、69.92、61.08 μg·mL-1。该分析检测方法样品处理简单方便,分离度理想,结果重复性好,可以用于疏螺旋体素的产生菌Streptomyces sp.菌种诱变选育、发酵工艺优化及化学纯化过程的样品监测。
3 讨论疏螺旋体素有良好的抗细菌生物活性,其作用机制特殊,还具有血管生成抑制作用,因此具有很好的开发前景。疏螺旋体素含有9个手性中心,含有共轭二烯、环戊酸、氰基结构,化学全合成困难,目前来源主要靠微生物发酵产生[12-13]。但是关于微生物发酵生产疏螺旋体素的研究国内外报道均较少,其菌种选育、发酵、纯化精制及质量控制等方面报道甚少。本课题组在筛选微生物天然产物过程中分离到1株可产疏螺旋体素的放线菌Streptomyces sp. BOR-0311[14]。对产疏螺旋体素的菌株发酵液采用HPLC-Q-TOF-MS分析技术确认目标化合物,并建立了HPLC含量测定方法,该方法具有较高的准确度和良好的重现性,可应用于菌株选育、发酵优化及产品提取的生产现场的有效质量控制,为该菌株的后续研发提供检测保障。
| [1] |
BERGER J, JAMPOLSKY LM, GOLDBERG MW. Borrelidin, a new antibiotic with antiborrelia activity and penicillin enhancement properties[J]. Arch Biochem, 1949, 22(3): 476. |
| [2] |
SAISIVAM S, BHIKSHAPATHI DVRN, KRISHNAVENI J, et al. Isolation of borrelidin from Streptomyces californicus-An Indian soil isolate[J]. Indian J Biotechnol, 2008, 7(3): 349. |
| [3] |
FANG P, YU X, JEONG SJ, et al. Structural basis for full-spectrum inhibition of translational functions on a tRNA synthetase[J]. Nat Commun, 2015, 6(1): 11. |
| [4] |
LUMB M, MACEY PE, SPYVEE J, et al. Isolation of vivomycin and borrelidin, two antibiotics with anti-viral activity, from a species of Streptomyces (C2989)[J]. Nature, 1965, 206(981): 263. |
| [5] |
GAO YM, WANG XJ, ZHANG J, et al. Borrelidin, a potent antifungal agent:insight into the antifungal mechanism against Phytophthora sojae[J]. J Agric Food Chem, 2012, 60(39): 9874. DOI:10.1021/jf302857x |
| [6] |
LIU CX, ZHANG J, WANG XJ, et al. Antifungal activity of borrelidin produced by a Streptomyces strain isolated from soybean[J]. J Agric Food Chem, 2012, 60(5): 1251. DOI:10.1021/jf2044982 |
| [7] |
SUGAWARA A, TANAKA T, HIROSR T, et al. Borrelidin analogues with antimalarial activity:design, synthesis and biological evaluation against Plasmodium falciparum parasites[J]. Bioorg Med Chem Lett, 2013, 23(8): 2302. DOI:10.1016/j.bmcl.2013.02.075 |
| [9] |
WAKABAYASHI T, KAGEYAMA R, NARUSE N, et al. Borrelidin is an angiogenesis inhibitor; Disruption of angiogenic capillary vessels in a rat aorta matrix culture model[J]. J Antibiot, 1997, 50(8): 671. DOI:10.7164/antibiotics.50.671 |
| [10] |
KAWAMURA T, LIU D, TOWLE MJ, et al. Anti-angiogenesis effects of borrelidin are mediated through distinct pathways:threonyl-tRNA synthetase and caspases are independently involved in suppression of proliferation and induction of apoptosis in endothelial cells[J]. J Antibiot (Tokyo), 2003, 56(8): 709. DOI:10.7164/antibiotics.56.709 |
| [11] |
BHIKSHAPATHI DVRN, KUMAR YS, RAO YM, et al. Borrelidin:a prospective drug[J]. Indian J Biotechnol, 2010, 9(1): 18. |
| [12] |
NAGAMITSU T, TAKANO D, MARUMOTO K, et al. Total synthesis of borrelidin[J]. J Org Chem, 2007, 72(8): 2744. DOI:10.1021/jo062089i |
| [13] |
萨拉斯J A, 门德斯C, 奥拉诺C, 等.产生疏螺旋体素的聚酮化合物合酶及其用途: CN1732264A[P]. 2003-12-24 SALAS JA, MÉNDEZ C, OLANO C, et al. Borrelidin-producing polyketide synthase and its use: CN1732264A[P]. 2003-12-24 |
| [14] |
李周, 赵圣印. 娄彻氏链霉菌ATCC10739产抗生素Borrelidin发酵条件优化及其分离纯化[J]. 微生物学通报, 2011, 38(7): 1051. LI Z, ZHAO SY. Borrelidin production by Streptomycete rochei ATCC10739:optimization of fermentation, separation and purification conditions[J]. Microbiol China, 2011, 38(7): 1051. |
| [15] |
周剑, 陈宏, 杨煌建, 等. 响应面法优化疏螺旋体素发酵培养基[J]. 中国抗生素杂志, 2016, 41(5): 344. ZHOU J, CHEN H, YANG HJ, et al. Optimization of fermentation medium for production of borrelidin by response surface methodology[J]. Chin J Antibiot, 2016, 41(5): 344. DOI:10.3969/j.issn.1001-8689.2016.05.005 |
 2019, Vol. 39
2019, Vol. 39 
