2. 中国食品药品检定研究院, 北京 102629
2. National Institutes for Food and Drug Control, Beijing 102629, China
传统的基于细胞病变效应(cytopathic effect,CPE)的病毒滴定方法是病毒灭活验证的经典方法。但是,利用该种方法对每个样品的评估需要消耗大量的耗材以及花费较长的观察时间。而且,人工进行细胞病变观察,易受主观因素影响。另外,该方法通常需要长时间的培养以量化感染性病毒,尤其对于出现病变较慢的病毒,由于培养时间长,在未出现细胞病变时细胞本身可能发生变化,无法准确地评估细胞病变,导致病毒滴定不准确[1]。Ko等使用mRNA作为感染性腺病毒的指示物,进行了腺病毒灭活验证[2-4]。但是,单纯的PCR检测病毒核酸的方法不能区分失活的死病毒和感染性活病毒。有研究已经证明结合细胞培养和分子生物学方法,能够以更客观、短时间的方式区分灭活的死病毒和感染性活病毒[1, 5-10]。对于DNA病毒,在其侵染细胞后,既可以选择提取病毒DNA转录出的mRNA,又可以选择提取进入细胞的病毒基因组DNA进行核酸的定量检测。然而,mRNA制备的成本较高,容易降解,且易受基因组DNA干扰[8]。有多项研究以更加稳定的基因组DNA作为检测对象,利用热力灭活病毒作为对照,利用细胞培养-核酸扩增荧光定量PCR(integrated cell culture quantitative PCR,ICC-qPCR)方法检测活病毒。Gerrity、Hodon等先后开发了针对腺病毒灭活验证的ICC-qPCR方法,并证明了该方法的适用性[1, 8]。热力可使病毒外膜蛋白和衣壳蛋白变性,使病毒包膜上的糖蛋白棘突发生改变,从而阻止病毒吸附于宿主细胞,使病毒失去感染性,但热力灭活对于病毒核酸基本没有影响[11-12]。因此,基于以上文献研究,本研究使用热灭活的伪狂犬病毒(pseudorabies virus,PRV)作为对照,进一步证明死病毒DNA无法进入正常细胞,从而通过考察最初的活病毒吸附进入细胞的结果来区分死病毒和活病毒。通过提取染毒后细胞及PRV活病毒DNA进行PRV核酸定量检测,建立PRV的ICC-qPCR检测方法,结合经典CPE法,建立ICC-qPCR检测方法与经典CPE法的相关性数据曲线,考察ICC-qPCR方法的适用性。同时开展所建立方法在复用电生理导管的环氧乙烷病毒灭活验证中的应用研究,评估复用电生理导管的环氧乙烷灭菌工艺对病毒灭活的有效性。
1 材料与仪器 1.1 病毒与细胞PRV(Bartha株,购自中国兽医药品监察所);PK15细胞(由中国食品药品检定研究院细胞资源保藏研究中心提供,中国食品药品检定研究院医疗器械所质量评价室建库保存)。
1.2 材料一次性电生理导管由北京大学第一附属医院收集、灭菌后提供。
1.3 主要试剂胎牛血清、细胞培养液(均购自Gibco公司);无菌抗凝绵羊全血、青链霉素混合液、EB染料、琼脂(LB)固体培养基干粉、LB液体培养基干粉、氨苄青霉素储存液、50×TAE缓冲液、Marker I DNA Ladder、6×DNA上样缓冲液、琼脂糖、DH5a感受态细胞(均购自北京索莱宝科技有限公司);氯化钠注射液(石家庄四药有限公司);无水氯化钙(国药);磷酸盐缓冲液(PBS,Hyclone公司);环氧乙烷(EO)灭菌剂(河南三强医疗器械有限公司);DNeasy® Blood & Tissue Kit(Qiagen公司);Ex Taq® DNA Polymerase、胶回收试剂盒、PMDTM 18-T Vector Cloning kit、质粒提取试剂盒、SYBR® Premix Ex TaqTMⅡ(均购自Takara公司)。
PCR引物由生工生物工程(上海)股份有限公司合成。
1.4 仪器二氧化碳培养箱(BB150,Thermo公司)、离心机(3K15,sigma公司)、倒置显微镜(Axio Vert. A1,ZEN公司)、酶标仪(Spectramax M5,Molecular devices公司)、实时荧光定量PCR仪(LightCycler480 Ⅱ,Roche公司)、基因扩增仪(PC-707-02,ASTEC公司)、电泳仪(Power Pac Basic,Bio-Rad公司)、环氧已烷灭菌柜(SQ-H40,河南三强医疗器械有限公司)、数显型医用封口机(SQ-F,河南三强医疗器械有限公司)。
2 方法 2.1 PRV病毒液的制备与滴定 2.1.1制备PRV病毒液将PK15细胞以1.0×106个接种于75 cm2细胞培养瓶,用含10%胎牛血清(FBS)的细胞生长培养液(含10%FBS的MEM)培养至细胞单层,接种PRV病毒,置于37 ℃吸附2 h后吸除液体,加入含2%FBS的MEM维持培养液继续培养3 d。将染毒细胞反复冻融3次,3 000 r·min-1离心5 min取上清,收获PRV病毒。
2.1.2 滴度的测定将PK15细胞以每孔5×103个接种于96孔细胞培养板,培养24 h,吸除液体,PBS漂洗1次。将制备的PRV经10倍系列稀释后以每孔100 μL接种于PK15细胞,37 ℃吸附2 h,吸除液体,PBS漂洗1次,加入含2% FBS的维持培养液,每孔200 μL,于37 ℃、5%二氧化碳培养箱中培养3 d,采用Reed-Muench方法[13]计算病毒滴度(每毫升的logs)。
2.2 ICC-qPCR方法的建立及验证 2.2.1 质粒DNA标准品的制备PRV的株系类别为Barthar株,gB为该株PRV的一个基因名称。参考GeneBank中Barthar株gB基因序列和相关文献报道,结合Gene Runner和Beacon Designer针对文献中设计的引物进行基本核验。选定文献中1组引物作为本实验研究用引物,其引物序列为:FP:5’-GTCACCTTGTGGTTGTTG-3’,RP:5’-CCACATCTACTACAAGAACG-3’,扩增片段长180 bp[14]。将该扩增片段的电泳产物回收纯化后连接到pMDTM18-T克隆载体进行克隆。阳性克隆通过qPCR进行初步鉴定。培养阳性克隆并提取质粒DNA,用酶标仪测定质粒DNA浓度及纯度。阳性质粒DNA通过测序进一步鉴定。
2.2.2 qPCR扩增体系用Takara公司TB Premix Ex TaqⅡ kit的试剂进行荧光定量PCR检测,其反应体系:Premix 10 μL,上、下游引物各0.2 μL(20 pmol·μL-1),无DNA/RNA酶的水7.6 μL,模板DNA 2 μL。反应条件为95 ℃预变性30s;扩增:95 ℃10 s、60 ℃20 s、72 ℃10 s、循环数40;溶解:95 ℃10 s、60 ℃60 s、95 ℃10 s。
2.2.3 标准曲线的线性范围、检测下限、定量下限按公式计算质粒DNA标准品的拷贝数[copies=(质量/相对分子质量)×6.02×1023][15],将其10倍系列稀释,取1.0×100~1.0×108 copies·μL-1的质粒DNA标准品,每个浓度3个复孔,考察方法的检测下限和定量下限。用1.0×103~1.0×108 copies·μL-1的PRV质粒DNA标准品进行测定,并以DNA拷贝数的对数值与所得的Ct值绘制标准曲线,确定最佳线性范围、检测下限和定量下限。
2.2.4 特异性试验将1.0×106 copies·μL-1的PRV质粒DNA、PK15细胞DNA和ATCC 9372菌DNA(作为阴性对照)作为模板,用本研究使用的PRV特异性引物进行扩增,验证荧光定量检测方法的特异性,每个样品设3个重复。
2.2.5 重复性试验选用1×108、1×107、1×106、1×105 copies·μL-1的质粒DNA标准品,进行同一次实验多个重复和不同次实验间的重复性考察,评价方法的重复性。
2.2.6 PRV接种收获时间的优化结合PRV在单层细胞培养上的隐蔽期3~6 h、对数生长期17 h[16],确定PRV接种后全部进入细胞但未扩增的收样时间点,即:设定接种后1、2、3、4、6、12、24 h。将PK15细胞以每孔1.0×105个接种于细胞培养板,培养24 h后弃掉培养液,PBS漂洗1次,接种PRV活病毒,每个时间点3个重复。以无血清培养液代替PRV接种作为正常细胞对照;以高温高压灭活的PRV病毒接种作为阴性对照。将染毒细胞置37 ℃孵育,期间每隔15 min轻摇数次,使病毒充分接触并进入细胞。根据实验计划,于接种后不同时间点弃除接种液,PBS漂洗5次,充分清洗除去细胞外病毒。收取清洗后染毒细胞样品置-70 ℃备用。检测前将细胞反复冻融3次。按照DNeasy® Blood & Tissue Kit操作说明提取各组细胞或细胞及病毒DNA,置于-20 ℃待测。
2.2.7 ICC-qPCR法检测不同滴度病毒将PRV病毒稀释成滴度为每毫升8、7、6、5、4、3、2、1、0、-1、-2 logs·mL-1的病毒液接种细胞,按照“2.2.6”项下确定的最佳接种收获时间,收获细胞后反复冻融3次,并按照DNeasy® Blood & Tissue Kit操作说明提取细胞及病毒DNA,置于-20 ℃待测。以此考察PRV病毒滴度数据与核酸拷贝数检测数据的关联性。
2.3 复用电生理导管环氧乙烷病毒灭活工艺验证 2.3.1 污染物负载基于电生理导管的物理特征、临床应用、污染物的特性,参照美国材料与试验协会(American Society for Testing and Materials,ASTM)标准,选择全血试验污染物(枸橼酸化绵羊全血100 mL、小牛血清50 mL、生理盐水50 mL,使用前加入2 mol·mL-1CaCl2 0.01 mL)[17]。将高滴度的PRV病毒加入到全血试验污染物中制备含有PRV病毒全血试验污染物。使用12根无菌实心电生理导管,通过测量实验污染用导管轴的长度(L)和直径(2r)(游标卡尺测定),计算实验污染导管的近似表面积(S=2πrL)约为12.05 cm2。将电生理导管前端10 cm部分浸泡入模拟污染物1 h,然后取出自然晾干4 h。实验设定4组,每组平行3根导管,具体分组如下:
空白对照组:3根导管不经任何处理,提取空白导管清洗液作为空白对照;
阴性对照组:用不含病毒的全血试验污染物负载3根导管,用于提取污染物作为阴性对照;
零时组:用含病毒全血试验污染物负载3根导管,用于病毒灭活前的零时对照;
病毒灭活组:用含病毒全血试验污染物负载3根导管后,用既定的环氧乙烷灭菌工艺灭菌,检测活病毒降低量或滴度。
2.3.2 环氧乙烷灭菌在模拟污染物负载并晾干后,将负载污染物的电生理导管单个置于环氧乙烷包装袋内,放入灭菌生物指示卡并密封。使用环氧乙烷灭菌柜进行环氧乙烷灭菌。灭菌条件:温度55 ℃;相对湿度60%;环氧乙烷浓度500 mg·L-1;灭菌时间7 h;排残次数5次,每15 min排除残留环氧乙烷气体1次。
2.3.3 样品提取用无血清培养液1 mL清洗提取灭菌后的各组导管前端10 cm的样品,重复3次,提取液合计为3 mL。
2.3.4 ICC-qPCR法验证病毒灭活有效性将“2.3.3”项下提取的各组样品,接种于单层PK15细胞,按照确定的最佳PRV接种收获时间收获细胞,反复冻融3次,按照DNeasy®Blood & Tissue Kit操作说明提取各样品细胞或细胞及病毒DNA,置-20 ℃待测。按照“2.2”项下建立的ICC-qPCR方法进行检测。
2.3.5 CPE法验证病毒灭活有效性与ICC-qPCR法并行,用相同的各组样品各1 mL进行10倍梯度稀释,至少稀释10个浓度,按照“2.1.2”项下方法进行滴定。培养3 d左右后在倒置显微镜下观察并记录细胞病变情况。按Reed-Muench方法[13]计算各组样品每毫升的logs。
3 结果 3.1 PRV病毒液制备与滴定PRV病毒接种48 h后能明显看到大多数细胞圆缩、散落(图 1),细胞病变最为明显的时期为48~96 h,此时维持液中病毒含量高并且稳定。收取培养72 h的病毒液,置-70 ℃备用。病毒液制备后,于不同时间点测定冻存的PRV病毒滴度,PRV病毒每毫升平均滴度为11.6 logs·mL-1。

|
A.正常PK15细胞(normal PK15 cell) B. PRV感染PK15细胞(PK15 cell inoculated with PRV) 图 1 PRV感染PK15细胞引起的细胞病变效应(放大倍数×100倍) Fig.1 Cytopathogenic effects of PK15 cell inoculated with PRV(magnification ×100, bar=100 μm) |
用含有目的片段的质粒DNA标准品,系列的浓度:1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103 copies·μL-1作为模板进行荧光定量PCR反应。扩增曲线各稀释度间距均匀,线性范围为1.0×104~1.0×108 copies·μL-1,检测下限为1.0× 103 copies·μL-1,定量下限为1.0×104 copies·μL-1,以Ct值为纵坐标,以浓度为横坐标绘制标准曲线(见图 2):
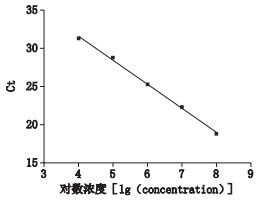
|
图 2 ICC-qPCR标准曲线 Fig.2 Standard curve of ICC-qPCR |
Y=-3.132X+44.09 r2=0.996 9
说明相关性较好,可进行有效定量,斜率为-3.13(在-3~-3.5之间),扩增效率Eff为108.68%(90%~110%之间)。
3.2.2 特异性试验特异性试验结果表明除PRV质粒DNA有扩增外,其他DNA模板均无扩增,说明本实验方法检测PRV具有较好的特异性。
3.2.3 重复性试验4个不同浓度质粒DNA标准品同1次试验的3次重复检测和3次不同实验的重复检测结果见表 1,其RSD < 5%,说明方法的重复性较好。
|
|
表 1 重复性检测结果 Tab.1 The results of repeatability testing |
按照建立的荧光定量PCR方法,对细胞染毒后不同收样时间的样品进行检测。各组测定结果表明24 h内正常细胞对照和高温高压蒸汽灭活PRV样品无病毒核酸检出,证明不会检测到死病毒DNA,可以排除死病毒的干扰。接种PRV后1、2、3 h病毒DNA检测结果无显著性差异,接种后4~24 h病毒DNA量急剧增加,与1、2、3 h相比有显著性差异(P < 0.05,P < 0.01)(图 3)。因此,确定PRV收样时间为病毒接种后1~2 h。

|
*. P < 0.05 **. P < 0.01 图 3 PRV接种时间依存性对数增长曲线(n=3) Fig.3 Growing curve of PRV with inoculation time-dependent manner in lg(concentration) |
将病毒滴度(4~8 logs·mL-1)与病毒DNA检测值(copies·mL-1)的对数做线性回归分析,结果显示ICC-qPCR检测DNA的每毫升拷贝数对数与病毒滴度(logs·mL-1)具有良好的线性关系,线性方程(见图 4):
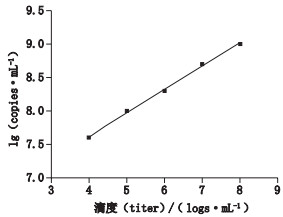
|
图 4 CPE法检测病毒滴度与ICC-qPCR法检测DNA拷贝数之间的线性关系 Fig.4 The linear relationship between virus titer and viral DNA copiesdetected by ICC-qPCR method |
Y=0.349X+6.224 r2=0.998
因此,可以据此将ICC-qPCR法检测的病毒DNA拷贝数推算成病毒滴度。
ICC-qPCR方法测定病毒DNA结果显示,当PRV病毒滴度≥-1 logs·mL-1时,PRV DNA均可检出,当PRV病毒滴度 < -1 logs·mL-1时,未检出PRV DNA。即:ICC-qPCR方法的检测下限为-1 logs·mL-1,明显低于CPE法(-0.5 logs·mL-1)。因此,说明ICC-qPCR方法较CPE法灵敏。
3.3 电生理导管环氧乙烷病毒灭活工艺验证结果 3.3.1 ICC-qPCR法病毒灭活验证结果含病毒全血污染物负载到导管中零时组的PRV拷贝数约106 copies·μL-1(约相当于8~9 logs·mL-1);环氧乙烷工艺后各导管可检出PRV病毒,但PRV拷贝数均低于本方法的定量下限(104 copies·μL-1,约相当于2 logs·mL-1);阴性对照组和空白对照组均未检出PRV。本方法的检测下限为103 copies·μL-1(约相当于-1 logs·mL-1),因此,病毒滴度下降≥9.0 logs·mL-1。具体结果见表 2。
|
|
表 2 ICC-qPCR法病毒(PRV)灭活验证结果 Tab.2 PRV inactivation validation results via ICC-qPCR method |
利用CPE法观察细胞病变,计算环氧乙烷病毒灭活工艺后病毒滴度降低量。零时组和病毒灭活组在培养2 d后,细胞出现明显病变。而阴性对照组及空白导管组在滴定培养3~5 d的过程中均未出现细胞病变。
本实验中CPE法的检测下限为-0.5 logs·mL-1。电生理导管中负载的生物模拟污染物中PRV经环氧乙烷工艺后,病毒滴度下降了≥8.5 logs·mL-1(见表 3)。
|
|
表 3 CPE法病毒(PRV)灭活验证结果 Tab.3 PRV inactivation validation results via CPE method |
本研究中针对PRV建立的ICC-qPCR方法可以有效地检测病毒灭活工艺后的残留PRV活病毒。其定量下限为104 copies·μL-1(约相当于CPE方法的2 logs·mL-1),检测下限为103 copies·μL-1(约相当于CPE方法的-1 logs·mL-1)。比传统CPE法(检测下限为-0.5 logs·mL-1)灵敏度高,可避免人为主观因素对结果判断的影响,且节省时间和实验成本。
据文献报道,RYU等人多次利用腺病毒研究了ICC-qPCR方法在病毒灭活有效性验证中的适用性,并与CPE法比较后认为ICC-qPCR方法与CPE法的灵敏度相当,但ICC-qPCR方法更简便快捷,可以作为病毒灭活研究中CPE法的替代方法[1, 7-8, 10]。本研究中所建立的针对伪狂犬病毒(PRV)的ICC-qPCR方法,其检测病毒滴度的检测下限为-1 logs·mL-1,而CPE法的检测下限为-0.5 logs·mL-1,因此,本研究建立的ICC-qPCR方法比传统的CPE法的灵敏度高,方法简便快捷,显示了作为病毒灭活研究中CPE法替代方法的优势。RYU等人认为腺病毒与单层细胞孵育1 d足以量化感染性病毒,但不同细胞系对不同病毒具有不同程度的敏感性。因此,对于不同细胞和病毒,ICC-qPCR必须针对接种后孵育时间进行优化[1, 7-8, 10]。本研究建立的ICC-qPCR方法,其PRV病毒与单层细胞孵育1~2 h即可保证病毒完全进入细胞且无明显扩增。因此,ICC-qPCR方法可以作为病毒灭活研究中CPE法的补充方法。后期经过充分验证和标准化后有望作为CPE法的替代方法。
本研究中CPE法病毒灭活验证结果表明经环氧乙烷灭活后的病毒负载导管其病毒滴度降低 > 8.5 logs·mL-1,而ICC-qPCR结果表明其病毒滴度降低 > 9.0 logs。在《动物源医疗器械注册审查指导原则》中规定,病毒灭活验证结果应满足其病毒滴度降低≥6 logs·mL-1。复用电生理导管是经过临床使用后清洗消毒的产品,曾经接触过病人的血液或者组织液,因此是类似于动物源医疗器械的生物源污染的产品,其病毒灭活验证的要求可以参考动物源医疗器械的要求。本验证结果显示,CPE法和ICC-qPCR法均说明电生理导管的环氧乙烷工艺是有效的病毒灭活工艺。2种方法相互印证,充分证明了工艺有效性。
截止目前,中国对一次性使用电生理导管等一次性使用医疗器械的复用研究比较少[18]。本研究仅仅针对一次性使用实心电生理导管进行了环氧乙烷病毒灭活工艺的研究。为进一步评估该类器械复用的风险,需要针对拟复用的器械和拟采用的病毒灭活工艺进行验证,并结合复用器械的各项物理、化学和生物性能的全面检测,以及其他安全性和临床使用性等进行全面的风险评估。
| [1] |
RYU H, CASHDOLLAR JL, FOUT GS, et al. Applicability of integrated cell culture quantitative PCR(ICC-qPCR)for the detection of infectious adenovirus type 2 in UV disinfection studies[J]. J Environ Sci Health, Part A, 2015, 50(8): 777. DOI:10.1080/10934529.2015.1019795 |
| [2] |
KO G, CROMEANS TL, SOBSEY MD. Detection of infectious adenovirus in cell culture by mRNA reverse transcription-PCR[J]. Appl Environ Microbiol, 2003, 69(12): 7377. DOI:10.1128/AEM.69.12.7377-7384.2003 |
| [3] |
KO G, CROMEANS TL, SOBSEY MD. UV inactivation of adenovirus type 41 measured by cell culture mRNA RT-PCR[J]. Water Res, 2005, 39(15): 3643. DOI:10.1016/j.watres.2005.06.013 |
| [4] |
KO G, JOTHIKUMAR N, HILL VR, et al. Rapid detection of infectious adenoviruses by mRNA real-Time RT-PCR[J]. J Virol Meth, 2005, 127(2): 148. DOI:10.1016/j.jviromet.2005.02.017 |
| [5] |
DI GD, LECHEVALLIER MW. Quantitative-PCR assessment of cryptosporidium parvumcell culture infection[J]. Apple Environ Microbiol, 2005, 71(3): 1495. DOI:10.1128/AEM.71.3.1495-1500.2005 |
| [6] |
LEE C, LEE SH, HAN E, et al. Use of cell culture-PCR assay based on combination of A549 and BGMK cell Lines and molecular identification as a tool to monitor infectious adenoviruses and enteroviruses in river water[J]. Appl Environ Microbiol, 2004, 70(11): 6695. DOI:10.1128/AEM.70.11.6695-6705.2004 |
| [7] |
RYU H, GERRITY D, CRITTENDEN J, et al. Photocatalytic inactivation of cryptosporidium parvum with TiO2 and low-pressure ultraviolet irradiation[J]. Water Res, 2008, 42(6-7): 1523. DOI:10.1016/j.watres.2007.10.037 |
| [8] |
GERRITY D, RYU H, CRITTENDEN J, et al. UV inactivation of adenovirus type 4 measured by integrated cell culture qPCR[J]. JEnviron Sci Health Part A, 2008, 43(14): 1628. DOI:10.1080/10934520802329919 |
| [9] |
LI D, GUA Z, HE M, et al. UV inactivation and resistance of rotavirus evaluated by integrated cell culture and real-Time RTPCR assay[J]. Water Res, 2009, 43(14): 3261. |
| [10] |
MAYER B, RYU H, GERRITY D, et al. Development and validation of an integrated cell culture-qRTPCRassay for simultaneous quantification of coxsackieviruses, echoviruses, and polioviruses in disinfection studies[J]. Water Sci Technol, 2010, 61(2): 375. DOI:10.2166/wst.2010.818 |
| [11] |
MARINIF C, KORNBL AU. Production and culture of HSVtk transduced suicidal lymphocytes induces variable changes in the lymphocyte subset composition[J]. Bone Marrow Transplant, 1999, 23(9): 907. DOI:10.1038/sj.bmt.1701738 |
| [12] |
LEMOLI RM, BERTOLINI F, PETRUCCI MT, et al. Functional and kinetic characterization of granulocyte colony-stimulating factorprimed CD34-human stem cells[J]. Br J Haematol, 2003, 123(4): 720. DOI:10.1046/j.1365-2141.2003.04673.x |
| [13] |
黄祯祥, 洪涛, 刘崇柏, 等. 医学病毒学基础及实验技术[M]. 北京: 科学出版社, 1990: 120. HUANG ZX, HONG T, LIU CB, et al. Medical Virology Basics and Experimental Techniques[M]. Beijing: Science Press, 1990: 120. |
| [14] |
高嘉聪, 叶超, 赵款, 等. 猪源伪狂犬病病毒gB基因SYBR Green Ⅰ实时荧光定量PCR检测方法的建立[J]. 中国兽医科学, 2015(11): 1166. GAO JC, YE C, ZHAO K, et al. Development of a SYBR Green Ⅰ real-time PCR for detection of gB gene of pseudorabies virus in swine[J]. Chin Veter Sci, 2015(11): 1166. |
| [15] |
于春梅, 刁有祥, 唐熠, 等. 坦布苏病毒荧光定量RT-PCR方法的建立[J]. 中国农业科学, 2012, 45(21): 4492. YU CM, DIAO YX, TANG Y, et al. Fluorescence quantitative RTPCR assay for detection of tembusu virus[J]. Sci Agric Sin, 2012, 45(21): 4492. DOI:10.3864/j.issn.0578-1752.2012.21.018 |
| [16] |
殷震, 刘景华. 动物病毒学[M]. 北京: 科学出版社, 1997: 988. YIN Z, LIU JH. Animal Virology[M]. Beijing: Science Press, 1997: 988. |
| [17] |
ASTM F3208-17 Standard Guidefor Selecting Test Soils for Validation of Cleaning Methods for Reusable Medical Devices[S]. 2018
|
| [18] |
管晓东, 张慕禹, 陈哲, 等. 国内外一次性医疗器械重复使用管理政策现状研究[J]. 中国药房, 2015, 26(25): 3469. GUAN XD, ZHANG MY, CHEN Z, et al. Study on the management policy situation of the re-use of single-use device at home and abroad[J]. China Pharm, 2015, 26(25): 3469. DOI:10.6039/j.issn.1001-0408.2015.25.05 |
 2019, Vol. 39
2019, Vol. 39 
