乙酰胆碱酯酶(acetylcholinesterase,AChE)是一种位于胆碱能突出间隙催化水解神经递质乙酰胆碱的关键性酶[1],可造成乙酰胆碱缺失或活性降低,导致神经信号传递失败,从而引起阿兹海默症[2](Alzheimer’s disease,AD)等疾病。随着“胆碱能假说”[3]的提出,利用AChE抑制剂阻止突触间隙内乙酰胆碱的降解,成为近年来设计治疗AD用药的主要机理之一[4]。因此建立AChE抑制剂体外筛选模型,筛选高效价、低副作用的抑制剂对临床治疗AD具有重大意义[5]。而如何获得高纯度和高活性的AChE对于其抑制剂筛选尤为关键[6]。
人们长期利用重组表达的大鼠AChE开展抑制剂筛选研究。近年来,学者们开始运用重组人乙酰胆碱酯酶(recombinant human acetylcholinesterase,rhAChE)开展相关研究[7],以避免一系列不利因素的影响,更符合临床实际[8],从而更具研究和应用价值。目前只有少量的天然AChE抑制剂被发现,因此构建高效的rhAChE体外筛选模型,探寻植物源的AChE抑制剂也成为治疗AD的重要途径。本研究通过优化rhAChE制备方案,建立起rhAChE体外筛选模型,并开展了相关中药化合物的初步筛选,为探寻具潜在活性的天然药物治疗AD提供一种高通量的筛选模型。
1 仪器与材料SW-CJ-2FD HS-840D超净工作台(苏州净化公司);AC2-4S1-CN生物安全柜(ESCO公司);MCO-18AC二氧化碳培养箱(三洋公司);Multiskan,FC酶标仪(Thermo公司);DMI-3000B倒置显微镜(Leica公司);Trans-Blot半干转膜仪(Bio-Rad公司);PAGE电泳仪,Mini-PROTEAN Tetra C电泳槽(Bio-Rad公司);5427R台式高速冷冻离心机、移液器(Eppendorf公司);HHW-420恒温水浴锅(常州市仪都仪器有限公司);WTL掌式离心机(湖南湘仪仪器公司);ME204E精密电子天平(METTLER公司);Direct8 Mill-Q纯水仪(Millipore公司);YXQ-LS-S2灭菌锅(济南思卓医疗器械厂);303-3恒温培养箱(常州恒隆仪器有限公司);ZWY-2102C恒温摇床(上海百典仪器设备有限公司);馏分收集CBS-A程控全自动部分收集器(上海沪西分析仪器厂)。
HEK293细胞系(人胚肾293细胞,浙江大学药学院陈枢青教授赠送);pCMV-AChE质粒(浙江大学药学院陈枢青教授赠送);大肠杆菌菌株Escherichia coli DH5α(本实验室保存);Amp(Amresco公司);琼脂糖(Biowest公司);酵母提取物、胰蛋白胨(OXIOD公司);DMEM高糖培养基(Gibco公司);LipofectamineTM2000,β-巯基乙醇(Invitrogen公司);质粒提取试剂盒(Axygen公司);胎牛血清(PAA公司);5 mL规格细胞培养瓶、100 mm细胞培养皿(Corning公司);96孔培养板(Costar公司);碘化硫代乙酰胆碱(Fluka公司);DTNB、SDS、TEMED(Sigma公司);DNA Marker(Fermentas公司);PVDF膜(Sattle膜材公司);阴离子交换柱(DEAE-Sepharose Fast Flow)亲和层析柱(Amersham Pharmacia公司);Anti-AChE antibody、Goat anti rabbit IgG、ECL发光试剂盒、Tris-HCl粉剂(上海生工生物工程有限公司);多奈哌齐(批号30178359,98%,上海皓元科技公司);透析袋(相对分子质量14×103,南京森贝伽生物科技有限公司);蛋白标准品(14.3×103~97.2××103,杭州纽龙生物科技有限公司);小檗碱、血根碱、蛇根碱(B21379、B21379、B20722,上海源叶生物科技有限公司)。
2 实验方法 2.1 质粒表达系统构建制备感受态细胞E.coli DH5α,将pCMV-AChE转化至感受态细胞E. coli DH5α,加入LB培养基800 μL摇床培养1 h,3 000 r·min-1离心15 min,取上清液,LB培养基50 μL重悬后平铺至LB培养板上,37 ℃培养倒置培养过夜;次日挑取单菌落放入LB培养基中,37 ℃摇床过夜,次日抽提质粒。
2.2 pCMV-AChE表达质粒转染及rhAChE粗酶液提取 2.2.1 HEK293细胞培养培养条件:37 ℃、5%CO2、饱和湿度、10%胎牛血清、100 U·mL-1青霉素、100 mg·L-1链霉素、DMEM培养基、0. 25%胰蛋白酶,2~5 d消化传代。
2.2.2 pCMV-AChE质粒转染细胞细胞接种:取对数期生长的HEK293细胞1×106个·mL-1接种至100 mm培养皿中,每个培养皿加入完全培养基10 mL,待细胞生长至70%~80%,即可转染。
细胞转染:取pCMV-AChE质粒5 μg加入无血清培养基500 μL中,并加入LipofectamineTM2000转染试剂20 μL,混匀后静置15~20 min,配制成转染液;取出HEK293细胞弃去培养基,加入无血清培养基5 mL、转染液1 mL,摇匀,培养5 h后取出,弃去培养液,加完全培养基10 mL,培养箱继续培养。
2.2.3 粗酶液获取HEK293细胞转然后培养24 h,弃去培养液,加入pH 7.4的磷酸盐缓冲溶液(PBS) 2 mL冲洗,弃去,加入无血清培养基10 mL,培养24 h,收集培养基,即为粗酶液。
2.2.4 rhAChE活性测定采用改进的Ellman方法[8]检测。使用96孔培养板,反应体系中加入pH为7.4的PBS 80 μL、粗酶液20 μL、0.1%的DTNB 50 μL,混匀,置于37 ℃培养箱孵育8 min,取出,加入0.5 mmoL·L-1底物碘化硫代乙酰胆碱(ATCh)50 μL,37 ℃孵育18 min,3% SDS 50 μL终止反应,412 nm处测定其吸收度。阴性对照,加入pH为7.4的PBS 30 μL、收集的粗酶液20 μL、0.1% DTNB 50 μL、3% SDS 50 μL,孵育8 min,加入底物ATCh (0.5 mmol·L-1) 50 μL,孵育18 min,加入pH为7.4的PBS 50 μL,412 nm下测定吸收度。
2.3 rhAChE的分离纯化 2.3.1 透析使用分子截止量大小为14×103的透析袋对rhAChE粗酶液进行透析。纯水煮沸60 min,去除杂质。透析袋内加入待纯化粗酶液40 mL,扎紧。放入0.02 mol·L-1 Tris-HCl溶液400 mL中,磁力搅拌4 ℃透析过夜,期间更换3次Tris-HCl溶液。透析后放入聚乙二醇中吸水浓缩,调节pH至7.4,即为上样液,-20 ℃保存。
2.3.2 DEAE-Sepharose FF柱纯化装柱:取50 mL柱子,装凝胶液30 mL,20%乙醇清洗,0.02 mol·L-1 Tris-HCl溶液10 mL平衡,最终柱床体积约20 mL。
上样:0.02 mol·L-1、pH 7.4的Tris-HCl缓冲液平衡100 mL,酶液上样40 mL。
洗脱:0.02 mol·L-1pH 7.4 Tris-HCl溶液梯度洗脱,氯化钠溶液浓度从0~0.4 mol·L-1,洗脱液共400 mL。
收集:馏分收集器每管收集4 mL,即得纯化液。
2.3.3 rhAChE活性检测步骤同“2.2.4”,比较粗酶液和纯化酶液活性。结果见表 1。
|
|
表 1 纯化前后蛋白酶活性对比 Tab.1 Enzymatic activity contrast before and after purification |
按照BCA试剂盒说明书操作(试管法)。将BSA标准品(2 mg·mL-1,试剂盒自带)分别配制成质量浓度为1、0.5、0.25、0.125、0.006 25 mg·mL-1等溶液。将试剂A和试剂B按50:1配制成BCA工作液,混匀。取标准品溶液和待测纯化液样品分别加入96孔板中,每孔20 µL(3组重复),每孔加入200 µL BCA工作液,37 ℃放置25 min。570 nm处测定吸收度A,建立标准曲线,测定蛋白浓度。
2.3.5 Western blot鉴定5%浓缩胶和10%分离胶SDS-PAGE电泳,考马斯亮蓝染色,观察蛋白纯化效果;Western blot验证蛋白,通过半干转膜法将目的蛋白转至PVDF膜上,脱脂奶粉封闭,抗体孵育,采用ECL发光法鉴定。
2.4 rhAChE活性测定条件优化采用改进的Ellman法测定rhAChE酶的活性,步骤同“2.2.4”项,分别测定不同底物浓度、反应时间及酶浓度的酶活性变化。
2.4.1 底物浓度对rhAChE酶活性的影响酶浓度为0.05 mg·mL-1和0.1 mg·mL-1,碘化硫代乙酰胆碱配制成0、50、100、200、400、800、1 600、3 200、6 400 μmol·L-1的浓度,测定酶活性。
2.4.2 反应时间及不同AChE浓度对酶活性的影响碘化硫代乙酰胆碱浓度为6 400 μmol·L-1,AChE稀释为15.625、31.25、62.5、125、250、500、1 000、2 000 mg·mL-1,测定酶活性;反应时间设置为10、15、20、25、30、60、120 min,测定酶活性。
2.5 rhAChE筛选模型建立及中药筛选96孔板中加入纯化液4 μL、酶抑制剂20 μL、DTNB(0.1%)50 μL,pH 7.4 PBS补足至150 μL,摇床混匀,37 ℃孵育6 min,加入0.5 mmol·L-1 ATCh 50 μL,继续孵育16 min,最后加入3%SDS终止反应(n=3)。412 nm下检测吸收度A,计算化合物的酶抑制率,以摩尔浓度的负对数和酶抑制率进行线性回归,求出IC50值,作为天然产物活性成分的抑制活性指标。
酶抑制率=(A0-AI)/A0,A0为未加抑制剂时的A412值,AI为抑制剂浓度为I时的A412值。
多奈哌齐是AChE的可逆性抑制剂,作为阳性对照,设置7个反应浓度:0、5、10、20、40、80、160 nmol·L-1,测定多奈哌齐的IC50值。
据文献报道和临床用药经验,选择小檗碱、血根碱和蛇根碱[9-10]3个化合物,纯度达到98%。依据预试结果确定7个不同浓度来测定化合物的IC50值,考察化合物的AChE抑制活性。
3 结果 3.1 rhAChE的表达系统建立检测pCMV-AChE质粒转染HEK293细胞和未转染HEK293细胞的酶活性(图 1),结果显示转染pCMV-AChE质粒组有较高的酶活性。实验结果表明pCMV-AChE转染HEK293细胞可实现对rhAChE的分泌表达。

|
1.转染后(after being transfected) 2.未转染(without being transfected) 图 1 转染pCMV-AChE的HEK293细胞上清液的酶活 Fig.1 Enzymatic activity of supernatant of HEK293 with pCMV-AChE |
体外表达的rhAChE粗酶液经DEAE-Sepharose FF阴离子交换柱纯化后,检测酶活性和蛋白浓度,结果如图 2所示。
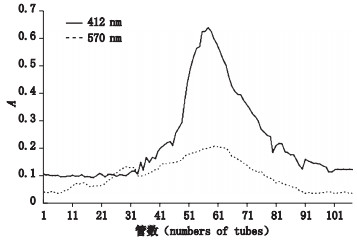
|
图 2 粗酶液经DEAE-Sepharose FF阴离子交换柱洗脱后的酶活性(412 nm)和蛋白浓度(570 nm) Fig.2 rhAChE protease activity (412 nm) and protein concentration (570 nm) after the crude enzyme solution was eluted through DEAE-Sepharose FF affinity chromatography column |
检测每管馏分酶活,根据酶活力测定结果绘制折线图。图 2表明,氯化钠溶液浓度的增加,rhAChE的活性在第35管起出现;第60管酶活达到最高;随后酶活性逐渐下降,第97管活性下降至背景A;1 mol·L-1氯化钠溶液冲洗,收集检测酶活性,未检测到乙酰胆碱酯酶活性。
检测每管馏分蛋白浓度,根据蛋白浓度结果绘制折线图。图 2表明,氯化钠溶液浓度的增加,蛋白逐渐被洗脱下来,第15管馏分出现第1个蛋白峰;第30管处出现第2个蛋白峰;第60管处出现第3个蛋白峰,并达到浓度最大。图 2显示,第3个蛋白峰的出峰位置和乙酰胆碱酯酶活性出峰位置重合,且酶活性最高处与蛋白浓度最高处一致。由于洗脱液中蛋白浓度较低,故冻干浓缩后再测定。
3.3 Western blot结果 3.3.1 SDS-PAGE上样组分别为空白组(无质粒转染组)、转染组、蛋白标品及纯化后蛋白。SDS-PAGE结果(见图 3)表明,标准品、纯化后蛋白与转染组大量表达蛋白大小一致,分子量约为68×103 g·mol-1。实验结果可证明,转染组大量表达蛋白、纯化蛋白和标准品的蛋白分子量一致,即该蛋白为乙酰胆碱酯酶。
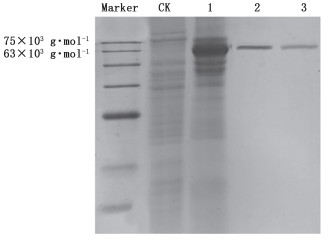
|
1.转染组(transfection group) 2.蛋白标准品(protein standard) 3.纯化后蛋白(purified protein) 图 3 SDS-PAGE凝胶电泳图 Fig.3 SDS-PAGE Gel electrophoresis |
将标准品及纯化蛋白2个样品,重新跑胶和进行Western blot实验,上样量为10 μg,实验结果见图 4。研究同样证实了纯化后的蛋白即为乙酰胆碱酯酶。

|
1.蛋白标准品(protein standard) 2.纯化后目的蛋白(purified protein) 图 4 Western blot结果 Fig.4 The result of Western blot |
分别以0、50、100、200、400、800、1 600、3 200、6 400 μmol·L-1不同浓度的ATCh为底物,检测rhAChE在不同底物浓度下的酶活性,结果见图 5。实验结果表明,反应条件一致情况下,随着底物浓度的增加,酶解反应速率也相应上升,且当底物浓度为6 400 μmol·L-1时依旧呈上升趋势。可推测在一定范围内,底物浓度与rhAChE酶活性呈正比例关系。结果见表 2。
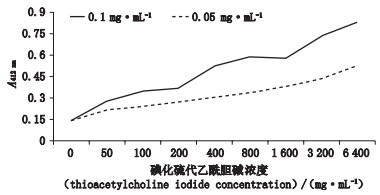
|
图 5 底物浓度对纯化液rhAChE活性的影响 Fig.5 Effect of ATCh concentration on activity of purified rhAChE |
|
|
表 2 rhAChE时间浓度折线图线性关系 Tab.2 The linear relationship of the line graph of rhAChE time-concentration relationship |
分别测定15.625、31.25、62.5、125、250、500、1 000、2 000 mg·mL-1 rhAChE,反应10、15、20、25、30、60、120 min时的活性,其他反应条件一致,结果见图 6。图 6显示,当rhAChE质量浓度小于250 mg·mL-1时,酶活性随着反应时间和酶浓度的增加而增加;但当rhAChE质量浓度大于250 mg·mL-1时,酶活性达到饱和,即使反应时间和酶浓度变化而酶活不变,且有下降趋势。

|
图 6 乙酰胆碱酯酶浓度、时间对纯化rhAChE活性的影响 Fig.6 Effect of concentration time on activity of purified rhAChE |
由图 6可知,酶活性达到饱和之前,其线性范围随着反应时间的增加而上升;但在反应时间为15~20 min期间,rhAChE浓度与412 nm下的A线性关系最好,故选择15~20 min作为酶活检测反应时间,可保证酶活性浓度在250 mg·mL-1内与A有良好的线性关系。
3.5 rhAChE抑制剂筛选模型的建立及其抑制剂的筛选多奈哌齐作为乙酰胆碱酯酶的可逆性抑制剂,可作阳性药。粗酶液中多奈哌齐的IC50值为14 nmol·L-1;多奈哌齐对rhAChE纯化液抑制率的IC50值见表 3。
|
|
表 3 3个化合物对纯化液rhAChE的IC50值 Tab.3 IC50 values of three compounds for rhAChE of purified liquid |
据预实验的结果,选择小檗碱、血根碱和蛇根碱测定其对纯化后的rhAChE抑制率,计算出3种中药单体对纯化液rhAChE的IC50值,结果同见表 3。
小檗碱、血根碱和蛇根碱是依据AD疾病的治疗经验来选择,它们的分子结构式与多奈哌齐非常相似。实验结果表明,小檗碱、血根碱和蛇根碱对rhAChE均表现为一定的抑制效果。其中,小檗碱的IC50值最为接近多奈哌齐。同时,多奈哌齐对rhAChE纯化液的IC50值为5 nmol·L-1,低于多奈哌齐对粗酶液的IC50值(14 nmol·L-1)。由此可见,纯化后rhAChE相较于粗酶液具更高纯度及活性,并较为成功地构建了rhAChE抑制剂体外筛选模型。
4 讨论HEK293细胞表达系统作为rhAChE获得及其结构、功能等研究最常用的表达系统,可以快捷、高效、简便的获得和人体相似的rhAChE,并能翻译后加工和表达具有生物活性的外源蛋白[11]。真核细胞所表达的rhAChE的生物活性与人AChE性质接近,也是体外rhAChE的获得及其抑制剂筛选研究的重大突破,对AD药物的研究有积极的影响[12]。
随着“胆碱能学说”的提出,人们不断在探寻新的AChE抑制剂以治疗AD[13-14]。最近研究表明,在天然产物中寻求副作用小、作用面广、适宜长期服用等特点的AChE抑制剂已经成为相关领域研究的热点之一[15]。植物来源广泛,药效丰富,可利用价值高,值得更深入地考察有抑制AChE活性的植物单体或新型结构衍生物,发掘更高效、更低毒、作用更强的抗AD药物[16]。本研究基于现有资源,考察了3种天然产物小檗碱、血根碱和蛇根碱的AChE酶活性抑制作用。小檗碱是黄连生物碱的有效成分之一,已有研究证明其可以抑制许多组织中AchE的活性,也有学者采用生物信息模拟技术结合生物学效应,研究小檗碱与AchE受体的相互作用[17];血根碱是一种苯菲啶异喹啉类生物碱,主要存在于罂粟科、芸香科等植物中,具有抗菌、抗炎、抗肿瘤等作用,同时也可抑制AchE的活性[18];前期课题组研究发现蛇根碱作为长春花主要有效成分之一,也可抑制AchE活性,因此本实验选择了这3种小分子活性物质作为研究对象。
虽然体外重组蛋白质获取具有广阔的发展前进,但外源蛋白质在大肠杆菌中高效表达时常形成不可溶、无生物活性的蛋白质聚集物。主要是由于使用高剂量的基因和强启动子而导致高表达造成的,使表达蛋白不具有重组蛋白天然的空间结构从而失去了生物活性,故需要采用适宜的复性方法使重组蛋白进行正确的重折叠,重新获得生物活性。目前的蛋白复性的方法主要有稀释[19]、透析[20]、超滤、液相色谱[21]、反胶束等。因为实验后期还将继续优化rhAChE的纯化方法,怎样可以将AChE的纯化效率达到最高,不可避免的在AChE的粗提液中还混有各种不同来源的干扰性蛋白,因此纯化蛋白的复性研究将在后续开展。
综上所述,本研究运用转染pCMV-AChE的HEK293细胞表达系统成功获得rhAChE,并通过DEAE-Sepharose FF层析法获取纯度较高、活性较强的rhAChE。通过优化rhAChE活性的检测体系,成功建立了rhAChE体外抑制剂筛选模型,并利用该模型对天然化合物开展初筛。为rhAChE抑制剂的筛选和研究提供了一种更加便捷、有效的研究工具。
| [1] |
张千, 王取南. 乙酰胆碱酯酶生物功能的研究进展及其应用[J]. 国外医学(卫生学分册), 2008, 35(3): 143. ZHANG Q, WANG QN. Research progress and application of acetylcholinesterase biological function[J]. Foreign Med Sci(Sect of Hyg), 2008, 35(3): 143. |
| [2] |
DODART JC, MART RA. Gene delivery of human apoliopoprtein E alter brain Aβ burden in a mouse model of Alzheimer's disease[J]. Proc Nat Acad Sci USA, 2005, 102(4): 1211. DOI:10.1073/pnas.0409072102 |
| [3] |
SCHORDERET M. Alzheimer's disease:fundermental and therapeutic aspects[J]. Experientia, 1995, 51(2): 99. DOI:10.1007/BF01929348 |
| [4] |
张赟彬, 宋庆, 胡刘岩. 天然产物中乙酰胆碱酯酶抑制剂的研究现状[J]. 上海应用技术学院学报(自然科学版), 2011, 11(1): 1. ZHANG YB, SONG Q, HU LY. Research status of acetylcholinesterase inhibitors in natural products[J]. J Shanghai Inst Technol (Nat Sci), 2011, 11(1): 1. DOI:10.3969/j.issn.1671-7333.2011.01.001 |
| [5] |
MANIKANDAN K, GEERLOF A, SCHULDT L. Cloning, expression, purification, crystallization and prelmi inary X-ray diffraction analys is of the small subunit of isop ropylmalate isomerase(Rv2987c)from mycobacterium tuberculosis[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2009, 65: 136. DOI:10.1107/S1744309108042516 |
| [6] |
JAHNKE U. Therapeutic approaches for Alzheimer's disease[J]. Drugs, 2008, 11(1): 4. |
| [7] |
STRITTMATTER WJ. Old drug, new hope for Alzheimer's disease[J]. Science, 2012, 335(6075): 1447. DOI:10.1126/science.1220725 |
| [8] |
王向军, 吴怀秀, 叶珊珊, 等. 重组人乙酰胆碱酯酶的表达及其抑制剂的筛选[J]. 药学学报, 2014, 49(1): 50. WANG XJ, WU HX, YE SS, et al. Expression of recombinant human acetylcholinesterase and screening of its inhibitors[J]. Acta Pharm Sin, 2014, 49(1): 50. |
| [9] |
BERND I, EKKEHARD H. Acetylcholinesterase inhibition in alzheimer, s disease[J]. Curr Pharm Design, 2004, 10(3): 231. DOI:10.2174/1381612043386509 |
| [10] |
李进东. 银杏叶提取物对老年痴呆症大鼠学习空间学习记忆能力的影响[J]. 湖北中医杂志, 2013, 35(9): 26. LI JD. Effect of Ginkgo biloba extract on learning and memory ability in Alzheimer's disease rats[J]. Hubei J Tradit Chin Med, 2013, 35(9): 26. DOI:10.3969/j.issn.1000-0704.2013.09.014 |
| [11] |
WANG XJ, WU HX, YE SS, et al. Expression of recombinant human acetylcholinesterase and its application in screening its inhibitors[J]. Acta Pharm Sin, 2014, 49(1): 50. |
| [12] |
叶珊珊.孕烷X受体配体筛选模型与乙酰胆碱酯酶抑制剂筛选模型的构建[D].杭州: 浙江大学药学院, 2008 YE SS. Screening Model of Mregnane X Receptor Ligand and Construction of Screening Model for Acetylcholinesterase Inhibitor[D]. Hangzhou: College of Pharmaceutical Sciences, Zhejiang University, 2008 http://cdmd.cnki.com.cn/Article/CDMD-10335-2009053459.htm |
| [13] |
SZYMAŃSKI P, OLSZEWSKA P, MIKICIUKOLASIK E, et al. Novel tetrahydroacridine and cyclopentaquinoline derivatives with fluorobenzoic acid moiety induce cell cycle arrest and apoptosis in lung cancer cells by activation of DNA damage signaling[J]. Tumour Biol J Intern Socr Oncodevel Biol Med, 2017, 39(3): 1. |
| [14] |
NIU B, ZHANG M, DU P, et al. Small molecular floribundiquinone B derived from medicinal plants inhibits acetylcholinesterase activity[J]. Oncotarget, 2017, 8(34): 57149. |
| [15] |
张磊, 杨苏蓓. 老年痴呆症发病机制下的治疗药物研究[J]. 中国现代药物应用, 2010, 4(10): 238. ZHANG L, YANG SB. Study on therapeutic drugs under the pathogenesis of Alzheimer's disease[J]. Chin J Mod Drug Appl, 2010, 4(10): 238. DOI:10.3969/j.issn.1673-9523.2010.10.225 |
| [16] |
CASTILLO-ORDÓÑEZ WO, TAMAROZZI ER, DA SILVA GM, et al. Exploration of the acetylcholinesterase inhibitory activity of some alkaloids from Amaryllidaceae family by molecular docking in Silico[J]. Neurochem Res, 2017, 42(10): 2826. DOI:10.1007/s11064-017-2295-8 |
| [17] |
王晨, 谭政, 邹欣, 等. 生物信息模拟及生物学效应结合研究盐酸小檗碱对乙酰胆碱酯酶的抑制作用[J]. 华中科技大学学报(医学版), 2014, 43(5): 561. WANG C, TAN Z, ZOU X, et al. Biological information simulation and biological effects combined to study the inhibitory effect of berberine hydrochloride on acetylcholinesterase[J]. Acta Med Univ Sci Technol Huazhong, 2014, 43(5): 561. DOI:10.3870/j.issn.1672-0741.2014.05.016 |
| [18] |
李春梅, 郁建平. 血根碱对菜青虫几种代谢酶活性的影响[J]. 中国生物防治学报, 2013, 29(3): 463. LI CM, YU JP. Effects of radix on the activities of several metabolic enzymes of Pieris rapae[J]. Chin J Biol Control, 2013, 29(3): 463. |
| [19] |
王苹, 井健. 重组人膜联蛋白的尿激酶原融合蛋白衍生物的复性及制备[J]. 北京师范大学学报:自然科学版, 2012, 48(6): 626. WANG P, JING J. Refolding and preparation of prokaryotic fusion protein derivatives of recombinant human annexin[J]. J Beijing Normal Univ (Nat Sci), 2012, 48(6): 626. |
| [20] |
黄鹏煌, 王泽, 田海山, 等. 重组人成纤维细胞生长因子8b原核表达载体的构建和纯化研究[J]. 中国生物工程杂志, 2013, 33(1): 14. HUANG PH, WANG Z, TIAN HS, et al. Construction and purification of recombinant. human fibroblast growth factor 8b prokaryotic expression vector[J]. J Chin Biotechnol, 2013, 33(1): 14. |
| [21] |
GENG X, WANG L. Liquid chromatography of recombinant proteins and protein drugs[J]. Chromatogr B Anal Technol Biomed Life Sci, 2008, 866(1/2): 133. |
 2019, Vol. 39
2019, Vol. 39 
