2. 中国食品药品检定研究院, 北京 102629;
3. 国家纳米科学中心, 北京 100190;
4. 广东博溪生物科技有限公司, 广州 523808
2. National Institutes for Food and Drug Control, Beijing 102629, China;
3. National Center for Nanoscience and Technology, Beijing 100190, China;
4. Guangdong Biocell Biotechnology Co. Ltd, Guangzhou 523808, China
纳米银(AgNPs)以其独特的抗微生物性能被广泛应用于纺织业、食品工业、化妆品、水质净化和医疗器械等领域[1-3],使人类接触纳米材料的机会越来越多。关于纳米银暴露于健康皮肤乃至受损皮肤的安全性尚需进一步研究。虽然已有大量关于纳米银的皮肤毒性研究,但都主要集中在细胞和动物水平[4-7]。Caterina Zanette等[4]用人源角质形成细胞HaCaT细胞系评价AgNPs[(25±7.1)nm)]对皮肤的影响,结果提示AgNPs引起细胞活力随浓度和时间的增长依赖性降低,其半数抑制率(IC50)为(6.8±1.31)mol·L-1(MTT法),且短时间接触Ag NPs可导致细胞生长的长期抑制。Radoslaw Szmyd等[5]研究显示,聚乙烯吡咯烷酮包被的AgNPs(15 nm)对原代正常人表皮角质形成细胞(NHEK)有潜在毒性作用,其MTT结果提示,暴露于AgNPs 24 h后细胞活力呈现浓度依赖性降低,低浓度组(6.25 μg·mL-1和12.5 μg·mL-1)无显着变化,中浓度组(25 μg·mL-1)和高浓度组(50 μg·mL-1)下降至70%和60%。Benjawan Boonkaew等[6]对比了含银敷料ActicoatTM对永生角质形成细胞(HaCaT)和原代角质形成细胞(HEK)中的毒性作用,结果表明暴露24、48、72 h后,ActicoatTM均引起HaCaT和HEK细胞存活率降低,但前者的降低更为显著。这些细胞二维水平的实验结果表明,纳米银对不同来源、不同细胞系的皮肤细胞均有细胞毒性,其引起毒性的剂量水平往往很低。
正常皮肤是复层结构,有角质层作为屏障阻挡外界对人体内部的损害。在皮肤毒性研究中,单层细胞实验显示出的毒性效应,并未考虑皮肤的复层结构与角质屏障功能,不能真实地反映纳米材料对皮肤的实际生物效应。动物实验结果又无法完全代表人体反应。因此,建立与人体皮肤结构高度相似的三维(3D)组织工程皮肤模型,评价纳米银在皮肤模型中的渗透行为及对组织活力的影响,可以为科学合理地评价纳米材料的皮肤毒性风险提供基础信息。
纳米银为单质银(Ag0)颗粒,与银离子(Ag+)引起生物效应的作用机制不同,其潜在毒性风险也不同[8],因此有必要分别研究纳米银和银离子的透皮行为。纳米银在溶液或组织中会持续释放银离子[8],而银的定量测定需要将其消解后通过ICP-MS法等测定银元素的含量,无法区分纳米银颗粒还是银离子[9]。纳米金(AuNPs)在溶液中性质稳定,不降解,在电镜下呈暗红色,是常用的示踪剂[10]。本实验采用以纳米银为外壳包裹棒状纳米金制成的金核/银壳纳米棒(Au@AgNRs)为研究材料[11-13],考察纳米颗粒在皮肤中的渗透行为。通过电感耦合等离子体-质谱法(ICP-MS)检测金和银元素在皮肤模型各层中的渗透量,以金元素代表纳米颗粒的渗透量,以银元素代表纳米金/银棒释放的银离子渗透量,考察纳米颗粒在皮肤模型中的穿透行为。
1 材料 1.1 3D表皮模型HaCaT和Epikutis® 3D表皮模型由广东博溪生物科技有限公司提供[14]。这些模型由第四军医大学金岩教授为首的核心团队通过组织工程技术,利用人的细胞体外构建的与人体皮肤高度一致的三维皮肤模型。
1.2 材料与试剂Au@AgNRs(Ag、Au投料摩尔比约3:1,以聚苯乙烯磺酸钠(PSS)修饰,国家纳米科学中心提供),模型培养液(广东博溪生物科技有限公司提供),MTT(M2128,Sigma公司),Triton X-100(T8787,Sigma公司),乳酸脱氢酶细胞毒性检测试剂盒(C0016,Beyotime公司),浓硝酸、浓盐酸(国药集团),1 mg·mL-1银标准溶液(北京有色金属研究院,有证书),1 mg·mL-1金标准溶液(Thermo公司,有证书),1 mg·mL-1铟标准溶液(美仑生物科技公司,有证书),氩气(纯度≥99.99%)。
1.3 仪器酶标仪(Spectramax M5,MD公司),二氧化碳培养箱(150i,Thermo公司),超声清洗器(KQ250ES,昆山市超声仪器有限公司),离心机(3k-15,Sigma公司),动态光散射仪(DLS,Zetasizer Nano ZS,Malvern公司),透射电子显微镜(TEM,JEM-2100F,Hitachi公司,Tokyo),分光光度计(Lambda 950,Perkin Elmer Instruments Co. Ltd.),电感耦合等离子体质谱分析仪(NexION300X,PE公司),微波消解系仪(Mars 6,CEM公司),分析天平(BT124S,Sartorius公司)。
2 方法 2.1 表皮模型的表征用常规HE染色制备HaCaT和Epikutis®模型的组织切片,分析组织结构。
模型采用给予1% Triton X-100后测定组织活力为50%的时间(ET 50),判断模型的屏障功能。
2.2 Au@AgNRs的表征通过透射电子显微镜以200 kV的加速电压获得Au@AgNRs和没有银壳的金纳米棒的形态和尺寸,通过能量色散X射线谱(EDS)进行元素分析。用动态光散射(DLS)在透明的一次性ζ电池中测量Au@AgNRs电势。
2.3 Au@AgNRs在表皮模型中的透皮行为 2.3.1 Au@AgNRs暴露3D表皮模型复苏:在6孔板每孔添加0.9 mL培养液,将含有表皮模型的培养小室转移至6孔板的第1排,在(37±1)℃、(5±1)% CO2、95%相对湿度中培养(60±5)min。培养结束后,将表皮模型(培养小室)从第1排的孔中转移到第2排,再放回培养箱中培养过夜[(18±3)h],培养过夜后的组织可用于实验。
分设阴性对照组(PBS)和Au@AgNRs组(80 μg·mL-1),每种模型的每个实验组别分别设至少3个重复。取出模型培养板,分别在HaCaT和Epikutis®模型表面加样40 μL,转移到恒温培养箱中孵育24 h和72 h。孵育结束后,将表皮模型及模型下层培养液分别回收,放入提前标记好的聚四氟乙烯(EP)管中,-20 ℃保存备用。
2.3.2 测试样品制备用微波消解法消解生物样品:取出冷冻的待测样品(包括表皮模型和模型下层培养液),每份样品单独转移至已称量的1个微波消解罐中,并用差量法准确称量样品。向微波消解罐中分别加入浓硝酸9 mL和浓盐酸1 mL,预消解30 min后盖上消解罐,并将其对称安装在转盘上。按照微波消解程序操作,共分为3步,其中功率(1.6 kW)、功率百分数设定(100%)、上升时间(8 min)均一致,温度及时间分别为120 ℃保持2 min,160 ℃保持5 min,195 ℃保持50 min。待消解罐冷却至室温后,打开消解罐让消解过程产生的气体慢慢释放出来。将消解罐放在赶酸电热板上,160 ℃加热约90 min进行赶酸,取出消解罐冷却至室温,剩余大约0.5 mL样品,取出消解罐冷却至室温,将样品转移到已称量后的15 mL EP中。配制硝酸盐酸混合溶液,硝酸终浓度为2%,盐酸终浓度为1%。其中50%用2%稀硝酸和1%盐酸混合溶液洗涤消解罐2~3次,转移到上述EP管中,并最终定容至12.000~15.000 g,用于金含量测定。另外50%用2%稀硝酸洗涤消解罐2~3次,转移到上述EP管中,并最终定容到12.000~15.000 g用于银含量测定。
2.3.3 检测及数据分析配制25 μg·L-1铟溶液作为内标溶液。用2%硝酸和1%盐酸混合溶液及2%硝酸溶液分别配制0.5、1.0、5.0、10.0、20.0、50.0 μg·L-1的系列金标准溶液和系列银标准溶液。将定容的消解液各取1 mL于已称量的15 mL EP管中,精确称量1 mL溶液的质量,用2%硝酸和1%盐酸混合溶液及2%硝酸溶液分别稀释10倍、100倍待测。ICP-MS开机按照仪器操作规程执行。将铟内标溶液通过ICP-MS仪的内标管持续在线加入。将银及金标准溶液从浓度由低到高依次测量,测量完毕后用2%稀硝酸溶液冲洗。将制备的样品溶液从浓度由低到高依次测量,每份溶液测量3个重复,每次测量完毕后用2%稀硝酸溶液冲洗。将测量数据从计算机中导出代入下列公式中。
样品中银或者金的质量(Q,μg):
| $ Q=C\times f\times \frac{m}{c} $ |
式中,C—测量浓度,μg·mL-1;f—稀释倍数;m—样品消解液质量,g;c—样品消解液浓度,g·mL-1。
计算得出样品消解液中金、银的质量(μg)。将计算得出的金、银含量除以最初检测的待测样品质量(g),得出单位质量样品中金、银含量(μg·g -1)。
2.4 Au@Ag NRs对表皮模型组织活力的影响3D表皮模型复苏步骤同上。实验分设阴性对照组(PBS)、LDH阳性对照组(1%Triton X-100)及Au@Ag NRs暴露组(10、20、40、80、160 μg·mL-1)。取出模型培养板,分别在HaCaT和Epikutis®模型表面加入Au@Ag NRs 40 μL,转移到恒温培养箱中孵育24 h。在模型孵育结束前30 min加入1%Triton X-100 40 μL。孵育结束后,收集培养液以备LDH检测用。用无菌磷酸盐缓冲液(DPBS)清洗表皮模型15次,将清洗好并且干燥的模型转移至加有300 μL MTT溶液(1 mg·mL-1)的24孔板中,孵育3 h±5 min后,弃去MTT溶液,用DPBS溶液清洗3次,在表皮模型中加入异丙醇(分析纯)2 mL,密封,4 ℃静置过夜,表皮模型组织溶解后,在570 nm和680 nm双波长下测量其吸收度,计算模型的相对组织活力。
LDH检测:按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液;将收集的培养液以每孔50 μL加入96孔中,每孔加入25 μL配制的LDH工作液,混匀,室温避光振荡30 min,在490 nm和600 nm双波长测量其吸收度。LDH释放率计算公式:
LDH释放率= (P-N)/(T-N)×100%
式中,P为阳性对照组吸收度;N为阴性对照组吸收度;T为试验组吸收度;P、N、T均为减去背景空白对照孔吸收度。
2.5 统计学分析用SPSS 20.0统计学软件分析。经过方差齐性检验,组间差异采用单因素方差分析(one-way ANOVA)中LSD进行两两比较检验。设定P < 0.05差异有统计学意义。
3 实验结果 3.1 材料表征 3.1.1 3D表皮模型的表征HaCaT模型:采用人永生化上皮角质形成细胞系HaCaT(购自ATCC)构建而成,未分化完全时使用,仅为HaCaT细胞叠加排列,无棘层、颗粒层及角质层的分化,其质量控制指标和标准见表 1[14]。HE染色显示HaCaT模型呈现HaCaT表皮细胞叠加排列成复层单一细胞层(图 1-A);其组织活力测定结果为A570=1.5±0.4,屏障功能测定结果为ET50在(60±10)min,各项指标均符合其质量标准。本实验以HaCaT模型模拟角质缺失或受损的人群,如烧烫伤、皮肤病、敏感肌肤等,评价纳米材料对无角质屏障或屏障功能受损人群的暴露风险。
|
|
表 1 皮肤模型质量控制指标 Tab.1 Epidermal model quality control items |

|
A. HaCaT B. EpiKutis® 图 1 3D表皮模型HE染色图片(放大倍数×40) Fig.1 HE staining of 3D epidermal model (magnification×40) |
Epikutis®模型:以正常人的角质形成细胞为种子细胞(角质形成细胞由儿童包皮组织分离而来),在体外发育成复层化结构的皮肤模型。Epikutis®模型在组织学结构上与人皮肤结构高度相似,含有角质层、颗粒层、棘层和基底层细胞,其质量控制指标和标准见表 1。HE染色显示Epikutis®模型呈现角质层、颗粒层、棘层和基底层多细胞层(图 1-B);其组织活力测定结果为A570=1.6±0.5,屏障功能测定结果为ET50在(4.0±1.5)h,各项指标均符合其质量标准。本实验以Epikutis®模型代表正常人皮肤,评价纳米材料对角质屏障功能正常的健康人群的暴露风险。
3.1.2 Au@Ag NRs的表征本研究使用的Au@AgNRs与已发表文献[13]中所使用的Au@AgNRs相同(均由国家纳米科学中心提供)。其中,TEM图像显示Au@AgNRs是尺寸均匀的纳米棒(图 2-B)。单纯纳米金棒(AuNRs):短径D=(20.3±2.4)nm,长径L=(60.1±4.7)nm,纵横比AR(aspect ratio)=2.99±0.35(统计颗粒数315个);银包裹后的Au@AgNRs:短径D=(37.2±1.74)nm,长径L=(76.2±4.8)nm,纵横比AR(aspect ratio)=2.05±0.15(统计颗粒数204个)。根据TEM图像可以发现,金纳米棒(AuNRs)的表面均匀地覆盖着厚度为8 nm的银薄层。DLS测量Au@AgNRs显示,Au@AgNRs@PSS:大小为(32.6±0.4)nm,电势为(-45.1±0.5)mV,其消光光谱图见图 2-C。用能量色散X射线表征光谱学(EDS)对Au@Ag NRs做进一步表征,EDS谱证实此NRs为元素Au和元素Ag组成(见图 2-D)。
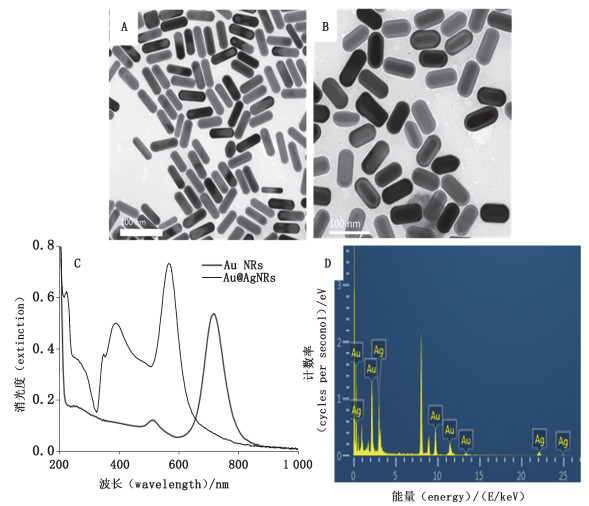
|
A. Au NRs代表性的TEM图像(representative TEM image of Au NRs) B. Au@Ag NRs代表性的TEM图像(representative TEM image of Au NRs) C. DLS消光光谱图(DLS extinction spectrum) D. EDS元素分析(EDS element analysis) 图 2 Au@Ag NRs的表征 Fig.2 The characterization of Au@Ag NRs |
HaCaT和Epikutis®模型暴露于Au@Ag NRs 24 h和72 h后,用ICP-MS法检测表皮模型中和模型下培养液中的金、银元素,结果见表 2。
|
|
表 2 HaCaT和Epikutis®模型各层中金、银元素的量 Tab.2 The amount of gold and silver in each layer of HaCaT and Epikutis® |
在HaCaT模型中,Au@AgNPs在24 h的暴露后其释放的银离子进入并储留在HaCaT模型的细胞层中,其中,金元素约0.980 µg、银元素约3.510 µg;但下层培养液中未检测到金元素,说明Au@AgNPs颗粒物在24 h的暴露后不能穿透HaCaT模型;而下层培养液中检测到银元素约0.005 µg,说明Au@AgNPs释放的银离子(Ag+)可极少量穿透HaCaT模型进入下层培养液。将暴露时间延长至72 h后,进入并储留在HaCaT模型中的金、银显著增加,金元素约3.650 µg、银元素约5.590 µg;穿透HaCaT进入下层培养基中的银元素由24 h暴露后的0.005 µg增加至0.053 µg,同时检测到0.003 µg金元素。这些结果提示,纳米材料可以穿透无角质或角质受损的表皮进入人体,且透皮行为具有时间-效应关系。
在Epikutis®模型中,Au@AgNPs 24 h暴露后其释放的银离子进入并储留在Epikutis®模型的角质层和细胞层(总细胞层),其中,储留在角质层的金元素约0.270 µg、银元素约0.750 µg;储留在细胞层的金元素约0.540 µg、银元素约0.570 µg;但下层培养液中未检测到金元素或者银元素,说明颗粒及其释放的银离子均不能完全透过Epikutis®模型。Au@AgNPs在72 h的暴露后其释放的银离子大量进入并储留在Epikutis®模型的角质层和细胞层。其中,储留在角质层的金元素约0.780 µg、银元素约1.770 µg;储留在细胞层的金元素约1.650 µg、银元素约3.490 µg;同时少量的Au@AgNPs及其释放的银离子可继续向下移动,穿透Epikutis®模型进入下层培养液的金元素约0.004 µg、银元素约0.046 µg。这些结果提示,纳米材料可以穿透角质层进入表皮及进一步进入表皮下层,且透皮行为具有时间-效应关系。与无角质表皮模型相比,屏障功能健全的角质层可阻挡部分纳米材料进入和穿透表皮模型,但并不能完全阻隔。
3.3 Au@Ag NRs对表皮模型组织活力的影响MTT实验结果(图 3-A)显示,与对照组相比各Au@Ag NRs组对Epikutis®及HaCaT模型有一定的毒性作用,均造成了模型组织活力的下降,并呈剂量-效应关系。在Epikutis®模型中,10 μg·mL-1 Au@AgNRs暴露组的组织活力为95.69%±1.48%,与对照组相比无显著性差异;当Au@Ag质量浓度大于20 μg·mL-1时,组织活力剂量依存性下降,从90.83%±1.73%减小至87.84%±1.95%,与对照组相比具有显著性差异(P < 0.05);Au@AgNRs暴露剂量增高至160 μg·mL-1时其组织活力为85.43%±1.77%,与对照组相比显著降低(P < 0.01)。在HaCaT模型中,10 μg·mL-1Au@AgNRs的组织活力为86.34%±1.41%,与对照组相比具有显著性差异(P < 0.05);当质量浓度大于20 μg·mL-1时,其组织活力剂量依存性下降,自75.55%±1.88%降至20.02%±1.84%,与对照组相比显著降低(P < 0.01)。

|
图 3 Au@AgNRs对Epikutis®和HaCaT模型组织活力[MTT法(A)及LDH释放法(B)]的影响 Fig.3 Effect of Au@AgNRs on the tissue viability [MTT assay (A) and LDH release assay (B)] of Epikutis® and HaCaT models |
以LDH阳性对照组1%Triton X-100的LDH释放量为100%,计算得出Epikutis®和HaCaT模型对照组和各浓度Au@AgNRs组的LDH释放量百分比。在Epikutis®模型中各Au@Ag NRs组LDH释放量百分比与对照组相比无显著性差异。在HaCaT模型中,如图 3-B所示,10 μg·mL-1Au@AgNRs暴露组LDH释放量百分比为14.28%±1.32 %,与对照组相比显著降低(P < 0.05);当质量浓度大于20 μg·mL-1时,LDH释放量百分比从16.18%±1.20%升高至116.90%±2.95 %,与对照组相比剂量依存性显著降低(P < 0.01)。
4 讨论本研究深入探讨了金核/银壳纳米棒(Au@AgNRs)在HaCaT和Epikutis® 3D表皮模型中的透皮行为和对表皮模型组织活力的影响。
首先,为保证实验结果的准确性和可重复性,表皮模型的质量很重要,尤其是屏障功能指标。在表皮模型表征结果的基础上,本研究发现角质层健全的Epikutis®模型在Au@AgNRs暴露24 h后,模型中检测到金、银元素,但在模型的下层培养液中金、银元素未被检出,说明在24 h内Au@AgNRs纳米棒或者其释放的银离子进入并储留在角质层和表皮细胞层中,未穿透表皮。然而,在持续暴露72 h后,进入并储留在Epikutis®模型角质层和表皮细胞层中的Au@AgNRs较24 h明显增多,且在模型培养液中检测到微量的金、银元素,提示Au@AgNRs纳米棒能够透过角质层健全的皮肤模型,其透皮行为具有时间-效应关系。24 h暴露后组织活力结果进一步提示,随着Au@AgNRs暴露剂量的增加呈现轻度而缓慢的降低趋势。这些结果提示纳米银的皮肤暴露存在一定风险。在无角质屏障或屏障功能受损的HaCaT表皮模型中,由于缺少角质层Au@AgNRs的通透量呈现更显著的时间依存性增加和对组织活力的剂量依存性毒性效应,提示角质层受损的皮肤对Au@AgNRs暴露引起的毒性风险更大。
许多二维细胞水平的实验研究表明,不同的纳米银对不同来源、不同细胞系的皮肤细胞均有细胞毒性[4-6]。Cheng等用与本实验类似的金核/银壳纳米棒[AgNRs,金/银摩尔比约为1.18:1,长径(53±7)nm,短径(18±2)nm,银壳厚度约1 nm]作为研究材料,探讨其对小鼠成纤维细胞(NIH3T3)的毒性效应。结果提示,NIH3T3细胞暴露于AgNRs 24 h后,透射电镜下观察到20 pmol·L-1(约5.8 pg·mL-1)的AgNRs引起细胞表面光滑的膜结构明显粗糙化。随着AgNRs浓度增加到40 pmol·L-1,细胞膜显示出多孔结构。进一步增加浓度至60 pmol·L-1和80 pmol·L-1,活细胞数量急剧减少,细胞出现严重的萎缩损伤[12]。本研究在三维皮肤组织模型中,80 μg·mL-1的Au@AgNRs[金/银摩尔比为3:1,短径D=(37.2±1.74)nm,长径L=(76.2±4.8)nm,,银壳厚度约为8 nm]虽然能够时间依存性透过表皮模型,但对组织活力的影响相对轻而缓慢,最高浓度组(160 μg·mL-1)组织活力也仅下降至85.43%±1.77%;然而,在无角质层的HaCaT模型中,Au@AgNPs引起的毒性作用更加明显,低剂量(10μg·mL-1)就引起了组织活力明显下降,随着剂量增加其组织活力从86.34%±1.41%降至20.02%±1.84%,说明角质层对纳米材料的透皮性起到了重要屏障作用。因此,仅用单层细胞实验无法真实反映纳米银对人皮肤的毒性风险,而三维表皮模型能更好地模拟人体皮肤的屏障功能,有效地评价纳米材料的透皮性和皮肤毒性风险。
有文献利用动物实验评价纳米材料的皮肤毒性,通过检测动物体内各组织脏器中的纳米材料的含量评价纳米材料的透皮行为。如Mitra Korani等[7]在Guiana Pigs皮肤表皮暴露AgNPs,检测Guiana Pigs皮肤和其他组织脏器中银离子的含量。结果提示,可以在不同器官中检测到银离子,组织对AgNPs摄取呈现剂量-时间依存性。但是,该文献中检测的是脏器组织中的银元素,无法证明通过动物皮肤进入动物体内的是AgNPs颗粒还AgNPs释放的银离子。MengJie等[11, 13]用与本次研究相似的Au@AgNPs埋植于大鼠皮下(模拟受损皮肤的暴露),发现在局部附近的淋巴结检测到了金元素,说明有金/银纳米棒被皮下吸收移行到了局部附近的淋巴结,提示纳米颗粒可以被无角质层或者角质层受损的皮肤吸收,向局部淋巴组织迁移。本研究的体外三维表皮模型研究结果与动物实验结果是一致的,说明纳米材料有透过皮肤屏障进入体内的风险。因此,利用体外三维表皮模型可以了解纳米颗粒的透皮行为及预测其在体内的迁移可能性。
终上所述,无论角质屏障是否健全,Au@AgNRs均可进入并停留在表皮模型中,引起表皮模型组织活力下降并呈剂量-效应关系。Au@AgNRs在表皮模型中的透皮行为具有时间-效应关系。角质屏障可减轻和减缓纳米材料在表皮中的透过行为和对表皮的损伤,但并不能完全保护皮肤免受纳米材料的侵害。
| [1] |
ZHANG XF, LIU ZG, SHEN W, et al. Silver nanoparticles:synthesis, characterization, properties, applications, and therapeutic approaches[J]. Int J Mol Sci, 2016, 17(9): 1534. DOI:10.3390/ijms17091534 |
| [2] |
THOMAS R, JANARDHANAN A, VARGHENSE RT, et al. Antibacterial properties of silver nanoparticles synthesized by marine Ochrobactrum sp[J]. Braz J Microbiol, 2014, 45(4): 1221. DOI:10.1590/S1517-83822014000400012 |
| [3] |
CHERNOUSIVA S, EPPLE M. Silver as antibacterial agent:ion, nanoparticle, and metal[J]. Angew Chem Int Ed, 2013, 52(6): 1636. DOI:10.1002/anie.v52.6 |
| [4] |
ZANETTE C, PELIN M, CROSERA M, et al. Silver nanoparticles exert a long-lastingantiproliferative effect on human keratinocyte HaCaT cell line[J]. Toxicol Vitro, 2011, 25(5): 1053. DOI:10.1016/j.tiv.2011.04.005 |
| [5] |
SZMYD R, GORALVZYK AG, SKALNIAK L, et al. Effect of silver nanoparticles on human primary keratinocytes[J]. Biol Chem, 2013, 394(1): 113. |
| [6] |
BOONKAEW B, KEMPF M, KIMBLE R, et al. Cytotoxicity testing of silver-containing burn treatments using primary and immortal skin cells[J]. Burns, 2014, 40(8): 1562. DOI:10.1016/j.burns.2014.02.009 |
| [7] |
KORANI M, REZAYAT SM, ARBABI BS. Sub-chronic dermal toxicity of silver Nanoparticles in Guinea pig:special emphasis to heart, bone and kidney toxicities[J]. Iran J Pharm Res, 2013, 12(3): 511. |
| [8] |
程祥, 赵玉云, 邵安良, 等. 含银敷料的表征和银的体外释放实验方法研究及其应用[J]. 药物分析杂志, 2015, 35(3): 491. CHENG X, ZHAO YY, SHAO AL, et al. Study on the characterization of silver-containing dressings and experimental methods of in vitro release of silver and its application[J]. Chin J Pharm Anal, 2015, 35(3): 491. |
| [9] |
BIANCO C, KEZIC S, CROSERA M, et al. In vitro percutaneous penetration andcharacterization of silver from silver-containing textiles[J]. Int J Nanomedicine, 2015, 10(10): 1899. |
| [10] |
TAURAN Y, BRIOUDE A, COLEMAN AW, et al. Molecular recognition by gold, silver and copper nanoparticles[J]. World J Biol Chem, 2013, 4(3): 35. DOI:10.4331/wjbc.v4.i3.35 |
| [11] |
MENG J, LI YL, LIU J, et al. Using gold nanorods core/silver shell nanostructures as model material to probe biodistribution and toxic effects of silvernanoparticles inmice[J]. Nanotoxicology, 2014, 8(6): 686. DOI:10.3109/17435390.2013.822593 |
| [12] |
CHEN XL, WU XC, XU HY, et al. Revealing silver cytotoxicity using Au nanorods/Ag shellnanostructures:disrupting cell membrane and causing apoptosis through oxidative damage[J]. RSC Adv, 2013, 3(3): 2296. |
| [13] |
WU MY, CHEN L, LI RU, et al. Bio-distribution and bioavailability of silver and gold in rat tissues with silver/gold nanorodadministration[J]. RSC Adv, 2018, 8: 12260. DOI:10.1039/C8RA00044A |
| [14] |
卢永波, 张荣芳, 许珊珊, 等.一种用于体外测试的中国汉族人表皮替代模型[A]//中国毒理学会第六届全国毒理学大会论文摘要, 2013: 1 LU YB, ZHANG RF, XU SS, et al. An epidermal replacement model of Chinese Han people used for in vitro testing[A]//The Sixth National Toxicology Conference of the Chinese Society of Toxicology, 2013: 1 http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGDV201311001565.htm |
 2019, Vol. 39
2019, Vol. 39 
