2. 新疆医科大学, 乌鲁木齐 830011;
3. 新疆新姿源生物制药有限公司, 伊犁 835800
2. Xinjiang Medical University, Urumqi 830011, China;
3. Xinjiang Nuziline Bio-Pharmaceutical Co., Ltd., Yili 835800, China
雌酮硫酸钠(sodium estrone sulfate,ESS)是甾体激素类化合物中雌性激素的一种,具有环戊烷并多氢菲母核,为孕马尿中天然混合雌激素的一种。自美国惠氏公司开创了更年期女性的激素补充疗法后,从孕马尿中提取结合态雌激素制备此类药物制剂已成为目前的一个主要方向,而文献报道雌激素替代疗法范围越来越广泛[1-6],因而从孕马尿中提取雌激素的生产规模也越来越大。
对于雌激素的分析检测,多采用GC、HPLC、GC-MS、TLC等各种仪器分析手段[7-8],结合态雌激素提取现场也借助于HPLC、GC分析方法,所得检测数据准确、可靠,但样品前处理复杂,检测分析时间较长,且需要特定的仪器设备。随着雌激素市场需求量激增,孕马尿采集量大幅度增加,故需检测样本量也急剧增大,从而出现孕马尿原料采集现场的质控检测法——HPLC、GC法无法在一定时间内完成大量样本检测任务,因此,有必要建立一种简单快速、灵敏度高、经济,适宜于采集现场监测孕马尿原料中主要活性成分雌酮硫酸钠、马烯雌酮硫酸钠等雌激素的方法[9]。鉴于胶体金免疫层析试纸法有选择性高,检测限低,操作简单,速度快及分析成本低等特点[10-12],本实验通过对药物结构、载体结合位点的分析,将目标物结构修饰为适宜衍生物,用免疫学方法制备针对目标物的高灵敏性、高亲和性抗体,又结合免疫胶体金技术制备出测定孕马尿原料的胶体金免疫层析试纸条,适合大样本快速检测[13-15]。
1 仪器与试药梅特勒-托利仪器有限公司AE250型分析天平;岛津公司UV-2550型紫外分光光度计;岛津公司IRAffinity-1型红外分光光度计;Telstar公司LYOQUEST冷冻干燥机;上海琅玕实验设备有限公司DHP-9160B电热恒温干燥箱;北京光电仪器厂XT4A显微熔点仪;Bio DOT公司CM4000型膜切割机-膜喷点系统,Variaw公司Unity-Inova超导核磁共振谱仪;金坛市华峰仪器有限公司HY-5型回旋多用振荡器;Millipore公司67120超纯水仪;北京市永光明医疗仪器厂SHHW-21电热三用水箱;METTLERTOLEDO公司FiveEosy酸度计;LG公司3850W3W059A型微波炉;科大创新股份有限公司中佳分公司KDC-220HR高速冷冻离心机;BIO-RAD公司Xmark型酶标仪;Nikon公司倒置荧光显微镜;Thermo公司371型直热式二氧化碳培养箱。
雌酮对照品(新疆新姿源生物制药有限公司惠赠);雌酮硫酸钠对照品(ORGANICS,批号:E089076);羧甲基羟胺半盐酸盐(东京理化株式会社,批号:YT2TD);二甲基亚砜(Sigma,批号:#WXBB5403V);聚乙二醇4000(Sigma,批号:RNBF1100);鱼胶蛋白(Sigma,批号:SLBH6724V);N,N-二甲基亚酰胺(天津市富宇精细化工有限公司,批号:130912);氯甲酸已丁酯(国药集团化学试剂有限公司,批号:WA20150821);牛血清白蛋白(BBI,A8020);HRP-羊抗兔IgG抗体(R & D Systems Inc,批号:FIN03);山羊血清(Solarbio,批号:20150403);Proclin(Sigma,批号:LB64899);Tris(Sigma,批号:1718A16);弗氏完全佐剂(Sigma,批号:#SLBL0210V);弗氏不完全佐剂(Sigma,批号:#SLBL5808V);氯金酸(国药集团化学试剂有限公司,批号:T20071102);氯磺酸(上海金山亭新化工公司,批号:20030720);柠檬酸三钠(上海生工生物工程有限公司,批号:#1983B25);HRP标记山羊抗小鼠IgG(Sigma,批号:040M150);山羊抗小鼠实IgG(Sigma,批号:SLBL2695V);胎牛血清(Hyclone,批号:NAE1388);ProteinG(Sigma,批号:PC338656);硝酸纤维素膜、膜玻璃纤维(Millipore公司);样品垫、吸收垫(Whatman公司);BALB/C小鼠雌性,体重18~22g,SPF级,购自北京维通利华实验动物有限公司,饲养于新疆医科大学第一附属医院实验动物中心。
2 方法与结果 2.1 制备雌酮硫酸钠衍生物(半抗原)和免疫原制备过程如图 1所示。
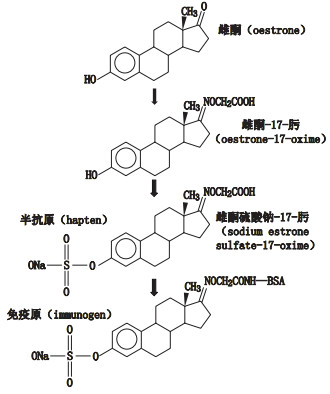
|
图 1 半抗原和免疫原的制备 Fig.1 Preparation of hapten and immunogen |
第一步:精密称取雌酮0.5 g,加无水甲醇20.0 mL,搅拌下加入羧甲基羟胺半盐酸盐30.12 mg和乙酸钠2.0 g。于40 ℃水浴中搅拌反应8 h,待反应完全后,40 ℃减压旋转蒸干除去甲醇,加水适量,乙酸乙酯萃取,回收没有反应的雌酮。水相用2 mol·L-1盐酸酸化,出现白色沉淀,静置,抽滤析出沉淀,沉淀物用蒸馏水洗至中性,真空干燥,得粗产品。甲醇重结晶,得无色针状晶体。
第二步:精密称取氯磺酸10 mg,在冰浴中缓缓滴加无水吡啶10 mL,将此溶剂在冰浴中加入第一步产物0.1 g,于35℃水浴中搅拌反应5 h,待反应完全后,用pH 7.5 0.05 mol·L-1醋酸盐缓冲液30 mL稀释,40 ℃减压旋转蒸干。将残留干粉溶于3 mL甲醇,点于硅胶H薄层板,以二氯甲烷-甲醇-氨水(10:10:5)为展开剂,展开,取出,晾干。刮取产物条带,用二氯甲烷洗脱,冷冻干燥,得纯品雌酮硫酸钠-17-肟(sodium estrone sulfate -17-oxime,ESS-17-肟) (半抗原)。
第三步:ESS-17-肟衍生物鉴定结果
(1) 外观性状:为白色粉末,易溶于水,微溶于甲醇。mp>300℃。(2)IR光谱:(υmaxcm-l)溴化钾压片法:1 608.63(
精密称取ESS-17-肟20 mg,置反应瓶中,加入N,N-二甲基亚酰胺3 mL,溶解,再加入二氧六环3.0 mL,将混合液4 ℃放置30 min后,加氯甲酸已丁酯18 µL作为活化溶液(A)。分别精密称取牛血清白蛋白(bovine serum albumin,BSA)和鸡卵清白蛋白(ovalbumin,OVA)60 mg,加pH 9.0 0.1 mol·L-1硼酸缓冲液5 mL,二氧六环2 mL,4 ℃放置30 min后,作为溶液B1、B2。将活化溶液(A)等量分别慢慢滴入溶液B1、B2中,将混合液于4 ℃缓缓搅拌反应过夜,对pH 7.2 0.01 mol·L-1磷酸盐缓冲液透析2 d,换液6次。离心去除反应中的沉淀,上清为偶联物溶液。
制备BSA、OVA、ESS-17-肟系列标准溶液及偶联物在200~400 nm波长范围内进行紫外扫描。标准系列扫描所得吸收度回归得线性方程和偶联物吸收度值,计算得ESS-17-肟与BSA偶联比为13.68,ESS-17-肟与OVA偶联比为7.91。从扫描图谱结果(图 2)可知,偶联产物最大吸收峰既不同于BSA,也不同于ESS-17-肟,偶联物的紫外吸收图谱与BSA和ESS-17-肟的有显著不同,所得偶联物的紫外吸收光谱兼具载体蛋白和半抗原的特征,由此推断半抗原与蛋白偶联成功。分装置-80 ℃冻存。
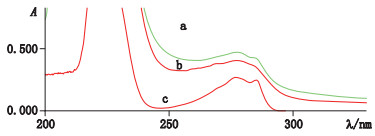
|
图 2 ESS-17-肟-BSA(a)、BSA(b)、ESS-17-肟(c)的紫外扫描 Fig.2 UV spectrum of ESS-17-Oxime-BSA(a)、BSA(b)、ESS-17-Oxime(c) |
用本实验合成的免疫原ESS-17-肟-BSA免疫3只6~7周龄、健康、雌性BALB/C小鼠,首次免疫取免疫原ESS-17-肟-BSA与等量弗氏完全佐剂充分乳化,于背部多点皮下注射,每只100 μg,待第3、5、7周时用弗氏不完全佐剂乳化免疫原进行加强免疫,每只100 μg;每次免疫前于小鼠尾静脉取血,ELISA法检测血清抗体效价,抗体效价 > 106准备进行细胞融合实验;细胞融合前3天再次强化免疫,腹腔注射不含佐剂的ESS-17-肟-BSA,每只50 μg。取血清滴度 > 106小鼠脾脏淋巴细胞与对数生长期的SP2/0细胞,按3:1比例融合。用含20%胎牛血清的RPMI-1640完全培养基、HAT培养基和HT培养基选择性培养杂交瘤细胞,以ESS-17-肟-OVA作为包被抗原,ELISA法检测杂交瘤细胞培养液中ESS单克隆抗体的分泌水平;收集检测结果为阳性培养孔中的杂交瘤细胞,采用有限稀释法进行克隆化培养。经过连续多次亚克隆化培养筛选,最终选择ELISA检测阳性率为100%的克隆型杂交瘤细胞进行扩大培养,获得稳定分泌抗ESS-17-肟单克隆抗体细胞株4株,分别命名为2D1、7G4、5F3、2A7。建株保存。进一步制备腹水型单抗,经过饱和硫酸铵粗纯,ProteinG亲和层析柱纯化后备用。采用间接ELISA法对单抗2D1、7G4、5F3、2A7进行亚类、效价及免疫原中偶联蛋白BSA和OVA的交叉性鉴定。
2.2.1 抗体亚型的鉴定经单克隆抗体亚类鉴定试剂盒鉴定,抗ESS-17-肟单克隆抗体2D1、7G4、5F3为IgG1类免疫球蛋白,2A7为IgG2b类免疫球蛋白(图 3)。
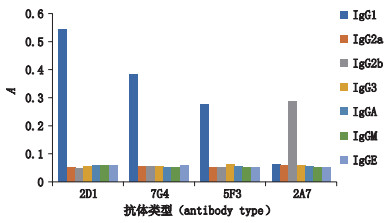
|
图 3 抗体亚型鉴定 Fig.3 Ig class and subclass identification of four antibody |
以ESS-17-肟-OVA为包被原,采用间接ELISA法测定4株单抗的效价。结果显示2D1、7G4株抗体效价在105以上,5F3、2A7三株抗体效价在104以上,2D1抗体效价最高,稀释比例在1:(5.12×105),P/N>2.1。见图 4。
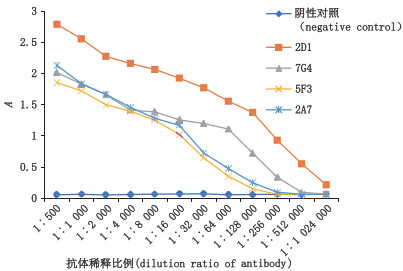
|
图 4 抗体效价测定 Fig.4 Detection of the valence of antibody |
通过间接ELISA检测单抗与载体蛋白-BSA、-OVA的交叉反应性,4株抗体与ESS-17-肟特异性良好,与高浓度的BSA、OVA均无交叉反应。
2.3 制备胶体金溶液精密称取氯金酸1.00 g,用水制成10%(w/v)的氯金酸溶液。取该溶液0.45 mL,加超纯水100 mL,加热至沸腾,快速加入1%(w/v)的柠檬酸三钠溶液7.5 mL,迅速搅拌均匀,观察颜色变化,溶液由金黄色变为灰色,由灰色—灰蓝色—紫色,最后变为酒红色,继续搅拌,直至溶液颜色稳定后,用超纯水定容至100 mL,制备得胶体金溶液澄清透明,呈酒红色,表面无漂浮物。可知制备的胶体金颗粒大小均匀,质量较好。紫外扫描计算金颗粒直径,紫外扫描最大吸收峰在521 nm,推断胶体金颗粒直径为20 nm左右。4 ℃保存备用。
2.4 优化胶体金标记抗体量及制备金标抗体 2.4.1 优化胶体金标记抗体量用0.1 mol·L-1碳酸钾溶液调节胶体金溶液pH至8.2,分别置9个EP管,每管1 mL胶体金溶液中依次加入1 mg·mL-1 ESS-17-肟抗体蛋白0、20、30、40、50、60、70、80、90 μL,混匀,放置10 min后,向上述各管中依次加入10%(w/v)氯化钠溶液100 μL混匀(图 5-A),静置2 h,每管溶液于521 nm处测定吸收度,以吸收度为纵坐标,抗体用量为横坐标作图(图 5-B)。由图 5可知,每1 mL胶体金溶液滴加1 mg·mL-1抗体蛋白50 µL时,胶体金抗体蛋白结合物的吸收度不再发生较大的变化,趋于平稳,说明胶体金颗粒对抗体蛋白的吸附基本达到饱和,待标记抗体蛋白的实际用量在此基础上再增加10%~20%即为稳定胶体金的实际蛋白用量。故最终确定抗体蛋白实际用量为每1 mL胶体金溶液中滴加1 mg·mL-1抗体蛋白60 µL。
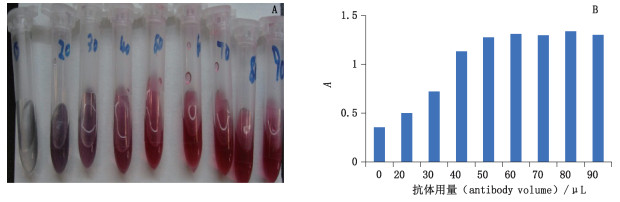
|
图 5 胶体金最适抗体标记量 Fig.5 Determination of the optimal in colloical gold and antibody |
将胶体金溶液用适量0.1 mol·L-1碳酸钾溶液调节溶液pH至8.2,搅拌下,再逐滴加入适量1 mg·mL-1抗体蛋白溶液,持续搅拌10 min,置4 ℃稳定1 h。加入终浓度为5%的新生牛血清封闭液封闭,持续搅拌30 min。10 000 r·min-1 4 ℃离心60 min,弃去上清液,再加入复溶液将体积浓缩为原体积的1/5,4 ℃保存待用。
2.5 胶体金免疫层析试纸条制备 2.5.1 胶体金免疫层析试纸条组装层析试纸条由5部分组成:金标结合垫、硝酸纤维素膜(NC膜)、样品垫、吸水垫和底板(PVC)。先将金标结合垫剪裁成3 mm的细条,再将一定量的金标抗体灌注在结合垫上,30 ℃恒温烘干备用;在附有底板的NC膜(25 mm)上涂布ESS-17-肟单抗为检测线(T线)和涂布羊抗鼠IgG为质控线(C线),封闭,30 ℃恒温干燥后,依次黏贴上吸水垫(15 mm)、灌注金标抗体的结合垫、处理后的样品垫(15 mm)组装为试纸条。见图 6。
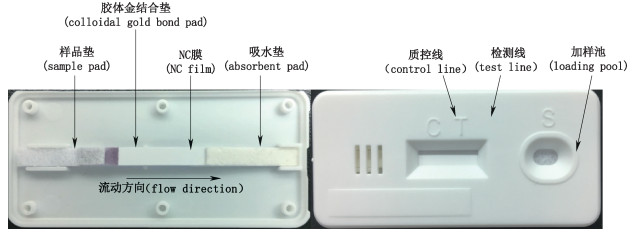
|
图 6 胶体金免疫层析试纸条组装结构图 Fig.6 Structure diagram of colloidal gold immunochromatographic strip assembly |
分别喷涂0.5、1.0、1.5 μg·mL-1的2D1单抗于NC膜上T线,每一浓度在NC膜上包被量为2.0 μL,制备试纸条,30 ℃干燥30 min,用1 μg·mL-1 ESS标准品溶液检测试纸条灵敏度。
2.5.2.2 质控线浓度优化确定将所购羊抗鼠IgG(质量浓度为10 mg·mL-1)依次稀释为0.3、0.6、0.9 μg·mL-1,每条包被量为2.0 μL制备试纸条,30 ℃干燥30 min,用1 μg·mL-1 ESS标准品溶液检测试纸条灵敏度。
2.5.2.3 胶体金标抗体喷涂量优化确定分别按每18 mm2玻璃纤维素膜喷涂稀释后的金标抗体30、45、60 μL,30 ℃干燥2 h,干燥后分别组装试纸条。用组装好的试纸条进行测试。
2.5.2.4 胶体金免疫层析试纸条参数的筛选确定胶体金标记抗体的喷涂量对T、C线深浅有一定的影响,影响目测效果,因此本实验利用正交实验方法对T、C线包被浓度进行了优化,结果如图 7及表 1。确定金标抗体灌注量为45 μL,T线抗体浓度为1.0 μg·mL-1,C线抗体浓度为0.9 μg·mL-1。
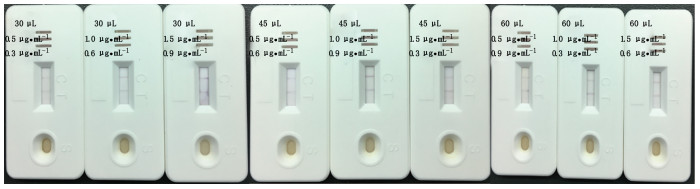
|
图 7 胶体金层析试纸条参数筛选检测结果 Fig.7 Colloidal gold chromatography strip parameters screening test resultsy |
|
|
表 1 胶体金层析试纸条参数筛选正交设计与结果 Tab.1 Orthogonaldesign and resultsof colloidal gold chromatography strip parameters selection |
向提取解析后的马尿样品(为阴性样本)加ESS标准品,分别稀释为50、500 ng·mL-1和1、5、10、20、30 μg·mL-1 7个浓度梯度的溶液并设空白对照,将样品滴入板条样品池中,观察检测线及质控线颜色变化。经试纸条测定未加标样本与加不同浓度标品样本,加标品500 ng·mL-1检测线显淡粉红色,其检测线显色结果和其他浓度显色结果差异能通过目视区分,在空白对照及50 ng·mL-1中都未显色,见图 8。经高效液相色谱法实测,确定公马尿、小马尿、空胎母马尿都含有微量雌激素。为避免灵敏度过高,使生产现场无法提取雌激素,对胶体金结合垫和NC膜通过封闭处理,降低其灵敏度,将试纸条灵敏度检测限为1 μg·mL-1,结果见图 8。

|
图 8 免疫层析试纸条灵敏度检测 Fig.8 Sensitivity of the detection limit of the immunochromatographic strip test |
取与ESS结构相似的马烯硫酸钠、马萘雌酮硫酸钠、雌酮及常见人工雌激素孕酮、己烯雌酚进行交叉反应。将上述物质都稀释制成2 µg·mL-1的溶液,将样品滴入金标试纸条的加样池中, 观察检测线和质控线的颜色变化,每个类似物做20个重复。ESS的单抗与马烯雌酮硫酸钠、马萘雌酮硫酸钠微有显色,因这2个化合物与雌酮硫酸钠在化学结构上极为相似,所以能与ESS的单抗结合而发生交叉反应;与其他结构类似物没有交叉反应。因考虑从孕马尿中提取的雌激素为包含马烯雌酮硫酸钠、马萘雌酮硫酸钠的混合雌激素,本实验建立的方法为定性检测,所以不影响本方法的检测准确性。
2.6.3 稳定性检测使用同批和不同批次试纸条对未加标样本(经提取雌激素后解析的马尿样品)和加标2 μg·mL-1样本进行测定,再将同批和不同批次试纸条真空包装后于37 ℃分别放置3 d和7 d,将同批和不同批试纸条于0 d、37 ℃放置3 d(有效期为6个月)和37 ℃放置7 d(有效期为12个月)后对未加标样本和加2 μg·mL-1标准品样本进行检测,批间、批内各平行测试3份,批间测试3批次,结果见表 2。从表 2可知:0 d与37 ℃放置3 d阴性样品测试中检测线都有个别略显色现象,存在假阳性;加标样品检测线颜色都较深,显色明显;37 ℃放置7 d后阴性样品测试中检测线无显色,加标样品检测线颜色明显减淡,因而得出初步结论,在现各种制备条件下制备的试纸条保存期为6个月,然后进行测定,综合评估其稳定性。
|
|
表 2 稳定性检测结果 Tab.2 Results of stability test |
将50份待测孕马尿样品分别于5 000 r·min-1离心20 min取上清液,用胶体金层析试纸条检测,同时用生产现场现使用方法HPLC法平行检测,比较测定结果,验证试纸条法的有效性。因胶体金层析试纸法设定灵敏度是1 μg·mL-1以上的定性检测,故将HPLC法定量检测结果≤1 μg·mL-1的定为阴性结果,检测结果≥1 μg·mL-1定为阳性结果。2种方法进行比对,与HPLC法的阳性符合率为85.45%(45/52),阴性符合率为89.58%(43/48),总符合率为88.00%(88/100),Kappa系数为0.760,检测结果显示,ESS胶体金层析试纸条和HPLC具有较好的一致性。
3 讨论本研究的目的是为了制备1种稳定的半抗原和免疫原,以提高抗血清的特异性,并对雌酮硫酸钠有较高的亲和性,同时建立1种ESS的快速检测方法。研究通过抗原制备、动物免疫、细胞融合、筛选、克隆和腹水制备,获得4株杂交瘤细胞株,并根据免疫胶体金原理,以胶体金标雌酮硫酸钠特异性单克隆抗体为核心试剂,研制雌酮硫酸钠快速检测的免疫层析试纸条。
研究过程中,免疫原通过1种明确的化学方法合成,使用雌酮做起始物料,将C-17位用羧甲基羟胺肟化为偶联桥,然后在C-3位加入硫酸钠根,通过C-17肟化所得羧基与蛋白偶联。在合成雌酮硫酸钠-17-肟中发现,-SO3Na很不稳定,同时在纯化和偶联中,-SO3Na很容易被水解损失,致使偶联产率较低,理论推算在体内过程再被水解损失后,可能无法进行后面的研究。进一步实验虽然获得雌酮硫酸钠抗体,但-SO3Na易水解问题还是有待进一步研究。同时,所获得单抗与孕马尿中的马烯雌酮硫酸钠、马萘雌酮硫酸钠呈现交叉反应,因为本实验中所建立的检测方法是限量定性检测孕马尿中混合雌激素,所以暂不考虑其对方法的干扰,但对在此实验基础上需进一步建立的定量测定却有影响,因此需更进一步深入研究抗原及抗体的特性,使抗体更精确识别抗原。
本研究建立的ESS胶体金免疫层析试纸条,是结合生产提取现场要求,对其主要影响因素进行了优化,获得的试纸条检出限为1 μg·mL-1,与HPLC比对阳性符合率为85.45%(45/52),阴性符合率为89.58%(43/48),总符合率为88.00%(88/100),结果一致性较好。本方法具有操作简单,稳定性好和灵敏度高的特点,可以满足雌激素提取生产现场的限量检测,适合于大样本的快速筛查,具有很好的应用前景。
| [1] |
RIŽNER TL. The Important roles of steroid sulfatase and sulfotransferases in gynecological diseases[J]. Front Pharmacol, 2016, 7(2): 30. |
| [2] |
LABRIE F, MARTEL C. A low dose (6.5 mg) of intravaginal DHEA permits a strictly local action while maintaining all serum estrogens or androgens as well as their metabolites within normal values[J]. Horm Mol Biol Clin Investig, 2017, 29(2): 39. |
| [3] |
REZVANPOU A, DON-WAUCHOPE AC. Clinical implications of estrone sulfate measurement in laboratory medicine[J]. Crit Rev Clin Lab Sci, 2017, 54(2): 73. DOI:10.1080/10408363.2016.1252310 |
| [4] |
GEYER J, BAKHAUS K, BERNHARDT R, et al. The role of sulfated steroid hormones in reproductive processes[J]. J Steroid Biochem Mol Biol, 2017, 172(9): 207. |
| [5] |
HIGUCHI T, ENDO M, HANAMURA T, et al. Contribution of estrone sulfate to cell proliferation in aromatase inhibitor(AI) -resistant, hormone receptor-positive breast cancer[J]. PLoS One, 2016, 11(5): 26. |
| [6] |
KOYAMA AK, TWOROGER SS, ELIASSEN AH, et al. Endogenous sex hormones and cognitive function in older women[J]. Alzheimers Dement, 2016, 12(7): 758. DOI:10.1016/j.jalz.2015.12.010 |
| [7] |
HOSOGI J, TANAKA H, FUJITA K, et al. LC-MS/MS coupled with immunoaffinity extraction for determination of estrone, 17 betaestradiol and estrone 3-sulfate in human plasma[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2010, 878(2): 222. DOI:10.1016/j.jchromb.2009.08.010 |
| [8] |
SPEARS KJ, ROSS J, STENHOUSE A, et al. Directional transepithelial transport of organic anions in porcine LLC-PK1 cells that co-express human OATP1B1(OATP-C) and MRP2[J]. Biochem Pharmacol, 2005, 69(3): 415. |
| [9] |
O'CONNOR KA, BRINDLE E, HOLMAN DJ, et al. Urinaryestrone conjugate and pregnanediol 3-glucuronide enzyme immunoassays for population research[J]. Clin Chem, 2003, 49(7): 1139. DOI:10.1373/49.7.1139 |
| [10] |
秦立得, 南文龙, 陈义平. 胶体金免疫层析试纸条在禽病检测方面的应用与展望[J]. 中国动物检疫, 2016, 33(8): 78. QIN LD, NAN WL, CHEN YP. The application and expectation of using immunochromatographic strip in detection of avian diseases[J]. China Anim Quarant, 2016, 33(8): 78. DOI:10.3969/j.issn.1005-944X.2016.08.022 |
| [11] |
施海燕, 盛恩泽, 马明, 等. 氯噻啉胶体金增强免疫层析分析方法的建立[J]. 分析化学, 2017, 45(3): 403. SHI HY, SHENG EZ, MA M, et al. Development of an enhanced colloidal gold immunochromatographic assay for detection of imidaclothiz[J]. Chin J Anal Chem, 2017, 45(3): 403. |
| [12] |
曹德康, 苏建忠, 张瑛, 等. 胶体金免疫层析技术在食品安全检测中的应用研究进展[J]. 解放军预防医学杂志, 2017(10): 1322. CAO DK, SU JZ, ZHANG Y, et al. Research progress in colloidal gold immune chromatographic techniques in food safety detection[J]. J Prev Med Chin PLA, 2017(10): 1322. |
| [13] |
HATZIDAKIS G, KATRAKILI K, KRAMBOVITIS E. Development of a direct and specific enzymeimmunoassay for the measurement of oestrone sulfate in bovine milk[J]. J Reprod Fertil, 1993, 98(1): 235. DOI:10.1530/jrf.0.0980235 |
| [14] |
MORTAUD S, DONSEZ-DARCEL E, ROUBERTOUX PL, et al. Murine steroid sulfatase(mSTS):purification, characterization and measurement by ELISA[J]. J Steroid Biochem Mol Biol, 1995, 52(1): 91. DOI:10.1016/0960-0760(94)00143-A |
| [15] |
HIRAKO M, TAKAHASHI H, DOMEKI I. Establishment of a reliable extraction method of estrone sulfate from bovine plasma for detection of the peripheral level during the regular estrous cycle by radioimmunoassay[J]. Domest Anim Endocrinol, 1996, 13(3): 187. DOI:10.1016/0739-7240(96)00013-6 |
 2019, Vol. 39
2019, Vol. 39 
