安塞曲匹(anacetrapib)是由美国默克公司研发的口服小分子选择性胆固醇酯转移蛋白(CETP)抑制剂, 主要用于冠状动脉疾病(CHD)和动脉粥样硬化[1-2]。CETP是高密度脂蛋白(HDL)的重要调控因子, 属于脂肪转运和脂多糖结合蛋白家族成员[3-6], 通过促进脂类在不同脂蛋白间的交换和转运, 调节脂代谢, 其主要功能是在甘油三酯交换时, 将胆固醇酯从HDL转运至极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL), 同时将VLDL逆向转运给HDL。抑制CETP的转运功能, 可提高血浆中HDL的水平, 降低LDL的水平, 从而减轻动脉粥样硬化的程度, 减少冠心病危险[7-10]。
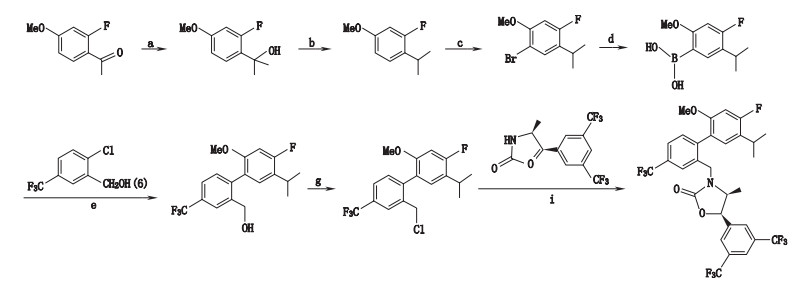
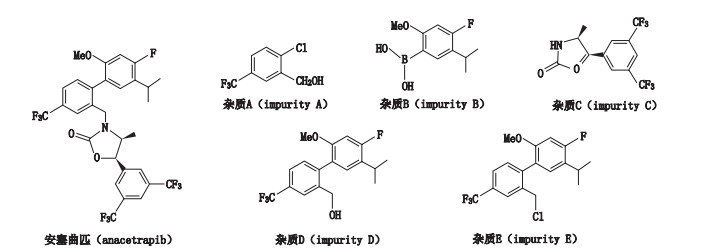
根据默沙东原研专利报道[11-13], 安塞曲匹的合成(合成路线见图 1)主要经Suzuki偶联、氯化、烷基化反应得到终产物。由于安塞曲匹本身性质较稳定, 不易降解, 最终引入的杂质主要是合成过程中的工艺杂质(结构式见图 2)。为加强安塞曲匹的质量控制, 本文在详细研究的基础上, 建立了RP-HPLC法测定安塞曲匹中5个已知杂质和其他未知杂质, 结果表明, 该方法操作简单, 灵敏度高, 专属性强, 可用于安塞曲匹的有关物质测定。
|
图 1 安塞曲匹合成路线图 Fig.1 The synthetic routes of anacetrapib |
|
图 2 安塞曲匹及其有关物质的结构图 Fig.2 The structures of anacetrapib and its related substances |
Waters e2695型高效液相色谱仪(配备PDA检测器)及Empower工作站(美国Waters公司)。
安塞曲匹对照品(自制, 纯度99.58%, 批号150415); 杂质A~E(含量分别为99.3%、98.6%、99.5%、99.1%、98.7%, 批号均为150601); 甲醇、乙腈(Tedia公司, HPLC级), 其余试剂均为分析纯。
2 方法与结果 2.1 色谱条件色谱柱:Agilent Zorbax SB C18柱(150 mm×4.6 mm, 5 μm); 流动相:A相为0.1%磷酸溶液, B相为乙腈, 按表 1程序进行梯度洗脱, 流速:1.0 mL·min-1; 柱温:30 ℃; 检测波长:210 nm; 进样量:10 μL。
|
|
表 1 梯度洗脱程序 Tab.1 Gradient elution program |
精密称取安塞曲匹和杂质A~E对照品各适量, 分别加甲醇溶解并稀释制成每1 mL含10 mg的安塞曲匹对照品储备液和每1 mL含0.5 mg的各杂质对照品储备液。
2.2.2 供试品溶液取本品20 mg, 精密称定, 置20 mL量瓶中, 加甲醇溶解并稀释至刻度, 摇匀, 即得。
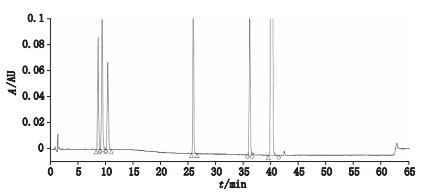
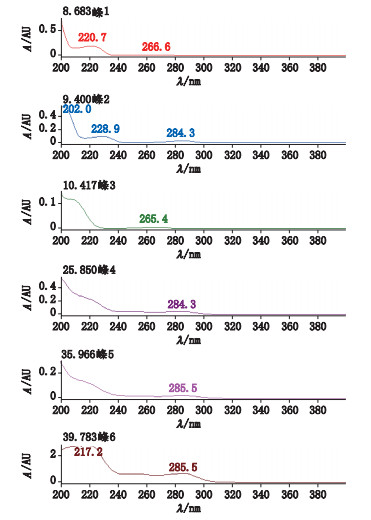
2.3 系统适用性试验精密量取各对照品储备液适量, 加甲醇稀释制成每1 mL含1 mg安塞曲匹和每1 mL含50 μg各杂质的混合溶液, 作为系统适用性溶液。在上述色谱条件下, 各峰的保留时间分别为:杂质A 8.7 min、杂质B 9.4 min、杂质C 10.5 min、杂质D 25.9 min、杂质E 36.1 min、安塞曲匹40.0 min; 理论板数以安塞曲匹计为177 876, 结果见表 2, 高效液相色谱图及其二极管阵列检测器光谱图见图 3、4, 主成分和各杂质在检测波长210 nm处均有较强吸收。
|
|
表 2 相对保留时间及相对响应因子结果 Tab.2 Results of relative retention time and relative response factor |
|
图 3 高效液相色谱图 Fig.3 HPLC chromatograms |
|
图 4 二极管阵列检测器光谱图 Fig.4 Spectra of diode array detector |
取空白溶剂(甲醇)10 μL, 注入液相色谱仪, 结果显示空白溶剂不干扰主峰及各杂质测定。
2.4.2 强制破坏试验精密称取安塞曲匹原料(批号20151215)500 mg, 置50 mL量瓶中, 加甲醇溶解并稀释至刻度, 摇匀, 作为破坏性试验储备液。精密量取2 mL, 共6份, 分别置20 mL量瓶中, 进行不同条件下的降解试验。①未破坏样品(即供试品溶液); ②酸破坏:加1 mol·L-1盐酸溶液1 mL, 摇匀, 置于80 ℃烘箱中加热18 h, 冷却, 用碱中和; ③碱破坏:加1 mol·L-1氢氧化钠溶液1 mL, 摇匀, 置于80 ℃烘箱中加热1.5 h, 冷却, 用酸中和; ④氧化破坏:加30%过氧化氢溶液3 mL, 置于80 ℃烘箱中加热12 h, 冷却; ⑤高温破坏:置80 ℃烘箱中加热65 h(加热过程中如溶剂挥发, 及时补加适量甲醇, 使样品处于溶液状态); ⑥光照:在(5 000±500)lx照度下放置5 d。上述6种溶液分别加甲醇稀释至刻度, 按“2.1”项的色谱条件进样, 用PDA检测器扫描, 得到色谱图, 见图 5。结果显示:各破坏条件产生的降解物质与主峰均能良好分离, 表明该法的专属性较强; 安塞曲匹降解产物均在210 nm有较强吸收, 进一步验证选择210 nm作为检测波长的合理性; 根据PDA扫描图, 可知主峰纯度均符合要求, 证明没有共洗脱峰存在。
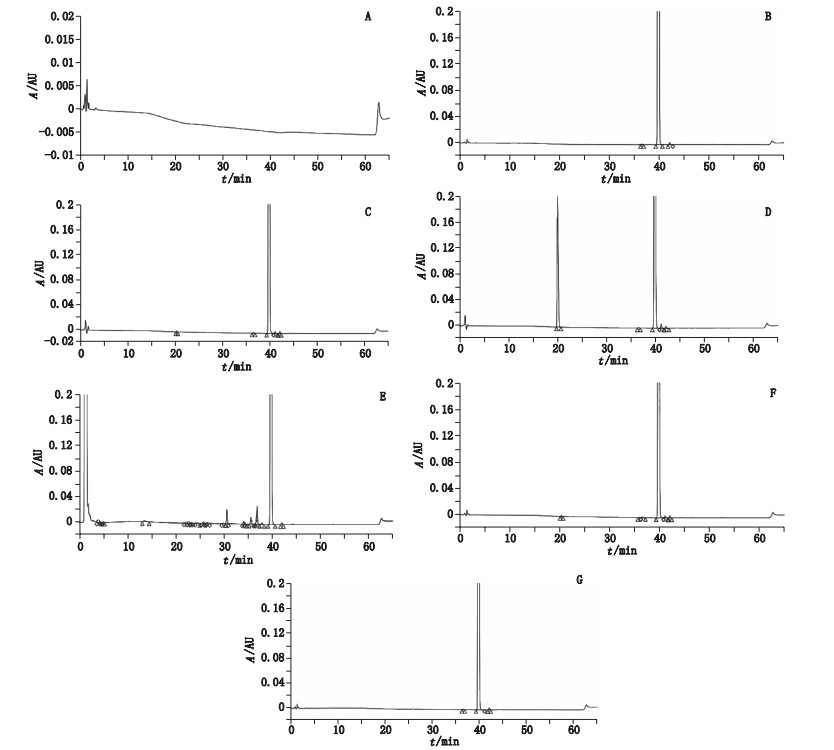
|
A.空白溶剂(blank)B.未经破坏样品(sample solution)C.酸破坏样品(destroyed by acid)D.碱破坏样品(destroyed by alkali)E.氧化破坏样品(destroyed by oxidation)F.高温破坏样品(destroyed by heat)G.光照破坏样品(destroyed by strong light) 图 5 不同降解条件下的HPLC色谱图 Fig.5 HPLC chromatograms in various degradation conditions |
按“2.1”项下色谱条件, 精密量取系统适用性试验项下的混合对照品溶液, 室温放置, 分别于0、2、4、6、8 h进样, 各测定时间点的杂质A、杂质B、杂质C、杂质D、杂质E及安塞曲匹峰面积与0 h比较, 峰面积变化率均在2%以内, 表明溶液在室温条件8 h内稳定。
2.6 精密度试验 2.6.1 进样精密度按“2.1”项下色谱条件, 精密量取系统适用性试验项下的混合对照品溶液, 连续进样6针, 记录峰面积, 结果杂质A、杂质B、杂质C、杂质D、杂质E及安塞曲匹峰面积的RSD依次为0.60%、0.60%、0.40%、0.70%、0.50%、0.40%, 表明该方法进样精密度良好。
2.6.2 重复性试验按“2.1”项下色谱条件, 取本品20 mg, 精密称定, 置20 mL量瓶中, 加甲醇溶解并稀释至刻度, 摇匀, 即得。平行配制6份供试品溶液, 进行测定。以面积归一化法计算各杂质含量, 6份测定结果的单个杂质和总杂质含量的绝对变化值均在0.05%以内, 表明该方法重复性良好。
2.7 线性试验分别精密量取各杂质对照品储备液, 加甲醇稀释制成各杂质质量浓度均为0.5、1、5、10、20、30 μg·mL-1的混合溶液, 依次进样测定, 记录峰面积; 另精密量取安塞曲匹对照品储备液, 加甲醇稀释制成各杂质质量浓度均为0.5、1、10、100、500、1 000 μg·mL-1的溶液, 依次进样测定, 记录峰面积。以峰面积(A)为纵坐标, 浓度(C, μg·mL-1)为横坐标进行线性回归, 得回归方程(n=6)及线性范围, 见表 3。
|
|
表 3 回归方程、线性范围、相关系数及相对校正因子的测定结果 Tab.3 The results of regression equation, linear range, correlation coefficients, relative correction factor of the investigated compounds |
结果表明在各自的线性范围内, 安塞曲匹与5个杂质均呈良好的线性关系, Y轴截距均在100%浓度响应值的10.0%以内。以安塞曲匹为参照物, 计算各杂质相对校正因子, 结果见表 3, 各杂质相对校正因子均在0.8~1.2范围内, 表明可采用面积归一化法计算各杂质含量。
2.8 检测下限和定量下限取线性试验项下质量浓度为4 μg·mL-1的溶液, 逐步稀释后进样测定, 以信噪比约为3时计算检测下限, 以信噪比约为10时计算定量下限, 结果见表 3。
2.9 回收率试验精密称取安塞曲匹供试品500 mg, 置50 mL量瓶中, 加甲醇溶解并稀释至刻度, 摇匀, 精密量取1 mL(量取9份), 置9个10 mL量瓶中; 分别精密量取各杂质对照品储备液1 mL, 置50 mL量瓶中, 制成杂质对照品混合储备液。精密量取杂质对照品混合储备液0.8 mL(80%)、1.0 mL(100%)、1.2 mL(120%)(每个浓度3份), 置于上述9个10 mL量瓶中, 加甲醇稀释至刻度, 摇匀, 按“2.1”项下色谱条件进样, 按外标法计算, 结果杂质A、杂质B、杂质C、杂质D及杂质E的平均回收率(n=9)依次为93.5%、92.5%、94.1%、91.0%、93.2%, RSD依次为1.2%、2.4%、2.7%、1.9%、2.7%。
2.10 耐用性试验分别考察流速(±10%)、柱温(±5℃)、检测波长(±2 nm)及不同品牌不同批次色谱柱条件下系统适用性和供试品有关物质变化情况。各条件下单个杂质和总杂质含量的绝对变化值均在0.05%以内, 系统适用性除保留时间略有变化外, 主峰理论塔板数和主峰与各杂质峰的分离度均符合规定, 表明本法测定安塞曲匹有关物质耐用性良好。
2.11 样品测定按“2.1”项下色谱条件, 取本品20 mg, 精密称定, 置20 mL量瓶中, 加甲醇溶解并稀释至刻度, 摇匀, 即得。精密量取供试品溶液10 μL进样分析, 按上述方法同时测定3批样品, 杂质A、杂质B、杂质C、杂质D及杂质E均未检出, 用面积归一化法计算各杂质含量, 结果见表 4。
|
|
表 4 有关物质测定结果(%) Tab.4 Determination of the related substances |
选择0.025%三氟乙酸-乙腈体系时, 基线噪音大, 干扰杂质测定; 0.1%磷酸-甲醇体系, 由于主峰极性小, 出峰晚, 故最终选择0.1%磷酸-乙腈体系为流动相的梯度洗脱方法测定安塞曲匹的有关物质。
3.1.2 溶剂的选择成品在乙腈和水中溶解性不佳, 选择60%乙腈为溶剂时, 样品不能完全溶解, 呈浑浊状, 过滤后仍不能改善, 故最终选择甲醇作为溶剂。
3.1.3 检测波长的选择安塞曲匹、杂质A~E及各破坏条件下产生的降解杂质均在210 nm波长处有较强吸收, 故最终选择210 nm作为检测波长。
3.2 强制破坏试验从降解试验可以看出, 安塞曲匹原料性质稳定, 采用剧烈的酸、高温、光照条件均未发生明显降解, 仅在碱和氧化条件下发生了降解。
按照面积归一化法计算, 安塞曲匹在碱降解条件下, 相对保留时间约为0.50和1.03的杂质分别增长10.02%和0.31%;氧化降解条件下, 出现多个新杂质, 相对保留时间约为0.10、0.77、0.90、0.93的杂质分别增长0.78%、0.93%、0.47%、1.43%。对试验中主要降解产物的结构分析有待进一步研究, 以更好地控制安塞曲匹的质量。
3.3 小结本文采用高效、快速、专属性强的HPLC法测定 安塞曲匹有关物质,成功分离了安塞曲匹及其杂质 A~E。该法专属性强,准确度高,可用于安塞曲匹的 质量控制。
| [1] |
KRISHNA R, GARG A, PANEBIANCO D, et al. Single-dose pharmacokinetics and pharmacodynamicsofanacetrapib, a potent cholesteryl ester transfer protein(CETP) inhibitor, in healthy subjects[J]. Br J ClinPharmacol, 2009, 68(4): 535. |
| [2] |
BRODEUR MR, RHAINDS D, CHARPENTIER D, et al. Dalcetrapib andanacetrapibdifferently impact HDL structure and function in rabbits and monkeys[J]. J Lipid Res, 2017, 58(7): 1282. DOI:10.1194/jlr.M068940 |
| [3] |
MILLAR JS, LASSMAN ME, THOMAS T, et al. Effects of CETP inhibition withanacetrapibon metabolism of VLDL-TG and plasma apolipoproteins C-Ⅱ, C-Ⅲ, and E[J]. J Lipid Res, 2017, 58(6): 1214. DOI:10.1194/jlr.M074880 |
| [4] |
MILLAR JS, REYES-SOFFER G, JUMES P, et al. Anacetrapiblowers LDL by increasing ApoB clearance in mildly hypercholesterolemic subjects[J]. J Clin Invest, 2015, 125(6): 2510. DOI:10.1172/JCI80025 |
| [5] |
ÄIJÄNEN T, KOIVUNIEMI A, JAVANAINEN M, et al. How anacetrapib inhibits the activity of the cholesteryl ester transfer protein? Perspective through atomistic simulations[J]. PLoS Comput Biol, 2014, 10(11). |
| [6] |
KRISHNA R, STYPINSKI D, ALI M, et al. Lack of a meaningful effect ofanacetrapibon the pharmacokinetics and pharmacodynamics of warfarin in healthy subjects[J]. Br J Clin Pharmacol, 2012, 74(1): 116. DOI:10.1111/bcp.2012.74.issue-1 |
| [7] |
YVAN-CHARVET LAURENT, KLING J, PAGLER T, et al. Cholesterol efflux potential and anti-inflammatory properties of HDL following treatment with niacin or anacetrapib[J]. Arterioscler Thromb Vasc Biol, 2010, 30(7): 1430. DOI:10.1161/ATVBAHA.110.207142 |
| [8] |
KRISHNA R, GARG A, JIN B, et al. Assessment of a pharmacokinetic and pharmacodynamic interaction between simvastatin andanacetrapib, a potent cholesteryl ester transfer protein (CETP) inhibitor, in healthy subjects[J]. Br J Clin Pharmacol, 2009, 67(5): 520. DOI:10.1111/bcp.2009.67.issue-5 |
| [9] |
MILLAR JS, REYES-SOFFER G, JUMES P, et al. Anacetrapiblowers LDL by increasing ApoB clearance in mildly hypercholesterolemic subjects[J]. J Clin Invest, 2016, 126(4): 1603. |
| [10] |
van der TUIN SJ1, KÜHNAST S2, BERBÉE JF, et al. Anacetrapibreduces(V) LDL cholesterol by inhibition of CETP activity and reduction of plasma PCSK9[J]. J Lipid Res, 2015, 56(11): 2085. DOI:10.1194/jlr.M057794 |
| [11] |
SARAH G. Polymer Formulations of Cetp Inhibitors: U. S., WO2007/092642 A2[P]. 2007-02-09
|
| [12] |
MERCK&CO. Process for Synthesizing a Cetp Inhibitor: U. S., 2007/005572 A1[P]. 2006-06-29
|
| [13] |
CHEOL C. Process for a Cetp Inhibitor: U. S., 2013/066768 A1[P]. 2012-10-26
|
 2019, Vol. 39
2019, Vol. 39 
