2型糖尿病(type Ⅱ diabetes mellitus, T2DM)已成为当今世界性公共卫生问题和健康问题, 据统计, 我国T2DM发病率为15.5%左右, 并且约有52%的成年人群为糖耐量受损人群, 如不采取有效措施加以控制, 一旦进入发病阶段, 将对人体健康造成严重影响[1-3]。近年来, 肠道菌群组成是糖尿病调节机制研究的一个热点, 研究发现, 肠道菌群结构紊乱可引发机体免疫力下降, 营养组分结构改变, 胰岛素抵抗等代谢失调, 能量失衡等, 在T2DM发生、发展过程中起着重要作用[4-5]。目前, 已有学者研究发现, 高脂膳食改变肠道菌群结构与功能, 引起机体脂代谢失衡, 与肥胖、T2DM的产生密切相关, 但仍未完全阐明肠道菌群与肥胖、T2DM的易感性的关系[6]。本研究采用代谢组学方法, 比较不同模型大鼠血糖、血清胰岛素, 粪便游离氨、短链脂肪酸和肠道菌群的动态变化, 研究高脂膳食与肠道菌群、肠道内环境及胰岛素抵抗的相关性, 明确高脂膳食在T2DM发病进程中的作用机制。
1 材料与方法 1.1 动物、饲料和主要试剂健康SD雄性大鼠(海南大学实验动物中心提供, 动物合格证号为SCXK琼2014-0011), 二级, 清洁, 20只, 体质量(200 ±20)g。高脂高糖饲料(配方:猪油10%、胆固醇2%、丙基硫氧嘧啶0.1%、胆酸钠0.5%、蛋黄粉10%和基础饲料, 批号D12492, 浙江斯涛利科技有限公司)。基因组DNA提取试剂盒(Abcam公司); 饱和酚(PH 8.0)、三氯甲烷、EB溶液、100 bp Marker均购自武汉金开瑞生物工程有限公司; PCR引物合成(上海生工生物公司); 大鼠胰岛素试剂盒(ALPCO公司); 氨氮检测试剂盒(北京中诺泰安科技有限公司)。
1.2 主要仪器UV-2600紫外可见分光光度计(岛津公司), XS204SX精密天平(梅特勒托利多公司), HGM-114血糖仪(欧姆龙公司), Vii ATM7型Real time RCR扩增仪(Applied Biosystems公司), 7693气相色谱分析仪(Agilent公司)。
1.3 动物分组和处理所有大鼠经基础饲料适应性喂养2周后, 采集每只大鼠的粪便样品和空腹血, 记为“零时刻”, 然后按体质量随机分为2组:造模组10只, 喂食高脂饲料; 对照组10只, 继续喂食普通饲料。连续喂养9周, 饲养条件:室温(24±1)℃, 相对湿度45%~65%。期间所有大鼠自由摄食、饮水, 每周称量并记录大鼠体质量、体长1次, 观察大鼠的生理变化, 主要包括毛发、活跃度等。
1.4 检测指标及方法 1.4.1 动物处理及留取标本分别在第1周、3周、6周和9周时采用腹部按摩法采集大鼠新鲜粪便, 用于粪便游离氨、pH、短链脂肪酸含量测定。同时采用断尾取血方法获取大鼠空腹血浆1 mL, 分为两部分, 一部分用于血糖监测, 另一部分用于胰岛素测定。
1.4.2 血糖监测取大鼠空腹血浆0.5 mL, 进血糖仪检测。
1.4.3 胰岛素测定取大鼠空腹血浆0.5 mL, 离心, 取血清采用ELISA试剂盒法测定。
1.4.4 粪便游离氨测定称取粪便样品0.2 g, 于10 mL溶解, 4 000 r·min-1离心5 min, 吸取上清液1 mL, 采用氨氮检测试剂盒进行测定。
1.4.5 短链脂肪酸测定参照罗剑鸣等[7]提出的测定方法, 取0.2 g的粪便样品进气相色谱分析仪进行测定。
1.4.6 肠道菌群多样性测序(委托上海英俊生物技术有限公司完成)参照试剂盒说明书, 提取第9周各组大鼠粪便的总DNA, 进行ERIC-PCR试验。PCR程序:95 ℃预变性4 min, 95 ℃变性20 s, 55 ℃退火20 s, 75 ℃延伸55 s, 43个循环, 75 ℃延伸5 min。ERIC1引物序列:5’-AACGGTCCCTGCCTTGAAA-3’; ERIC2引物序列:5’-CGATTGACCAGCCTATACC-3’。对扩增后的产物进行检查, 合格的文库用Illumina进行测序, 然后对测序数据进行过滤及双端拼接, 得到优化序列, 进行相似度分析。
1.5 统计处理应用SPSS19.0软件进行统计分析, 所有计量资料以均数±标准差(x±s)表示, 多个样本均数比较采用重复测量数据的方差分析, 组间两两比较采用LSD比较; 各时间段的组间比较采用单因素方差分析(one-way ANOVA)。P < 0.05表示差异有统计学意义。
2 结果 2.1 大鼠空腹血糖和血清胰岛素动态变化造模组大鼠的空腹血糖水平随着研究周期的推移呈逐渐增高的趋势, 而对照组无明显变化。与对照组相比, 造模组大鼠在第6周和第9周的空腹血糖水平显著提高(P < 0.05), 并且在第6周时造模组大鼠的血糖值大于11 mmol·L-1。见图 1-A。
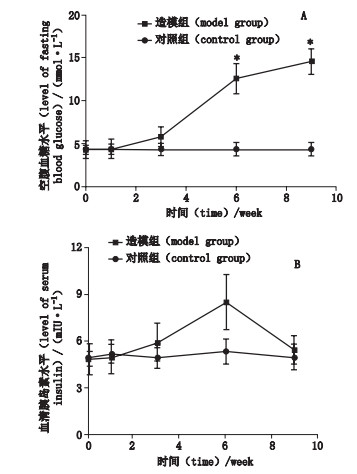
|
A.空腹血糖(fasting blood glucose)B.血清胰岛素(与对照组相比, *P < 0.05)[serum insulin(compared with the control group, *P < 0.05)] 图 1 2组大鼠空腹血糖和胰岛素的动态变化 Fig.1 The dynamic changes of fasting blood glucose and insulin in the two groups of rats |
造模组大鼠的血清胰岛素水平在第6周时达到峰值, 随后呈现持续下降, 说明造模组大鼠出现胰岛素抵抗; 对照组在研究期间血清胰岛素水平无明显变化。与对照组相比, 造模组大鼠在第3周和第6周的血清胰岛素水平显著提高(P < 0.05)。见图 1-B。
2.2 大鼠粪便游离氨含量的动态变化造模组大鼠粪便游离氨水平在第6周时达到峰值, 随后呈现缓慢下降; 对照组则呈缓慢增高趋势。与对照组相比, 造模组大鼠在第3周、第6周和第9周的粪便游离氨水平显著提高(P < 0.05)。见图 2。
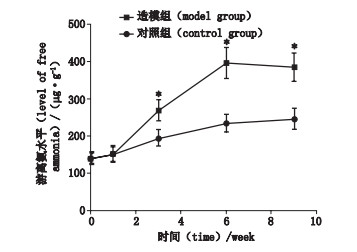
|
图 2 2组大鼠粪便游离氨水平的动态变化(与对照组相比, *P < 0.05) Fig.2 The dynamic changes in the level of free ammonia in the feces of the two groups of rats(compared with the control group, *P < 0.05) |
造模组和对照组大鼠粪便中乙酸、丙酸、丁酸、总短链脂肪酸水平随着研究周期的推移呈逐渐降低的趋势。与对照组相比, 造模组大鼠在第9周的粪便中乙酸、丙酸、丁酸水平显著降低(P < 0.05), 并且在第3周、第6周和第9周的粪便中总短链脂肪酸水平均显著降低(P < 0.05)。见图 3。

|
A.乙酸(acetic acid)B.丙酸(propionic acid)C.丁酸(butyric acid)D.总短链脂肪酸(total short chain fatty acids) 图 3 2组大鼠粪便短链脂肪酸的动态变化(与对照组相比, *P < 0.05) Fig.3 The dynamic changes of short chain fatty acids in the feces of the two groups of rats(compared with the control group, *P < 0.05) |
高脂饮食是T2DM的重要诱发因素, 与过度的能量吸收和游离脂肪酸增加对胰岛素受体的影响有关, 且与肠道菌群失衡相关。图 4是11组大鼠肠道菌群的聚类分析, 此树主要有2个分支:造模组9号、11号和其他组号, 说明造模组9号、11号的肠道菌群组成与其他组号大鼠有显著差异; 而在其他组号中, 造模组7号和10号在最外层, 说明造模组肠道菌群组成与对照组差异较大。
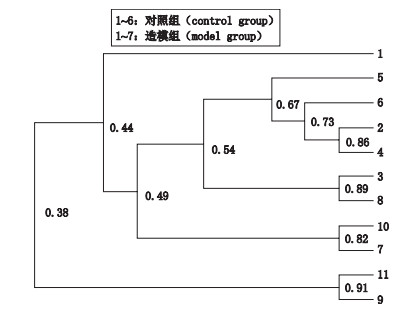
|
图 4 2组大鼠肠道菌群群落结构相似度的聚类分析 Fig.4 Cluster analysis of the community structure similarity of intestinal flora in two groups of rats |
图 5是11组大鼠的肠道菌群的PCoA分析图, 可以看出图中明显分成2个区域, 对照组大鼠距离很近, 说明肠道菌群差异不显著。而造模组(除8号外)与对照组距离较大, 说明2组之间的肠道菌群存在显著差别。
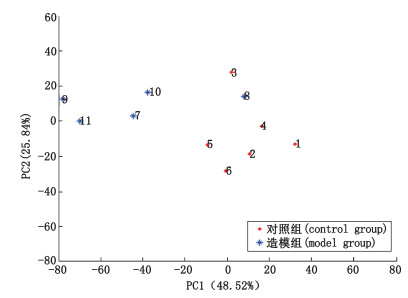
|
图 5 2组大鼠肠道菌群PCoA分析图 Fig.5 PCoA analysis of intestinal microflora in two groups of rats |
据国际糖尿病联合会估计, 目前全球约8.3%的成年人患有糖尿病, 预计到2030年, 人数将上升至5.92亿, 其中T2DM占90%以上[8-10]。T2DM属于多基因疾病, 病因复杂, 与多种遗传和环境因素作用致胰岛β细胞功能受损有关, 其中比较重要的便是饮食结构的改变。国际糖尿病联盟全球共识[11]中明确指出, 肥胖是发生T2DM的独立危险因素之一, 并且T2DM人群中约80%以上为肥胖者。研究发现, 随着膳食中脂肪占总能量百分比增加, 国民的体质量和肥胖发生率明显升高, 无疑加重了糖尿病发病的几率[12]。Cani等[13]研究发现, 高脂膳食能强烈增加小鼠肠道通透性, 减少紧密连接蛋白基因的表达, 这种效应与降低葡萄糖耐受, 体质量增加和脂肪积累, 氧化应激和巨噬细胞浸润在内脏脂肪组织中的表达密切相关, 最终诱导小鼠出现糖尿病。Remsberg等[14]研究发现, 高脂膳食通过诱导肠道菌群结构改变, 刺激机体发生低度炎症反应, 最终导致肥胖或T2DM等代谢综合征。本研究通过对实验大鼠连续喂食高脂饲料, 结果在第6周时造模组大鼠的血糖值大于11 mmol·L-1, 且血清胰岛素水平在第6周后呈现持续下降, 而血糖值持续升高, 说明高脂膳食造成大鼠出现胰岛素抵抗, 原因可能在于细胞对胰岛素作用不敏感, 使葡萄糖进入肌肉细胞受阻, 利用率减少, 造成血糖升高, 提示长期高脂膳食能诱发T2DM的发生[15]。然而其中涉及的作用机制, 仍需通过进一步分子生物学试验进行观察。
有学者开发了宏基因组范围关联研究(MGWAS)的方案, 对T2DM患者的肠道微生物含量进行分析, 结果显示肠道菌群在T2DM发病机制中的作用趋向于“功能性失调”, 而不是此前认为存在的某个或某些特定菌种, 直接参与到疾病的发生[16]。为了进一步明确高脂膳食在加重T2DM发病进程的机制, 本研究采用代谢组学方法比较不同模型大鼠粪便游离氨、短链脂肪酸和肠道菌群的动态变化, 研究高脂膳食与肠道菌群、肠道内环境关系。结果显示, 造模组大鼠在第3周、第6周和第9周的粪便游离氨水平显著高于对照组(P < 0.05)。肠道内游离氨主要是由细菌分泌的脲酶分解尿总碱产生的, 一部分游离氨在大肠中被用于细菌蛋白质的合成, 一旦肠道菌群结构失调, 将会导致尿总碱合成受阻, 产生更多的氨[17]。因此, 本研究结果提示, T2DM大鼠存在肠道菌群结构失调。短链脂肪酸的动态变化分析结果显示, 造模组大鼠粪便中乙酸、丙酸、丁酸、总短链脂肪酸水平显著低于对照组(P < 0.05)。越来越多的研究发现, 肠道功能和形态改变, 通透性增加在糖尿病发病机制中发挥着关键作用[18-20]。本实验中T2DM大鼠短链脂肪酸含量显著下降可能是肠道通透性增加引起的。为了进一步确定T2DM是否存在肠道菌群结构失调, 本研究对肠道微生物与T2DM的宏基因组进行关联分析, 发现两组之间的肠道菌群存在显著差别, 说明高脂膳食可以引起肠道微生态失衡, 进而在T2DM发病过程中加重肠道菌群的变化。
综上所述, 高脂膳食会造成大鼠肥胖, 使身体处于不健康的代谢紊乱状态, 主要体现在血糖增高, 胰岛素抵抗, 粪便游离氨水平升高, 粪便短链脂肪酸的代谢降低和肠道菌群结构失调, 进而加重T2DM发病进程。而这些过程均涉及肠道菌群结构失调, 提示高脂膳食引起T2DM的产生可能与肠道菌群有关, 但需要进一步深入研究证实。此外, 高脂膳食必然会造成大鼠血脂水平的变化, 但是本研究并未对血脂变化与肠道菌群、代谢产物的相关性进行探讨, 针对此方面的不足, 笔者拟在未来的研究中予以分析。
| [1] |
LONG L, WANG J, LU X, et al. Protective effects of scutellarin on type Ⅱ diabetes mellitus-induced testicular damages related to reactive oxygen species/Bcl-2/bax and reactive oxygen species/microcirculation/staving pathway in diabetic rat[J]. J Diabetes Res, 2015, 15(10): 1. |
| [2] |
MUSSAVIRA S, DHARMALINGAM M, OMANA SUKUMARAN B. Salivary glucose and antioxidant defense markers in type Ⅱ diabetes mellitus[J]. Turk J Med Sci, 2015, 45(1): 141. |
| [3] |
BARAZANDEGAN M, EKRAM F, KWOK E, et al. Assessment of type Ⅱ diabetes mellitus using irregularly sampled measurements with missing data[J]. Bioprocess Biosyst Eng, 2015, 38(4): 615. DOI:10.1007/s00449-014-1301-7 |
| [4] |
BREHM B, LATTIN BS, BOBACK J, et al. One-year comparison of a high-monounsaturated fat diet with a high-carbohydrate diet in type 2 diabetes[J]. Diabetes Care, 2009, 32(2): 215. DOI:10.2337/dc08-0687 |
| [5] |
PAREKH PJ, NAYI VR, JOHNSON DA, et al. The role of gut microflora and the cholinergic anti-inflammatory neuroendocrine system in diabetes mellitus[J]. Front Endocrinol, 2016, 7(3): 55. |
| [6] |
de La SERRE CB, ELLIS CL, LEE J, et al. Propensity to high-fat diet-induced obesity in rats is associated with changes in the gut microbiota and gut inflammation[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 299(2): 440. DOI:10.1152/ajpgi.00098.2010 |
| [7] |
罗剑鸣, 饶洁, 冯嘉韵, 等. 3种不溶性复合膳食纤维对小鼠肠道内短链脂肪酸产生的影响[J]. 食品科学, 2012, 33(3): 225. LUO JM, RAO J, FENG JY, et al. Effects of insoluble compound dietary fibers on short-chain fatty acid production in the intestinal tract of rats[J]. Food Sci, 2012, 33(3): 225. |
| [8] |
KUMAR V, JAGANNATHAN A, PHILIP M, et al. Role of yoga for patients with type Ⅱ diabetes mellitus:a systematic review and meta-analysis[J]. Complement Ther Med, 2016, 25(4): 104. |
| [9] |
van der ZWAAN GL, van DIJK SE, ADRIAANSE MC, et al. Diagnostic accuracy of the patient health questionnaire-9 for assessment of depression in type Ⅱ diabetes mellitus and/or coronary heart disease in primary care[J]. J Affect Disord, 2015, 190(13): 68. |
| [10] |
MOTAWI TMK, EL-REHANY MA, RIZK SM, et al. Genetic polymorphism of estrogen receptor alpha gene in Egyptian women with type Ⅱ diabetes mellitus[J]. Meta Gene, 2015, 6: 36. DOI:10.1016/j.mgene.2015.08.001 |
| [11] |
刘志民, 刘子毓. 代谢综合征研究现状及展望[J]. 中华老年心脑血管病杂志, 2015, 17(4): 337. LIU ZM, LIU ZY. Research status and expectation of metabolic syndrome[J]. Chin J Geriatr Cardiovasc Cerebrovasc Dis, 2015, 17(4): 337. DOI:10.3969/j.issn.1009-0126.2015.04.001 |
| [12] |
MELANSON EL, ASTRUP A, DONAHOO WT. The relationship between dietary fat and fatty acid intake and body weight, diabetes, and the metabolic syndrome[J]. Ann Nutr Metab, 2009, 55(55): 229. |
| [13] |
CANI PD, BIBILONI R, KNAUF C, et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice[J]. Diabetes, 2008, 57(6): 1470. DOI:10.2337/db07-1403 |
| [14] |
REMSBERG JR, EDIGER BN, HO WY, et al. Deletion of histone deacetylase 3 in adult beta cells improves glucose tolerance via increased insulin secretion[J]. Mol Metab, 2017, 6(1): 30. DOI:10.1016/j.molmet.2016.11.007 |
| [15] |
胡钰梅, 夏佳佳, 任伟. 钠-葡萄糖协同转运蛋白2抑制剂改善胰岛素敏感性及胰岛β细胞功能的研究进展[J]. 中国糖尿病杂志, 2015, 23(5): 475. HU YM, XIA JJ, REN W. Progresses of sodium glucose co-transporter-2 inhibitors on improving insulin sensitivity and islet β cell function[J]. Chin J Diabetes, 2015, 23(5): 475. DOI:10.3969/j.issn.1006-6187.2015.05.025 |
| [16] |
QIN J, LI Y, CAI Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes[J]. Nature, 2012, 490(7418): 55. DOI:10.1038/nature11450 |
| [17] |
鲜凌瑾, 唐勇. 肠道细菌微生态与人类疾病关系研究进展[J]. 微生物学免疫学进展, 2015, 43(4): 75. XIAN LJ, TANG Y. The relationship between gut microbiota and human disease[J]. Prog Microbiol Immunol, 2015, 43(4): 75. |
| [18] |
LI X, ATKINSON MA. The role for gut permeability in the pathogenesis of type 1 diabetes-A solid or leaky concept?[J]. Pediatr Diabetes, 2015, 16(7): 485. DOI:10.1111/pedi.12305 |
| [19] |
郭霄, 张勇, 郭建林, 等. Ⅱ型糖尿病与肠道菌群及益生菌的相关性研究进展[J]. 中国乳品工业, 2013, 41(8): 48. GUO X, ZHANG Y, GUO JL, et al. Research progress on relationship between type 2 diabetes gut microbiota and probiotics[J]. China Dairy Ind, 2013, 41(8): 48. DOI:10.3969/j.issn.1001-2230.2013.08.012 |
| [20] |
CHASSAING B, KOREN O, GOODRICH JK, et al. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome[J]. Nature, 2015, 519(7541): 92. DOI:10.1038/nature14232 |
 2019, Vol. 39
2019, Vol. 39 