2. 天津市第三中心医院检验科, 天津市人工细胞重点实验室, 卫生部人工细胞工程技术研究中心, 天津 300170
2. Department of Inspection, Tianjin Third Central Hospital, Tianjin Artificial Cell Key Laboratory, Ministry of Health Artificial Cell Engineering Technology Research Center, Tianjin 300170, China
代谢组学技术包括色谱技术、质谱技术和磁共振技术等多种技术手段, 鉴于其具有检测速度快, 仪器自动化高, 高通量, 检测质量能够控制和重复性良好等优点, 代谢组学引起越来越多的科研工作者的重视, 已经在临床得到一定应用[1]。目前, 已有大量研究试图用代谢组学技术探讨在肝硬化及肝癌等重大肝脏疾病发生发展过程中代谢标志物的变化[2-3], 并应用于临床标本进行验证[4]。溶血磷脂酰胆碱(lysophosphatidylcholine, LPC), 又称溶血卵磷脂, 是广泛存在于人体细胞内外的一种具有强溶血作用的磷脂类物质, 然而其在体内的作用机制目前尚不明确。代谢组学技术是检测LPC类物质最常用的手段, 但常常受到多种因素的影响, 各研究即便采用相同的对照疾病组, 结果也存在一定的差异。有研究表明, 患者体内LPC含量会显著增高[5], 也有研究表明LPC类物质受肝脏功能的影响, 患者血液中浓度较少甚至消失[6]。另外, 有研究表明, 2种或以上技术手段检测血液中的LPC类物质明显优于单一检测方法[7]。
本研究在前期实验基础上, 通过靶向代谢组学的液相色谱-串联质谱(LC-MS/MS)联合, 建立定量检测与肝硬化及肝癌等肝脏重大疾病诊断相关的5个饱和LPC类物质(包括LPC 14:0、LPC 15:0、LPC 16:0、LPC 17:0和LPC 18:0)方法, 以期为代谢组学技术手段在临床上疾病的筛选或诊断提供重要的支持。
1 材料与方法 1.1 试剂和仪器人血清标本由天津市第三中心医院提供, 均为在清晨空腹下抽取, 离心取血清后于-80℃下保存, 分析前室温下解冻。甲酸和甲酸铵(Mreda公司生产, 纯度均是HPLC级), 甲醇(Honeywell公司生产, 纯度为LC-MS级), 2, 6-二叔丁基对甲酚(BHT, 威企业有限公司, 优级纯), Durashell C18(L)色谱柱(孔径150 Å, 粒径约5 μm, 大小为3.0 mm×50 mm)、Cleanert PPT 96孔蛋白沉淀板(货号96CD2025Q)、Cleanert M96生物样品前处理仪、Cleanert ® V96样品氮吹浓缩仪和96孔收集板均购自天津博纳艾杰尔科技有限公司。质谱仪为Applied biosystems公司下属的AB/SCIEX生产部门制造的API 4000+, 质谱仪中使用TurboV离子源、三重四极杆(Triple quadruple)作为串联质谱的质量分析装置。实验中使用的其他试剂:LPC 14:0、LPC 15:0、LPC 16:0、LPC 17:0和LPC 18:0的标准品均购自美国Avanti公司, 纯度为100%。内标物质利血平由Sigma公司生产提供。
1.2 方法 1.2.1 HPLC-MS/MS方法学建立人血清样本中含有大量的蛋白质, 影响LPC类物质的定量检测, 所以需要对样本进行预处理除去干扰蛋白质。主要步骤如下:1)为保护人血中溶血磷脂酰胆碱, 试验中使用的甲醇均含有0.1%的BHT。0.1%的BHT甲醇溶液配制方法:70 mL甲醇溶液加入BHT 70 mg, 充分涡旋使BHT完全溶解。2)样本去除蛋白前的预处理过程:标准曲线及质控样本的配制方法是取100 μL生理盐水与25 μL标准工作液(或质控品)混合, 充分涡旋均匀即可; 对于临床样本而言则每1份临床样本取100 μL血清样品至EP管内, 再加入甲醇25 μL, 充分涡旋均匀即可备用。3)先向Cleanert PPT 96孔蛋白沉淀板中加入甲醇(含100 μg·L-1利血平)150 μL, 再加入上述预处理混合的待测样本25 μL, 使用96孔板振荡器于600 r·min-1涡旋5 min, 混合均匀后静置10 min, 最后使用Cleanert M96生物样品前处理仪将去蛋白后的溶液收集到洁净的收集板中备用。4)将收集板里的溶液在Cleanert® V96样品氮吹浓缩仪中用氮气吹干, 温度设定为30℃。吹干后标本再于1 mL 80%甲醇水溶液中复溶, 涡旋器上混合均匀后即可上机进行测试。上机测试过程中, HPLC流动相参数见表 1, 流速均设定为800 μL·min-1, 柱温固定在30℃, 进样量设定为5 μL。经HPLC分离后的样本进入质谱仪进行鉴定和定量分析, 质谱仪的参数设置见表 2。质谱检测条件如下:碰撞气CAD 41.37 kPa, 气帘气CUR 137.9 kPa, 雾化气GS1 137.9 kPa, 辅助加热气GS2 344.75 kPa, 喷雾电压5.5 kV。离子化温度600℃。
|
|
表 1 HPLC的流动相条件 Tab.1 Mobile phase conditions of HPLC |
|
|
表 2 质谱条件参数信息 Tab.2 MS parameter information |
由于难以获得完全不含5个待测LPC类物质的基质, 本研究采用0.9%的生理盐水代替人血清进行方法学评估和性能验证。将20 μL生理盐水加入5 μL的标准工作液作为待检测样本进行去蛋白处理, 并按照上述参数设定HPLC和MS的条件后上机检测。
HPLC-MS/MS实验平台线性范围和灵敏度的评估, 称取LPC 14:0、LPC 15:0、LPC 16:0、LPC 17:0和LPC 18:0的标准品分别为1.875、3.750、56.250、5.625和37.500 mg, 溶解于5 mL甲醇溶液中, 取5 μL移至20 μL甲醇溶液中, 即制成表 3中S7浓度的样本。用S7样本倍比稀释成S1~S6梯度浓度的样本, 用于标准曲线确定和线性关系验证。将S1浓度水平样本稀释至更低浓度梯度上机检测, 测定信噪比(S/N), 直至S/N为10:1。再平行处理5个样本, 满足精密度(RSD)小于20%, 则此时的样本浓度即为仪器的检测下限(LOD)。
|
|
表 3 标准曲线样品配制浓度 Tab.3 Concentrations of samples for standard curve |
为验证本HPLC-MS/MS实验平台精密度和准确度, 以生理盐水为基质, 配制出S3和S5 2个浓度水平的标准样本, S3为低加样浓度, S5为高加样浓度。对S3和S5 2个浓度水平的标准样本, 分别进行8个样本的平行试验。根据实测值和配制溶液的加样浓度, 计算平均值x及标准差SD、加样回收率和精密度(RSD)。
为验证本HPLC-MS/MS实验平台对人血清样本的适用性, 以人血清代替生理盐水配制成S3和S5 2个浓度梯度的加标准品的"加样血清", 进行加标回收率的检测。按照上述同样的步骤和设置, 测定加标血清中LPC 14:0~LPC 18:0 5个LPC类物质的含量, 记为加样血清浓度。在此基础上, 验证了HPLC-MS/MS实验平台在乙肝相关性肝细胞肝癌(HBV-HCC)患者血清的适用性。
1.3 统计学方法HPLC-MS/MS平台标准曲线是由工作站软件Analyst®自动处理给出, 其主要原理是根据检测的S1~S7系列浓度和相应的峰面积, 绘制标准浓度/内标物浓度-标准浓度面积/内标物面积的曲线, 并计算曲线方程和相关系数r。以生理盐水为基质的加样回收率计算公式[8]:加样回收率=(加样实测浓度/加样浓度)×100%;精密度RSD=标准差SD/平均值x。以人血清为基质的加样回收率计算公式:回收率=(加样血清浓度-人血清平均浓度)/加样浓度×100%。利用SPSS 21.0软件进行统计分析, 分析不同巴塞罗那分期亚组HBV-HCC患者血清中5个LPC类物质水平。P < 0.05或P < 0.01, 均被认为具有统计学意义。
2 结果 2.1 HPLC-MS/MS平台灵敏度和线性结果用检测下限(LOD)值表示本HPLC-MS/MS技术平台的灵敏度, 直接记录检测结果S/N=10:1时的样品浓度, 即为LOD值。经检验, LPC 14:0、LPC 15:0、LPC 16:0、LPC 17:0和LPC 18:0的LOD值分别为0.027、0.12、0.32、0.059和0.072 μg·mL-1。相邻2个峰的分离良好, S2浓度水平溶液的检测结果如图 1所示。
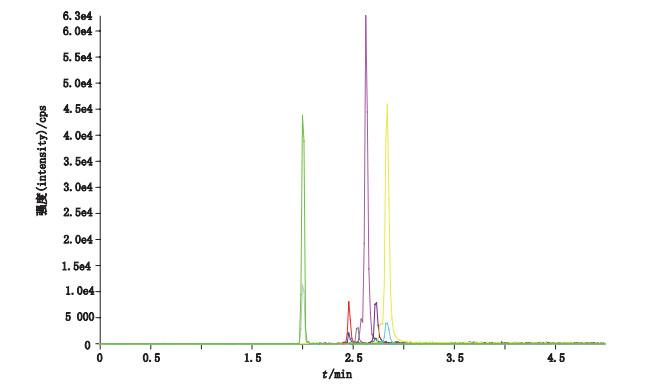
|
图 1 S2浓度标准溶液的色谱图 Fig.1 Chromatogram of standard solution at S2 concentration |
根据表 3配制上机的不同浓度梯度溶液, 分析图谱中峰面积绘制标准曲线。线性范围的评估过程中, S1~S7共计7个系列浓度均在线性范围内, 但是更高浓度的LPC 16:0和LPC 18:0检测显示其线性程度变差(数据未显示), 故而认为LPC 14:0~LPC 18:0 5个物质在该平台检测的线性范围即S1~S7浓度范围。在该范围内的检测结果可信, 超出范围的检测结果不可信。LPC 14:0~LPC 18:0 5个物质的回归方程如下:
| $ \begin{array}{*{20}{l}} {Y = 0.725X - 0.00264\;\;\;\;r = 0.9976}\\ {Y = 0.212X - 0.0256\;\;\;\;r = 0.9992}\\ {Y = 1.22X + 1.84\;\;\;\;r = 0.9927}\\ {Y = 0.861X - 0.0155\;\;\;\;r = 0.9980}\\ {Y = 0.813X + 0.558\;\;\;\;r = 0.9943} \end{array} $ |
以生理盐水为基质, 进行加样回收试验, 验证HPLC-MS/MS平台精密度和准确度(表 4)。结果S3低加样浓度、S5高加样浓度水平上LPC 14:0~LPC 18:0加样回收率均在85%~115%范围内。LPC 14:0~LPC 18:0在S3水平的精密度RSD分别为6.3%、6.4%、8.5%、7.1%和7.0%;LPC 14:0~LPC 18:0在S5浓度的RSD结果分别为11.3%、12.1%、12.3%、12.0%和11.3%。5个LPC类物质的RSD检测结果均小于15%。
|
|
表 4 加样回收试验评估HPLC-MS/MS平台准确度、精密度 Tab.4 Precision and accuracy assessment of HPLC-MS/MS platform by spiked recovery experiments |
以人血清为基质, 进行加样回收试验, 明确HPLC-MS/MS平台在人血清中应用的适用性(表 5)。2份人血清样本LPC 14:0~LPC 18:0质量浓度分别为0.83、2.46、107.00、2.92、47.30 μg·mL-1以及0.68、2.21、92.00、2.45、39.4 0 μg·mL-1。加样血清样本LPC 14:0~LPC 18:0的浓度明显高于灵敏度和线性范围的LOD值, 且都处于线性验证试验范围内, 结果可信。S3低加样浓度、S5高加样浓度血清加样回收率均落在85%~115%范围内, 与以生理盐水为基质的加样回收率差异不显著。HPLC-MS/MS平台对血清样本也有良好的适用性, 人血清对该HPLC-MS/MS平台影响不大。
|
|
表 5 HPLC-MS/MS平台对血清样本的适用性分析 Tab.5 Applicability evaluation of HPLC-MS/MS platform for human serum samples |
此外, 本研究利用HPLC-MS/MS平台分析了82例HBV-HCC患者血清中5个LPC类物质水平(表 6)。根据巴塞罗那分期, 所有患者被分为4组:单个肿瘤(A1期、A2期和A3期)患者为BCLC-Ⅰ组(n=27);多个肿瘤, 肿瘤直径 < 3 cm者(A4期)患者为BCLC-Ⅱ组(n=16);将多个肿瘤, 肿瘤体积较大, 肝脏尚可代偿者(B期)患者为BCLC-Ⅲ组(n=18);肝功能失代偿, 处于进展期或晚期C期和D期患者为BCLC-Ⅳ组(n=21)。结果表明, LPC 14:0~LPC 18:0 5个代谢标志物在各巴塞罗那亚组患者血清中浓度差异显著, 具有统计学意义(P < 0.05)。可见, 利用HPLC-MS/MS平台测定的5个LPC类物质, 对不同巴塞罗那期HBV-HCC患者具备一定的鉴别能力。
|
|
表 6 LPC 14:0~LPC 18:0在不同CTP分级HVB-HCC患者之间的比较 Tab.6 Comparisons of LPC 14:0~LPC 18:0 among patients with HVB-HCC at different CTP classes |
代谢组学是系统生物学的重要组成部分, 目前已发展为一门内可整合色谱、质谱、磁共振等多项技术, 外可整合基因组学、转录组学和蛋白质组学等的重要学科[9]。磁共振技术(nuclear magnetic resonance, NMR)、气相色谱-质谱联用(gas chromatography-mass spectrometry, GC-MS)、毛细管电泳-质谱联用(capillary electrophoresis coupled to mass spectrometry, CE-MS)及以HPLC-MS/MS可谓是目前代谢组学分析技术的四大支柱[10]。GC-MS长期以来用于生物体液中代谢物的鉴定, 但应用范围常受到待测物挥发性和生成挥发性衍生物的限制[11]; CE-MS技术适用于生物样本中极性带电荷的代谢物质分[12]; NMR虽具有重复性好及实验室间的差异较小等优点, 但其灵敏度较低[13]; HPLC-MS/MS适用的待检代谢物范围较广, 同时具有较高的特异性和敏感性, 是目前定量检测微量非挥发性分析物的金标准[14]。本研究中检测的LPC 14:0~LPC 18:0系列物质对热不稳定, 且不易挥发, 适用于HPLC-MS/MS技术定量分析检测, 利于LPC类物质定量准确检测。
鉴于人血清样本的复杂成分, 本研究对样本进行了前期分离和预处理, 以防样本中高丰度的蛋白质在质谱仪的电离作用下裂解生成与待测物裂解物相似的产物, 或与待测物之间发生反应而影响最终定量检测的结果。研究中使用加入了0.1% BHT的甲醇溶液对样本前处理, BHT可以防止对LPC类物质中不饱和键脂肪链的氧化, 而甲醇对水的亲和力大, 能破坏人血清蛋白颗粒表面的水化膜, 致使蛋白质沉淀而除去待测样本中的蛋白质。前处理后的待测样本注入到高效液相色谱柱中, 流动相中0.1%甲酸25 m mol·L-1甲酸铵-水溶液和0.1%甲酸-甲醇溶液的配比随时间而改变, 待测样本中各种物质在不同配比流动相中的溶解度不同而先后被洗脱下来, 这就完成色谱过程对样本的初步分离作用, 而不破坏待测样本的化学结构。
经色谱柱初步分离后的样本随流动相进入质谱的离子源, 样本在离子源内电离成为带电离子。研究中使用的API 4000+质谱仪、Turbo VTM离子源对LPC类物质的电离模式选择电喷雾(electrospray ionization, ESI)电离, 离子化效率高, 灵敏度高, 电离更加稳定和高效[15]。待测的5个LPC类物质经电离后成为带电离子在接口内进行去溶剂、聚集、冷却后进入质量分析器。本研究采用三重四极杆(triple quadrupole mass spectrometry, TQMS)质量分析器的多反应检测模式(multi-reaction monitoring, MRM)进行扫描检测, 3个四极杆在空间上串联, 限定母离子和子离子2个参数, 选择性极高, 提高了灵敏度, 最终将离子信号转变为电信号, 经API 4000+质谱仪的分析软件Analyst®软件分析成离子强度图, 完成定量分析子离子碎片的强度和质谱图的绘制。
具体每一种LPC类物质在循环中的具体量并不十分明确, 而且各LPC亚型众多, 各亚型之间还可以相互转换, 这给具体LPC类物质的绝对定量带来了巨大的困难。有研究报道, 正常人血浆中LPC类物质占磷脂类物质的含量低于3.2%, 而生理状态下人血浆磷脂类物质的总浓度约在1-3 mg·mL-1范围内[16-17]。也有研究表明, 生理状态下人血浆中LPC类物质的浓度范围约在12~166 μmol·L-1[18]。本研究通过前处理以及色谱参数和质谱条件的选择优化, 最终建立了HPLC-MS/MS检测平台, 并对该技术平台的性能进行验证。首先是标准曲线的绘制和线性相关性的验证:本研究以生理盐水为基质, 配制不同浓度梯度的LPC 14:0~LPC 18:0标准品溶液, 通过质谱仪自带软件分析待测物浓度和峰下面积的关系, 并绘制标准曲线和线性相关系数r, 结果显示5个目标LPC类物质实测浓度和配制浓度之间的r值分别为0.997 6、0.999 2、0.992 7、0.998 0和0.994 3, 均在0.99以上; 此外, 对LPC 14:0~LPC 18:0每一种LPC类物质配制的S1~S7共计7个浓度水平均在直线范围内, 说明本研究建立的HPLC-MS/MS平台可以满足人血清中5个目标LPC类物质的定量检测在浓度范围方面的需求。检测下限(LOD)结果表明, LPC 14:0~LPC 18:0的LOD分别为0.027、0.12、0.32、0.059和0.072 μg·mL-1。高(S5)、低(S3)2个浓度水平加样回收率试验结果显示, 5个LPC类待测物质在以生理盐水为基质的高、低2个浓度水平均具有满意的回收率, 在85%~115%范围内。低浓度的8个样本的平行试验显示, LPC 14:0~LPC 18:0 5个物质的平均回收率分别是96.3%、99.9%、103.6%、96.6%和100.0%, 均处于95%~105%范围内; 而高浓度5个物质的平均加样回收率分别是96.8%、99.1%、97.5%、93.8%和97.7%, 在95%~105%范围内, 证明该平台能够以高准确度定量分析以生理盐水为基质的溶液中的目标待测物。以血清为基质再次进行加样回收率试验显示, 加样回收率也可控制在85%~115%范围内, 说明该平台性能稳定, 受人血清影响较小, 适用于对人血清中目标待测物的定量检测分析。精密度结果表明, HPLC-MS/MS符合临床检验工作中对仪器精密度的要求, 低浓度和高浓度水平上5个LPC类目标物质RSD均小于15%。
本研究通过代谢组学技术建立了一定程度上满足临床检测人血清中LPC 14:0~LPC 18:0 5个LPC类物质的HPLC-MS/MS平台, 适合临床推广。
4 结论本研究利用HPLC-MS/MS平台, 以利血平作为内标物, 绘制目标待测物LPC 14:0~LPC 18:0的标准曲线并分析其r值, 评估检测平台的定量下限、线性范围, 评价其准确性和精密度。通过加样回收试验排除基质效应的影响, 最终成功建立了一个稳定、灵敏而可靠的定量检测人血清中LPC 14:0~LPC 18:0 5个目标LPC类物质的检测平台, 适合临床推广。
| [1] |
FITIAN AI, CABRERA R. Disease monitoring of hepatocellular carcinoma through metabolomics[J]. World J Hepatol, 2017, 9(1): 1. DOI:10.4254/wjh.v9.i1.1 |
| [2] |
LIU Y, HONG Z, TAN G, et al. NMR and LC/MS-based global metabolomics to identify serum biomarkers differentiating hepatocellular carcinoma from liver cirrhosis[J]. Int J Cancer, 2014, 135(3): 658. |
| [3] |
RESSOM HW, XIAO JF, TULI L, et al. Utilization of metabolomics to identify serum biomarkers for hepatocellular carcinoma in patients with liver cirrhosis[J]. Anal Chim Acta, 2012, 743(18): 90. |
| [4] |
ZENG J, HUANG X, ZHOU L, et al. Metabolomics identifies biomarker pattern for early diagnosis of hepatocellular carcinoma:from diethylnitrosamine treated rats to patients[J]. Sci Rep, 2015, 10(5): 16101. |
| [5] |
MATSUMOTO T, KOBAYASHI T, KAMATA K. Role of lysophosphatidylcholine(LPC) in atherosclerosis[J]. Curr Med Chem, 2007, 14(30): 3209. DOI:10.2174/092986707782793899 |
| [6] |
KRAUTBAUER S, EISINGER K, WIEST R, et al. Systemic saturated lysophosphatidylcholine is associated with hepatic function in patients with liver cirrhosis[J]. Prostaglandins Other Lipid Mediat, 2016, 6(124): 27. |
| [7] |
SONOMURA K, KUDOH S, SATO TA, et al. Plasma lipid analysis by hydrophilic interaction liquid chromatography coupled with electrospray ionization tandem mass spectrometry[J]. J Sep Sci, 2015, 38(12): 2033. DOI:10.1002/jssc.v38.12 |
| [8] |
张虹. 加标回收率的测定和结果判断[J]. 石油与天然气化工, 2000, 29(1): 50. ZHANG H. Study on the determination and recovery of spike recovery[J]. Petrol Nat Gas Chem Ind, 2000, 29(1): 50. |
| [9] |
朱超, 梁琼麟, 王义明, 等. 代谢组学的整合化发展及其新进展[J]. 分析化学, 2010, 38(7): 1060. ZHU C, LIANG QL, WANG YM, et al. Integrative development of metabolomics and its new progress[J]. Chin J Anal Chem, 2010, 38(7): 1060. |
| [10] |
PENG B, LI H, PENG XX. Functional metabolomics:from biomarker discovery to metabolome reprogramming[J]. Protein Cell, 2015, 6(9): 628. DOI:10.1007/s13238-015-0185-x |
| [11] |
GAO P, XU G. Mass-spectrometry-based microbial metabolomics:recent developments and applications[J]. Anal Bioanal Chem, 2015, 407(3): 669. |
| [12] |
RAMAUTAR R, SOMSEN GW, de JONG GJ. CE-MS for metabolomics:developments and applications in the period 2012-2014[J]. Electrophoresis, 2015, 36(1): 212. DOI:10.1002/elps.v36.1 |
| [13] |
WOLFENDER JL, MARTI G, THOMAS A, et al. Current approaches and challenges for the metabolite profiling of complex natural extracts[J]. J Chromatogr A, 2015, 1382(1): 136. |
| [14] |
GODFREY AR, JONES L, DAVIES M, et al. Miltefosine:a novel internal standard approach to lysophospholipid quantitation using LC-MS/MS[J]. Anal Bioanal Chem, 2017, 409(11): 2791. DOI:10.1007/s00216-017-0223-z |
| [15] |
王中华, 陈艳华, 徐婧, 等. 血清脂质组学研究中多重离子化液相色谱-质谱方法的比较[J]. 分析化学, 2017, 45(5): 674. WANG ZH, CHEN YH, XU J, et al. Comparison of multiple ionization liquid chromatography-mass spectrometry in serum lipid group study[J]. Chin J Anal Chem, 2017, 45(5): 674. |
| [16] |
XIA YQ, JEMAL M. Phospholipids in liquid chromatography/mass spectrometry bioanalysis:comparison of three tandem mass spectrometric techniques for monitoring plasma phospholipids, the effect of mobile phase composition on phospholipids elution and the association of phospholipids with matrix effects[J]. Rapid Commun Mass Spectrom, 2009, 23(14): 2125. DOI:10.1002/rcm.v23:14 |
| [17] |
QUEHENBERGER O, ARMANDO AM, BROWN AH, et al. Lipidomics reveals a remarkable diversity of lipids in human plasma[J]. J Lipid Res, 2010, 51(11): 3299. DOI:10.1194/jlr.M009449 |
| [18] |
亢爱春, 霍勇, 齐丽彤. 溶血磷脂酰胆碱在动脉粥样硬化中的作用[J]. 中国动脉硬化杂志, 2006, 12(14): 1083. KANG AC, HUO Y, QI LT. The role of lysophosphatidylcholine in atherosclerosis[J]. Chin J Arterioscler, 2006, 12(14): 1083. |
 2019, Vol. 39
2019, Vol. 39 
