六合氨基酸注射液是由L-精氨酸、L-谷氨酸、L-门冬氨酸、L-亮氨酸、L-异亮氨酸和L-缬氨酸6个氨基酸组成的复方制剂,主要用于慢性肝性脑病、慢性迁延肝炎、慢性活动性肝炎、亚急性及慢性重型肝炎引起的氨基酸代谢紊乱的治疗[1-2]。现行《中华人民共和国药典》(2015年版二部)对氨基酸的含量测定仅采用氨基酸分析仪或高效液相色谱仪进行分离测定[3],但这2种分析方法都需要对氨基酸进行衍生化后方可检测[4-8]。对氨基酸进行衍生化处理,操作烦琐,耗费时间长,费用较高,且致使灵敏度降低,检测下限较高,不利于快速、准确地检测,给样本的测定带来极大不便。本试验结合离子对试剂七氟丁酸[9-12]建立了UHPLC-MS/MS法,对六合氨基酸注射液中的6个氨基酸进行同时测定。该分析方法更简单、快速、准确、灵敏,可为六合氨基酸注射液的质量控制和评价提供科学依据。
1 仪器与试药 1.1 仪器Agilent 1290超高效液相色谱仪-6460 Triple-quad LC/MS质谱仪;Agilent MassHunter软件控制系统及数据处理软件(Agilent公司);Labnet定时可调速旋涡混合器(Labnet公司);Eppendorf 5418R型台式高速离心机(Eppendorf公司);Sartorius CPA 225D十万分之一电子天平(赛多利斯)。
1.2 药品与试剂六合氨基酸注射液(西安天一秦昆制药有限责任公司,批号1604171、1612123、1611063、1612122、1611023、1607083、1607091、1607022、1607023、1607063),L-精氨酸(L-arginine)、L-谷氨酸(L-glutamic acid)、L-门冬氨酸(L-aspartic acid)、L-亮氨酸(L-leuucine)、L-异亮氨酸(L-isoleucine)和L-缬氨酸(L-valine)等氨基酸对照品(中国食品药品检定研究院,批号140624-200805),七氟丁酸(HFBA)(Adamas Reagent Co.,Ltd),甲醇(Merck公司,质谱纯),甲酸(天地公司,色谱纯),超纯水(Millipore公司)。
2 方法与结果 2.1 LC条件采用Agilent ZORBAX SB-C18色谱柱(3.0 mm×150 mm,5 μm),流动相A为0.2%甲酸和0.02%七氟丁酸[9-12]的甲醇溶液,流动相B为0.2%甲酸和0.02%七氟丁酸的水溶液,梯度洗脱(0~2.5 min,10%A→15%A;2.5~4.5 min,15%A→23%A;4.5~8 min,23%A→72%A),流速为0.4 mL·min-1,柱温为50 ℃,进样量为2 μL。
2.2 MS条件采用电喷雾ESI离子源,选择正离子扫描方式,动态多反应监测(MRM)模式测定;雾化气和干燥气均为N2,雾化气压力为345 kPa;干燥气温度为325 ℃;碰撞气为高纯氮气,压力0.1 MPa;流速为10 L·min-1;毛细管电压为5 kV;柱温箱温度为50 ℃。各目标化合物的质谱检测参数见表 1。
|
|
表 1 6个化合物的质谱检测参数 Tab.1 MRM parameters for six compounds |
精密称取上述6个氨基酸的对照品各4.0 mg,分别置2 mL量瓶中,缬氨酸、亮氨酸、异亮氨酸、门冬氨酸和精氨酸用10%甲醇水溶液溶解并稀释至刻度,谷氨酸用0.5mL的0.2%甲酸水溶液溶解并用10%甲醇水溶液稀释至刻度,涡旋混匀,即配制成质量浓度均为2 mg·mL-1的对照品储备液,置4 ℃冷藏备用。吸取上述对照品储备液各适量,分别用10%甲醇水溶液稀释配制得到缬氨酸、亮氨酸和异亮氨酸质量浓度为480.00 μg·mL-1和80.00 μg·mL-1的混合对照品溶液;精氨酸质量浓度为320.00 μg·mL-1和40.00 μg·mL-1,谷氨酸质量浓度为400.00 μg·mL-1和80.00 μg·mL-1,门冬氨酸质量浓度为80.00 μg·mL-1和8.00 μg·mL-1的对照品溶液,备用。
2.3.2 供试品溶液精密量取不同批次六合氨基酸注射液1.00 mL,分别置250 mL量瓶中,加10%甲醇溶液稀释至刻度,摇匀,再分别精密移取1.00 mL,置25 mL量瓶中,用10%甲醇溶液定容,摇匀,进样前用0.22 μm微孔滤膜过滤,取续滤液,即得。
2.3.3 阴性样品溶液取灭菌注射用水,按照“2.3.2”项下方法操作,制备阴性样品溶液。
2.4 方法学考察 2.4.1 系统适用性分别取阴性样品溶液、含6个对照品的混合对照品溶液(即缬氨酸、亮氨酸、异亮氨酸、精氨酸、谷氨酸和门冬氨酸的浓度分别为2.00、2.00、2.00、1.00、2.00和0.20 μg·mL-1)和供试品溶液,按照“2.1”和“2.2”项的条件进行UHPLC-MS/MS分析,结果见图 1。6个化合物均能完全分离,供试品溶液的杂质和基质对精氨酸、谷氨酸、门冬氨酸、亮氨酸、异亮氨酸和缬氨酸的色谱峰不构成干扰,该方法专属性良好。
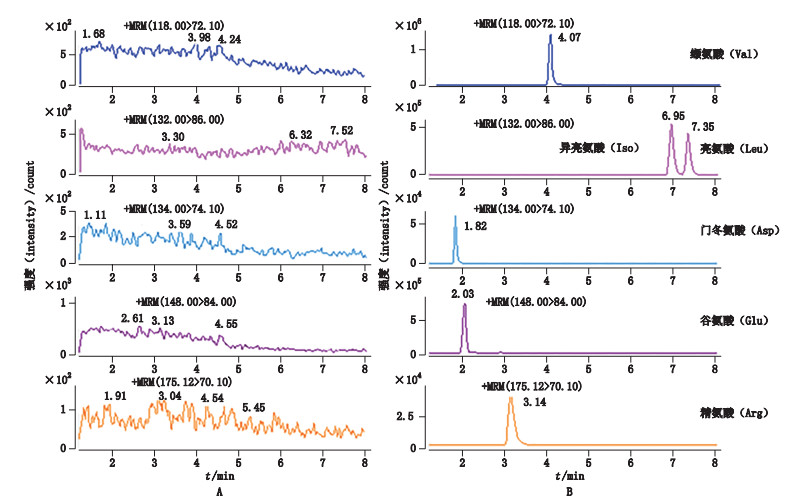
|
图 1 阴性样品(A)和6个氨基酸对照品(B)的UHPLC-MS/MS色谱图 Fig.1 UHPLC-MS/MS chromatograms of quantitative ion pairs of negative samples(A)and reference compounds of six amino acids(B) |
分别精密吸取“2.3.1”项下对应的混合和单一对照品溶液适量(即分别精密吸取480.00 μg·mL-1的缬氨酸、亮氨酸和异亮氨酸,320.00 μg·mL-1的精氨酸、400.00 μg·mL-1的谷氨酸和80.00 μg·mL-1的门冬氨酸各200、150、100 μL和80.00 μg·mL-1的缬氨酸、亮氨酸和异亮氨酸,40.00 μg·mL-1的精氨酸、80.00 μg·mL-1的谷氨酸和8.00 μg·mL-1的门冬氨酸各200、100、50、20 μL),分置7个2 mL量瓶中,加10%甲醇溶液稀释至刻度,摇匀;再分别吸取适量混合对照品溶液与10%甲醇溶液,按1:3比例混合,摇匀,制得7个不同浓度梯度系列(缬氨酸,亮氨酸和异亮氨酸分别为12.00、9.00、6.00、2.00、1.00、0.50、0.20 μg·mL-1,精氨酸为8.00、6.00、4.00、1.00、0.50、0.25、0.10 μg·mL-1,谷氨酸为10.00、7.50、5.00、2.00、1.00、0.50、0.20 μg·mL-1,门冬氨酸为2.00、1.50、1.00、0.20、0.10、0.05、0.02 μg·mL-1)的混合对照品溶液。按照“2.1”和“2.2”项下条件进样测定,以峰面积(Y)为纵坐标,对照品质量浓度(X,μg·mL-1)为横坐标,绘制标准曲线,求得回归方程(见表 2)。结果在规定的浓度范围内,各化合物呈良好的线性关系。分别以信噪比(S/N)为10:1和3:1时,确定其定量下限和检测下限,结果见表 2。
|
|
表 2 6个氨基酸的回归方程、相关系数和线性范围、定量下限和检测下限 Tab.2 Regression equations, correlation coefficients, linear ranges, LOQs and LODs of the six compounds |
精密吸取混合对照品溶液,按“2.1”和“2.2”项下条件连续进样6次,记录各成分的峰面积。结果精氨酸、谷氨酸、门冬氨酸、亮氨酸、异亮氨酸和缬氨酸峰面积的RSD分别为2.2%、3.6%、1.9%、2.0%、1.8%和1.5%,表明仪器精密度良好。
2.4.4 稳定性试验取六合氨基酸注射液(批号1612122)的供试品溶液,室温放置,分别在0、2、4、8、12、24和48 h时间点进样测定,并记录峰面积。结果精氨酸、谷氨酸、门冬氨酸、亮氨酸、异亮氨酸和缬氨酸峰面积的RSD分别为1.0%、0.76%、1.1%、0.49%、0.81%和0.57%,表明供试品溶液在48 h内稳定。
2.4.5 重复性试验按照“2.3.2”项下方法,制备六合氨基酸注射液(批号1612122)的供试品溶液,共6份,进样测定,计算各组分含量。结果精氨酸、谷氨酸、门冬氨酸、亮氨酸、异亮氨酸和缬氨酸的含量平均值分别为3.54、2.90、0.62、2.65、1.74和1.93 μg·mL-1,RSD分别为0.82%、1.7%、0.92%、3.0%、2.0%和1.2%,均符合规定,表明该方法的重复性良好。
2.4.6 加样回收率试验精密吸取同一批次(批号1612122)的六合氨基酸注射液0.5 mL,分别加入混合对照品溶液(精氨酸、谷氨酸、门冬氨酸、亮氨酸、异亮氨酸和缬氨酸的质量浓度分别为22.60、18.14、4.12、16.24、11.76和12.14 mg·mL-1)0.5 mL,按“2.3.2”项下方法制备供试溶液,进样测定,并记录峰面积,计算回收率,结果见表 3。
|
|
表 3 6个氨基酸的平均加样回收率(n=6) Tab.3 Average recoveries of the six amino acids |
取10批六合氨基酸注射液各3份,按照“2.3.2”项下方法制备供试品溶液,按照“2.1”和“2.2”项下条件进样检测,记录6个被测氨基酸的色谱峰面积,代入相应的回归方程并计算含量,结果见表 4。
|
|
表 4 六合氨基酸注射液样品测定结果(mg·mL-1,n=3,RSD < 2.8%) Tab.4 The determination results of compound amino acid injection |
在试验过程中,分别对6个氨基酸进行正、负离子扫描模式(MS SCan)考察,结果精氨酸、门冬氨酸、亮氨酸、异亮氨酸和缬氨酸在正离子模式下有较好的响应,而谷氨酸在正、负离子扫描模式下都具有较强的响应;再对谷氨酸[M+H]+、[M-H]-的二级碎片离子丰度进行比较,其中[M+H]+产生的子离子丰度比较稳定,且响应值也较高,故选择[M+H]+作为母离子进行检测。分别给予母离子不同碎裂电压和碰撞能量,进行子离子全扫描,确定灵敏度最高、稳定性和重复性最好的定量离子和最佳F值,CE值如表 1。
3.2 色谱柱的选择分别考察了Waters ACQUITY UHPLC HSS T3(2.1 mm×100 mm,1.8 μm)、Agilent Eclipse Plus C18(2.1 mm × 50 mm,3.5 μm)、Waters XBridgeTM Amide(2.1 mm ×100 mm,3.5 μm)和Agilent ZORBAX SB-C18(3.0 mm×150 mm,5 μm)色谱柱,结果所有氨基酸在HSS T3色谱柱上保留性较弱,同分异构体亮氨酸和异亮氨酸在Eclipse Plus C18,XBridgeTM Amide色谱柱上分离度小于1.5,而在ZORBAX SB-C18色谱柱上,既对6个氨基酸有更高的柱效和保留性,又能够完全分离亮氨酸和异亮氨酸且峰形对称,因此本试验采用Agilent ZORBAX SB-C18(3.0 mm×150 mm,5 μm)色谱柱进行分离。
3.3 流动相的选择在试验考察过程中,流动相的有机相比较了乙腈和甲醇,结果在相同条件下,乙腈的洗脱能力比较强,同分异构体亮氨酸和异亮氨酸不能够完全分离,而且峰形前延;水相比较了含0.05%甲酸和0.005%七氟丁酸的溶液、含0.1%甲酸和0.01%七氟丁酸的溶液、含0.2%甲酸和0.02%七氟丁酸的溶液、含0.3%甲酸和0.03%七氟丁酸的溶液、含0.5 %甲酸和0.05%七氟丁酸的溶液、含0.1%乙酸和0.01%七氟丁酸的溶液、含0.2 %乙酸和0.02%七氟丁酸的溶液,结果采用前2种水相时,分离效果较差,采用后4种水相时,酸性太强,易损坏色谱柱或离子对试剂过多,出现峰面积变小,且容易堵塞色谱柱及喷雾针。有机相选择含0.2%甲酸和0.02%七氟丁酸的甲醇溶液,水相选择含0.2%甲酸和0.02%七氟丁酸的水溶液,能使所有色谱峰完全分离,峰形对称(避免前延和拖尾),离子响应最强且稳定,因此是试验中最适合的流动相。
4 小结本试验建立的UHPLC-MS/MS含量检测方法,与现行《中华人民共和国药典》(2015年版二部)记载对氨基酸的含量测定仅采用氨基酸分析仪或高效液相色谱仪进行分离测定相比较,操作更简单、快速、准确、灵敏,重复性好且成本低,为六合氨基酸注射液的质量控制提供进一步的技术支持,是对现行《中华人民共和国药典》氨基酸测定方法的有效修改和补充。
| [1] |
尹国云, 郭小平. 门冬氨酸鸟氨酸联合复方氨基酸治疗肝性脑病临床观察[J]. 内蒙古医学杂志, 2011, 43(12): 1485. YIN GY, GUO XP. Clinical observation of ornithine aspartate combined with compound amino acid injection treating hepatic encephalopathy[J]. Inner Mongolia Med J, 2011, 43(12): 1485. DOI:10.3969/j.issn.1004-0951.2011.12.035 |
| [2] |
王振英. 六合氨基酸治疗肝性脑病[J]. 新药与临床, 1992, 11(5): 316. WANG ZY. Clinical study of compound amino acid injection(6AA) in the treatment of hepatic encephalopathy[J]. New Drugs Clin Rem, 1992, 11(5): 316. |
| [3] |
中华人民共和国药典2015版.二部[S]. 2015: 811 ChP 2015. Vol Ⅱ[S]. 2015: 811 |
| [4] |
KWANYUEN P, BURTON JW. A modified amino acid analysis using PITC derivatization for soybeans with accurate determination of cysteine and half-cystine[J]. J Am Oil Chem Soc, 2010, 87: 127. DOI:10.1007/s11746-009-1484-2 |
| [5] |
ZENG XY, WANG MF, ZHU BK, et al. Simultaneous analysis of AY and amino acids in corn oligopeptides by HPLC-fluorescence detector with OPA/FMOC-Cl pre-column derivatization[J]. J Food Agric Environ, 2013, 11(1): 86. |
| [6] |
ZENG F, OU J, HUANG YF, et al. Determination of 21 free amino acids in fruit juices by HPLC using a modification of the 6-aminoquinolyl-N-hydroxysuccinimidyl carbamate(AQC) method[J]. Food Anal Methods, 2015, 8(2): 428. DOI:10.1007/s12161-014-9905-8 |
| [7] |
SHARMA G, ATTRI SV, BEHRA B, et al. Analysis of 26 amino acids in human plasma by HPLC using AQC as derivatizing agent and its application in metabolic laboratory[J]. Amino Acids, 2014, 46(5): 1253. DOI:10.1007/s00726-014-1682-6 |
| [8] |
HUO TG, ZHANG YH, LI WK, et al. Effect of realgar on extracellular amino acid neurotransmitters in hippocampal CA1 region determined by online microdialysis-dansyl chloride derivatization-high-performance liquid chromatography and fluorescence detection[J]. Biomed Chromatogr, 2014, 28(9): 1254. DOI:10.1002/bmc.v28.9 |
| [9] |
SOWELL J, POLLARD L, WOOD T. Quantification of branched-chain amino acids in blood spots and plasma by liquid chromatography tandem mass spectrometry for the diagnosis of maple syrup urine disease[J]. J Sep Sci, 2011, 34(6): 631. DOI:10.1002/jssc.v34.6 |
| [10] |
ALODAIB A, CARPENTER K, WILEY V, et al. An improved ultra performance liquid chromatography-tandem mass spectrometry method for the determination of alloisoleucine and branched chain amino acids in dried blood samples[J]. Ann Clin Biochem, 2011, 48(5): 468. DOI:10.1258/acb.2011.010283 |
| [11] |
ECKSTEIN JA, AMMERMAN GM, REVELES JM, et al. Analysis of glutamine, glutamate, pyroglutamate, and GABA in cerebrospinal fluid using ion pairing HPLC with positive electrospray LC/MS/MS[J]. J Neurosci Methods, 2008, 171(2): 190. DOI:10.1016/j.jneumeth.2008.02.019 |
| [12] |
WANG Q, WEN Y, XIA T, et al. Quantification of 18 amino acids in human plasma:application in renal transplant patient plasma by targeted UHPLC-MS/MS[J]. Bioanalysis, 2016, 8(13): 1337. DOI:10.4155/bio-2016-0057 |
 2019, Vol. 39
2019, Vol. 39 