2. 江苏康缘药业股份有限公司, 连云港 222001;
3. 中药制药过程新技术国家重点实验室, 连云港 222001
2. Jiangsu Kanion Pharmaceutical Co. Ltd., Lianyungang 222001, China;
3. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China
复方南星止痛膏由生天南星、生川乌、丁香、肉桂、白芷、细辛、川芎、徐长卿、乳香、没药、樟脑、冰片12味药组成,是传承祖国多部医学经典而成的止痛组方[1],具有散寒除湿、活血止痛之功效,临床主要用于治疗寒湿瘀阻所引起的骨性关节炎及类风湿性关节炎,包括关节疼痛、肌肉肿胀等,疗效确切,应用广泛[2-4]。生川乌作为组方中的君药,具有祛风除湿、温经止痛之功效,其中双酯型乌头生物碱作为其特征活性成分,具有镇痛作用的同时还有较强的毒性[5-6]。2015年版《中华人民共和国药典》和相关文献研究均采用HPLC法对生川乌药材中的新乌头碱、乌头碱和次乌头碱3个双酯型乌头生物碱进行质量控制,因此,建立同时测定制剂中3个双酯型乌头生物碱的检测方法非常必要。但是,由于复方南星止痛膏成分极其复杂,且含有凡士林、液体石蜡等辅料,样品的前处理方法较为烦琐,建立同时测定制剂中3个双酯型乌头生物碱的方法难度较大。
近年来,随着商品化二维液相色谱仪器技术的逐渐成熟,中心切割、多中心切割和全二维液相色谱等结合多种分离模式的二维液相色谱法在中药分析中的应用已越来越多[8-12]。二维色谱分为在线和离线2种方式,其中在线二维液相色谱可以选择性地将一维馏分转移至第二维色谱柱中进行分析,能很好地解决常规色谱分离能力有限的问题,在复杂基质的多组分分析中具有尤其重要的应用前景[8, 10, 12-14]。本实验采用在线中心切割超高效二维液相色谱法,在一维色谱分析后通过定量环收集及阀切换的方式,将目标物切割进入二维色谱分析,实现同时对复方南星止痛膏中3个双酯型乌头生物碱进行定量分析[13-14],可有效提高产品的质量控制水平,也为该制剂在临床上应用的安全性和有效性提供保障。
1 仪器和材料 1.1 实验仪器Agilent 1290 Infinity Ⅱ二维液相色谱系统,包括:1290 Infinity Ⅱ高速泵,1290 Infinity Ⅱ自动进样器,1290 Infinity Ⅱ柱温箱,1290 Infinity Ⅱ二极管阵列检测器,1290 Infinity Ⅱ二元泵(用于第二维分析),1290 Infinity Ⅱ二极管阵列检测器(用于第二维检测),外置阀驱动;BUCHI R-3型旋转蒸发仪;KH-300DB型数控超声波清洗器;ME303E型电子天平;XS205DU型电子分析天平。
1.2 试剂与试药对照品次乌头碱(批号110798-201609)、乌头碱(批号110720-201111)和新乌头碱(批号110799-201307),中国食品药品检定研究院;复方南星止痛膏,江苏康缘阳光药业有限公司,批号160510、160609、160708、160713、160720、161126、170218、170621、170626、170707。乙腈,Tedia,批号16045019;甲醇,Tedia,批号17095089;无水甲醇,国药集团化学试剂有限公司,批号20151214;三氯甲烷,南京化学试剂股份有限公司,批号170424921D;无水碳酸钠,国药集团化学试剂有限公司,批号20130513);二乙胺,国药集团化学试剂有限公司,批号20161214;磷酸,南京化学试剂有限公司,批号13072211046),所有试剂均为分析纯;水为超纯水。
2 实验方法 2.1 对照品储备液的制备分别称取新乌头碱、乌头碱、次乌头碱的对照品适量,精密称定,置于10 mL量瓶中,用色谱甲醇溶解并定容至刻度,得质量浓度分别为0.990、0.820和1.370 mg·mL-1的对照品储备液。
2.2 供试品溶液的制备取本品10片,除去衬布,刮取药膏,取相当于2片量约8 g,精密称定,置研钵中,加甲醇适量,研匀,定量转移至100 mL量瓶中,超声(300 W,50 Hz)处理1 h,放冷,加甲醇稀释至刻度,摇匀,滤过,弃去初滤液,精密量取续滤液50 mL,减压回收至干,精密加入2%盐酸溶液100 mL,微热使残渣溶解,摇匀,放冷,置冰箱中冷藏1 h,滤过,精密量取续滤液50 mL,置分液漏斗中,用三氯甲烷分次提取(40、40、40、30 mL),合并三氯甲烷提取液,用无水碳酸钠脱水,滤液减压回收至干,残渣用甲醇溶解并定容至2 mL,摇匀,14 000 r·min-1离心10 min,即得。
2.3 色谱条件一维色谱:Waters XBridge BEH C18(2.1 mm×50 mm 1.7 μm)色谱柱;流动相A为甲醇,B为0.008%二乙胺,梯度洗脱(0~12 min,40%A→58%A;12~25 min,58%A→58%A;25~35 min,58%A→65%A;35~40 min,65%A→70%A;40~42 min,70%A→70%A;42~45 min,70%A→100%A,45~48 min,100%A→40%A);流速0.1 mL·min-1;柱温18 ℃;检测波长235 nm;进样量1 μL;样品盘温度10 ℃。
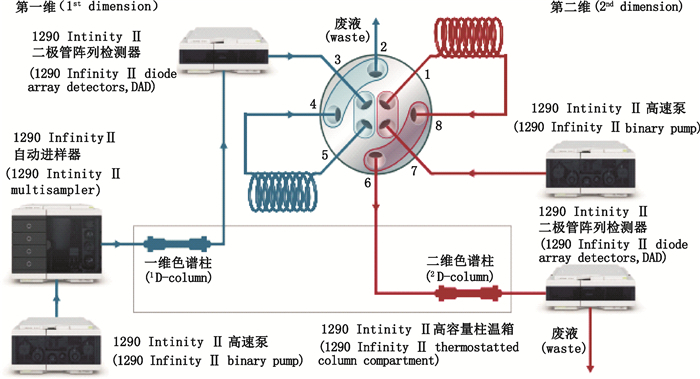
阀切换方法:阀切换开始时间为3个双酯型乌头生物碱起始出峰时间,每个峰切割0.8 min,定量环体积为80 μL。切割时间:片段1,23.65~24.45 min;片段2,34.60~35.40 min;片段3,40.35~41.15 min。超高效二维液相色谱系统的配置连接示意图见图 1。
|
图 1 超高效二维液相色谱系统的配置及连接示意图 Fig.1 Schematic diagram of configuration and connection of two-dimensional ultra performance liquid chromatography |
二维色谱:Waters XBridge BEH C18(3.0 mm×100 mm 1.7 μm)色谱柱;流动相A为乙腈,B为0.01%磷酸,梯度洗脱(0~1 min,30%A→38%A;1~3 min,38%A→48%A;3~4 min,48%A→90%A;4~4.2 min,90%A→30%A),流速0.7 mL·min-1;柱温40 ℃;检测波长235 nm。
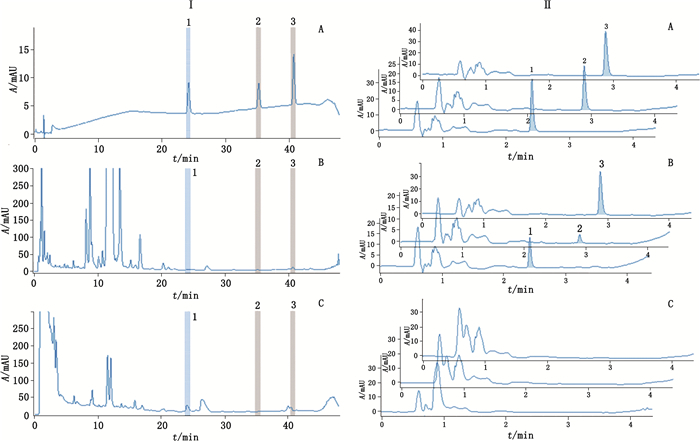
3 结果与讨论 3.1 专属性试验精密称取无川乌的阴性制剂,按照“2.2”项下方法制备阴性供试品溶液。分别取对照品溶液、供试品溶液及阴性供试品溶液,按照“2.3”项下色谱条件进样分析。从图 2可知,3个双酯型乌头生物碱的混合对照品溶液可以得到较好分离,而制剂中目标成分含量较低,且基质化学成分复杂,干扰较为严重。故本实验采用对照品保留时间比对法,将供试品溶液中与对照品保留时间一致的峰片段切入第二维色谱系统,发现在第二维色谱图中可检测到明显的新乌头碱、乌头碱和次乌头碱,而阴性供试品溶液对目标成分的测定无干扰,方法专属性良好。
|
1.新乌头碱(mesaconitine) 2.乌头碱(aconitine) 3.次乌头碱(hypaconitine) Ⅰ.第一维UPLC色谱图(the first dimensional UPLC chromatograms) Ⅱ.第二维UPLC色谱图(the second dimensional UPLC chromatograms) 图 2 混合对照品溶液(A)、供试品溶液(B)和阴性供试品溶液(C)的超高效二维液相色谱图 Fig.2 2D UPLC chromatograms of mixed reference solution (A), analytical sample solution (B), and negative sample solution (C) |
分别取“2.1”项下对照品储备液适量,用色谱甲醇配制成新乌头碱、乌头碱和次乌头碱质量浓度分别为19.80、16.39、27.44 μg·mL-1的混合对照品溶液。采用逐级稀释的方法得系列浓度的混合对照品溶液,按“2.3”项下色谱条件进样分析,记录各色谱峰的峰面积,以质量浓度(X,μg·mL-1)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,计算回归方程。将混合对照品溶液逐步稀释后进样测定,以色谱图中信噪比S/N为10:1确定定量下限。结果见表 1。
|
|
表 1 线性回归方程、相关系数、线性范围及定量下限考察 Tab.1 Linear regression equations, correlation coefficients, linear ranges and LOQs |
取混合对照品溶液,连续进样6针,记录各色谱峰的峰面积并计算其RSD。结果表明,3个成分峰面积的RSD均小于1%,表明仪器的精密度良好。
3.4 稳定性试验取混合对照品溶液、供试品溶液,分别于配制后0、2、4、8、12、18、24 h进样分析,记录各待测成分的峰面积并计算RSD。结果表明,对照品溶液和供试品溶液中待测成分RSD均小于2%,表明对照品溶液和供试品溶液在24 h内稳定。
3.5 重复性试验取同一批号的复方南星止痛膏制剂(批号170218)6份,每份约8 g,精密称定,按“2.2”项下方法制备供试品溶液,平行操作6份,按“2.3”项下色谱条件进行测定,记录各待测成分的峰面积,计算含量及RSD。计算得到新乌头碱、乌头碱和次乌头碱的平均含量分别为3.73、1.17和11.72 μg·g-1,RSD分别为3.3%、3.0%和2.0%,符合2015年版《中华人民共和国药典》关于“样品待测定成分含量为10 μg·g-1时,RSD可接受范围为6%”的规定,表明该方法的重复性良好。
3.6 加样回收率试验取已知含量的样品(批号170218)6份,每份4 g,精密称定,加入与样品中待测成分等量的对照品溶液,按“2.2”项下方法制备供试溶液并测定含量,计算回收率。结果见表 2,表明该方法准确度良好。
|
|
表 2 新乌头碱、乌头碱和次乌头碱的加样回收率结果(n=6) Tab.2 The results of the recovery of mesaconitine, aconitine and hypaconitine |
取10批复方南星止痛膏制剂,按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件对新乌头碱、乌头碱和次乌头碱的含量进行测定。同时取此10批制剂,采用现行标准HPLC法测定次乌头碱的含量。结果见表 3。结果显示,本方法有效地消除了杂质对目标化合物的干扰,提高了样品的检出灵敏度,复方南星止痛膏中新乌头碱、乌头碱和次乌头碱的含量分别在3.2~5.0、0.9~1.3、8.5~10.4 μg·g-1范围内,其中次乌头碱的含量与HPLC法检测结果基本一致,表明复方南星止痛膏中的3个双酯型乌头生物碱含量稳定,批间均一性良好。为了更加科学合理地对复方南星止痛膏进行质量控制,更好地保证临床用药安全,将3个双酯型乌头生物碱的总量作为制剂的质量控制标准。结合生产实际中不同批次间制剂的差异性,3个双酯型乌头生物碱总量拟控制在12~16 μg·g-1范围内。
|
|
表 3 10批样品中新乌头碱、乌头碱和次乌头碱的含量测定结果(μg·g-1,n=3) Tab.3 The contents of mesaconitine, aconitine and hypaconitine in 10 batches of samples |
为了选择合适的检测波长,实验中将混合对照品溶液进行全波长扫描,结果发现新乌头碱、乌头碱及次乌头碱的最大吸收波长均在235 nm左右,因此选择检测波长为235 nm进行实验考察。
4.2 流动相选择第一维流动相选择:为了保证目标化合物能够完全被切割进入第二维进行分析,在第一维色谱系统水相的选择上尝试了不同比例的二乙胺(DEA)、三乙胺(TEA)、磷酸-DEA缓冲盐等体系,最终确定为甲醇-0.008% DEA体系,该体系下目标化合物的峰宽较小,便于进行中心切割操作。
第二维流动相选择:为了保证定量环中收集到的目标化合物能够分析完全且不干扰下一个目标化合物的分析,将有机相改为洗脱能力更强的乙腈,可有效缩短第二维的分析时间。同时,在水相选择上尝试了0.02% DEA和0.01%磷酸。通过比较发现,乙腈-0.01%磷酸流动相体系可以明显改善目标化合物的峰形和分离度,消除其他杂质成分的干扰。综上,以甲醇-0.008% DEA水溶液为第一维流动相系统,以乙腈-0.01%磷酸水溶液为第二维流动相系统。
4.3 HPLC法检测条件实验首先比较了2015年版《中华人民共和国药典》一部“川乌”项下用于生物碱含量测定的色谱条件(条件1),和复方南星止痛膏现行质量标准中用于含量测定的色谱条件(条件2)。条件1以乙腈-四氢呋喃(25:15)为流动相A,0.1 mol·L-1乙酸铵溶液(每1 000 mL加冰乙酸0.5 mL)为流动相B;条件2以乙腈为流动相A,0.015%二乙胺溶液为流动相B。均梯度洗脱。
结果发现,在上述2种检测条件下,样品中新乌头碱和乌头碱在对照品的出峰位置杂质干扰较为严重,只能检测到次乌头碱。后续又进行了不同流动相体系、洗脱比例等条件的优化,均无明显改善。因此,采用HPLC法对制剂中的3个双酯型乌头生物碱进行同时定量难以实现。
4.4 供试品溶液制备方法实验分别考察了3种不同前处理方法,具体如下:方法1将样品用甲醇超声处理1 h后,冷藏2 h,利用物理法去除石蜡等辅料;方法2将样品置索氏提取器中,采用石油醚(60~90 ℃)回流提取4 h,弃去石油醚液,残渣取出挥干后加甲醇超声处理1 h;方法3同“2.3”项下供试品溶液的制备方法。
结果发现,以方法1制得的供试品溶液进样分析时,易发生进样针堵塞,原因为制剂中含有大量的液体石蜡、凡士林等辅料成分,前处理过程中无法去除干净,故该方法不可行;以方法2制得的供试品溶液,测得次乌头碱的平均回收率为56.2%,RSD为16.7%,说明该方法的稳定性和适用性均差;以方法3制得的供试品溶液,测得次乌头碱的平均回收率为86.9%,RSD为3.4%,符合2015年版《中华人民共和国药典》“药品质量标准分析方法验证指导原则”的数据要求,表明该供试品溶液制备方法的稳定性和适用性良好。
5 结论二维液相色谱是对传统液相色谱的优化,可提高系统的峰容量,增强色谱系统的分离能力,适用于复杂组分的快速分离。其在线分析模式的建立,消除了人为操作的误差,加快了样品的分析效率,保证了样品分析结果的准确性和稳定性,可有效解决中药复杂组分中微量成分定量难的问题[15-16]。
本文基于在线中心切割超高效二维液相色谱分离技术,建立了同时测定复方南星止痛膏中新乌头碱、乌头碱和次乌头碱的分析方法。由于制剂本身成分复杂,且含有凡士林、液体石蜡等辅料,对目标成分的干扰较为严重,在一维UPLC检测条件下仅检测到次乌头碱。因此,本实验采用对照品保留时间比对法,将制剂中与对照品保留时间一致的峰片段切入二维色谱,极大地排除了杂质成分的干扰,改善了目标成分的分离效果并提高了检测灵敏度。方法学验证结果表明,该方法能够有效分离待测组分,专属性、重复性、准确度良好,测定结果稳定、可靠,可应用于制剂中3个双酯型乌头生物碱成分的同时定量。
药理研究表明,生川乌具有抗炎、镇痛、强心、扩张外周血管、降压、抗肿瘤等药理作用,其功效主要由双酯型乌头生物碱类成分决定,但这类成分毒性极强[17],口服剂量0.2 mg就可使人中毒,3~4 mg可致人死亡[18],同时,双酯型乌头生物碱类成分性质很不稳定,遇水、加热均易水解成单酯型乌头生物碱[19-20],因此本实验在样品处理过程中用酸水处理,使之以盐的形式存在,这样供试品溶液更加稳定,结果更加准确。该研究可以为含有生川乌的复方制剂中毒效成分的限量检查提供研究思路,也可以为药品复杂组分或复杂基质中微量成分的定性、定量研究提供有益借鉴。同时,本实验的研究结果,也为复方南星止痛膏在临床上安全、合理用药提供数据支持。
| [1] |
刘为民. 开发复方南星止痛膏的科研思路[J]. 南京中医药大学学报, 1999, 15(1): 60. LIU WM. Development thinking of scientific research of compound Nanxing Zhitong plaster[J]. J Nanjing Univ TCM, 1999, 15(1): 60. |
| [2] |
胡晨, 陈荣明, 殷书梅, 等. 复方南星止痛膏的镇痛作用观察及机理探讨[J]. 南京中医药大学学报, 2009, 25(2): 140. HU C, CHEN RM, YIN SM, et al. The approaches on analgesic effect and mechanisms of Nanxing Zhitong plaster[J]. J Nanjing Univ TCM, 2009, 25(2): 140. DOI:10.3969/j.issn.1000-5005.2009.02.018 |
| [3] |
刘为民, 陆茵, 许慧琪. 复方南星止痛膏止痛机理研究[J]. 江苏中医, 1998, 19(10): 46. LIU WM, LU Y, XU HQ. Study on mechanism of pain of compound Nanxing Zhitong plaster[J]. Jiangsu J Tradit Chin Med, 1998, 19(10): 46. |
| [4] |
卞慧敏, 俞晶华, 姜淼, 等. 复方南星止痛膏抗炎作用研究[J]. 中药药理与临床, 2007, 23(5): 46. BIAN HM, YU JH, JIANG M, et al. Studies on anti-inflammatory of compound Nanxing Zhitong plaster[J]. Pharmacol Clin Chin Mater Clin Med, 2007, 23(5): 46. DOI:10.3969/j.issn.1001-859X.2007.05.024 |
| [5] |
中华人民共和国药典2015年版.一部[S]. 2015: 39 ChP 2015. Vol Ⅰ[S]. 2015: 39 |
| [6] |
罗春梅, 易凡力, 黄志芳, 等. HPLC-ELSD法测定附子水溶性生物碱提取物和蒸附片中5种生物碱的含量[J]. 药物分析杂志, 2018, 38(6): 935. LUO CM, YI FL, HUANG ZF, et al. Determination of five representative components in the extract of water-soluble alkaloids from Aconiti Lateralis Radix Praeparata and Zhengfu tablets by HPLC-ELSD method[J]. Chin J Pharm Anal, 2018, 38(6): 935. |
| [7] |
黄志芳, 易进海, 陈东安, 等. 制川乌HPLC特征图谱研究和6种酯型生物碱的含量测定[J]. 药物分析杂志, 2011, 31(2): 217. HUANG ZF, YI JH, CHEN DA, et al. HPLC specific chromatogram of Radix Aconiti Praeparata and determination of six esoteric alkaloids[J]. Chin J Pharm Anal, 2011, 31(2): 217. |
| [8] |
沈保家, 秦昆明, 刘启迪, 等. 二维色谱技术及其在中药领域中的应用[J]. 中国科学:化学, 2013, 43(11): 1480. SHEN BJ, QIN KM, LIU QD, et al. Two-dimensional chromatography technology and its applications in traditional Chinese medicine[J]. Sci Sin Chim, 2013, 43(11): 1480. |
| [9] |
张艳海, 金燕, 王峥涛. 在线二维多中心切割液相色谱法测定三七、人参及其相关产品中8种人参皂苷[J]. 中草药, 2017, 48(5): 894. ZHANG YH, JIN Y, WANG ZT. Simultaneous quantitation of eight ginsenosides in Notoginseng Radix et Rhizoma, Ginseng Radix et Rhizoma, and their related products by online multi heart-cutting two dimensional liquid chromatography[J]. Chin Tradit Herb Drugs, 2017, 48(5): 894. |
| [10] |
张艳海, 张大伟, 孟兆青, 等. 在线二维液相色谱法快速测定桂枝茯苓胶囊中芍药苷、丹皮酚、苦杏仁苷和肉桂酸的含量[J]. 中国中药杂志, 2013, 38(23): 4088. ZHANG YH, ZHANG DW, MENG ZQ, et al. Rapid determination of four components in Guizhi Fuling capsule with online two-dimensional liquid chromatography[J]. China J Chin Mater Med, 2013, 38(23): 4088. |
| [11] |
赵雅清, 付冬梅, 刘艳芳, 等. 离线二维液相色谱法分离巴天酸模根的化学成分[J]. 色谱, 2018, 36(1): 37. ZHAO YQ, FU DM, LIU YF, et al. Separation of chemical compositions in root of Rumex patientia L. with off-line twodimensional liquid chromatography[J]. Chin J Chromatogr, 2018, 36(1): 37. |
| [12] |
国金玲, 连云岚, 张远芳, 等. 中心切割-二维液相色谱分离清热解毒片(胶囊)中的咖啡酰奎宁酸类成分[J]. 中国药品标准, 2017, 18(6): 449. GUO JL, LIAN YL, ZHANG YF, et al. Separation of caffeoylquinic acids in Qingrejiedu tablets(capsules)by central-cutting twodimensional HPLC[J]. Drug Stand China, 2017, 18(6): 449. |
| [13] |
廖强, 罗达龙, 韦日伟, 等. 在线二维液相色谱法同时测定银翘解毒丸中5种成分[J]. 中药材, 2017, 40(12): 2891. LIAO Q, LUO DL, WEI RW, et al. On-line two-dimensional liquid chromatography for the simultaneous determination of 5 kinds of components in Yinqiaojiedu pills[J]. J Chin Med Mater, 2017, 40(12): 2891. |
| [14] |
黄竞怡, 佟玲, 丁黎. 二维液相色谱在中药分析的应用[J]. 药学进展, 2015, 39(5): 357. HUANG JY, TONG L, DING L. Application of two-dimensional liquid chromatography in analysis of traditional Chinese medicines[J]. Prog Pharm Sci, 2015, 39(5): 357. |
| [15] |
杨倩, 王志英, 唐素芳. 二维超高效液相色谱-QTof质谱联用技术在盐酸博来霉素杂质谱研究中的应用[J]. 药物分析杂志, 2016, 36(7): 1231. YANG Q, WANG ZY, TANG SF. Application of two-dimensional UPLC-QTof MS technology in the study of the impurity profile of bleomycin hydrochloride[J]. Chin J Pharm Anal, 2016, 36(7): 1231. |
| [16] |
高辉, 温学森, 马小军, 等. 二维液相色谱技术在药物分析中的应用[J]. 药物分析杂志, 2007, 27(4): 616. GAO H, WEN XS, MA XJ, et al. The technique of two-dimensinoal liquid chromatography (2D-LC) and its applications in drug analysis[J]. Chin J Pharm Anal, 2007, 27(4): 616. |
| [17] |
王瑞, 刘芳, 孙毅坤, 等. 不同附子炮制品中乌头碱、新乌头碱、次乌头碱含量的HPLC测定[J]. 药物分析杂志, 2006, 26(10): 1361. WANG R, LIU F, SUN YK, et al. Quantitative analysis of aconitine, mesaconitine, hypaconitine in different Radix Aconiti Lateralis Praeparata[J]. Chin J Pharm Anal, 2006, 26(10): 1361. |
| [18] |
郭爱华. 川乌、附子的毒性和药理作用[J]. 山西职工医学院学报, 1995, 5(2): 65. GUO AH. Toxicology and pharmacological effects of Aconitum alksloids and Aconiti Lateralis Radix Praeparata[J]. J Shanxi Med Coll, 1995, 5(2): 65. |
| [19] |
王蕾, 张先灵, 王鑫, 等. UPLC-MSn法对生川乌、生附片化学成分的比较研究[J]. 药物分析杂志, 2017, 37(9): 1640. WANG L, ZHANG XL, WANG X, et al. Comparative study on unprocessed Aconiti Radix and unprocessed Aconiti Lateralis Radix by UPLC-MSn[J]. Chin J Pharm Anal, 2017, 37(9): 1640. |
| [20] |
张聿梅, 鲁静, 蒋渝, 等. 川乌和制川乌中单酯及双酯型生物碱成分的含量测定[J]. 药物分析杂志, 2005, 25(7): 807. ZHANG YM, LU J, JIANG Y, et al. HPLC determination of Aconitum alkaloids and their hydrolysis products in Radix Aconiti and its preparate[J]. Chin J Pharm Anal, 2005, 25(7): 807. |
 2019, Vol. 39
2019, Vol. 39 
