肉苁蓉(Cistanche Herba)为列当科植物肉苁蓉Cistanche deserticola Y.C.Ma或管花肉苁蓉Cistanche tubulosa (Schrenk)Wight的干燥带鳞叶的肉质茎[1],其味甘、咸,性温,归肾、大肠经,是传统的补肾阳中药,最早记载于《神农本草经》,列为上品,具有补肾阳,益精血,润肠通便的功效,主治男子阳痿、女子不孕、血枯便秘等症,有“沙漠人参”之美誉。《中华人民共和国药典》(简称《中国药典》)2015年版收载肉苁蓉(又名荒漠肉苁蓉)和管花肉苁蓉为正品药材。肉苁蓉主要含苯乙醇苷、环烯醚萜苷、木脂素及甾醇等类成分[2],其中苯乙醇苷类是肉苁蓉抗衰老、抗疲劳、补肾助阳、抗老年性痴呆等药理作用的主要活性成分[3-4],是评价肉苁蓉质量及鉴别肉苁蓉真伪的重要指标。肉苁蓉主要炮制品有肉苁蓉片和酒苁蓉2种,市场上的肉苁蓉存在品种混乱,真伪混杂,质量不一等问题。本研究采用HPLC法建立酒苁蓉的特征图谱,并同时测定松果菊苷、肉苁蓉苷A、毛蕊花糖苷、异毛蕊花糖苷和2′-乙酰基毛蕊花糖苷5个苯乙醇苷类成分,用于鉴别酒苁蓉真伪优劣,为酒苁蓉的质量控制提供科学依据。
1 仪器、试药及样品 1.1 仪器Waters e2695高效液相色谱仪,数控超声波清洗器(昆山市超声仪器有限公司),万分之一和十万分之一天平(北京赛托利斯仪器系统有限公司)。
1.2 试药对照品松果菊苷(批号PS000867,含量 > 98%)、肉苁蓉苷A(批号PS010950,含量 > 98%)、毛蕊花糖苷(批号PS000683,含量 > 98%)、异毛蕊花糖苷(批号PS001059,含量 > 98%)、2′-乙酰基毛蕊花糖苷(批号PS180312-22,含量 > 98%),均由成都普思生物有限公司提供,甲醇、甲酸均为色谱纯(Fisher公司),娃哈哈纯净水。
1.3 样品共收集20批样品,样品信息见表 1。经外观性状鉴别及《中国药典》含量测定发现,其中5批样品(W1-W5)断面未见荒漠肉苁蓉特征环状维管束或管花肉苁蓉特征散生维管束,含量测定未检测到指标性成分或极低,初步判断为酒苁蓉伪品;另15批市售酒苁蓉饮片(J1-J15)中,样品J12中指标成分含量低于《中国药典》标准,为不合格饮片。
|
|
表 1 酒苁蓉饮片样品信息 Tab.1 Sample informations of wine-processed Cistanche Herba |
取松果菊苷、肉苁蓉苷A、毛蕊花糖苷、异毛蕊花糖苷、2′-乙酰基毛蕊花糖苷的对照品适量,分别置10 mL棕色量瓶中,用50%甲醇水溶解并稀释至刻度,配制成上述5个成分质量浓度分别为1.005、0.202、0.204、0.201、0.202 mg·mL-1的溶液,即得各对照品溶液。
2.2 供试品溶液取干燥的药材粉末(过65目筛)约1 g,精密称定,置100 mL具塞锥形瓶中,加50%甲醇水50 mL,密塞,称量,浸泡30 min,超声处理(功率250 W,频率35 kHz)40 min,放冷,再称量,加50%甲醇水补足减失的量,摇匀,静置,取上清液,经0.45 μm微孔滤膜滤过,即得。
3 特征图谱 3.1 色谱条件采用Agilent Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm),以甲醇(A)- 0.1%甲酸水(B)为流动相,梯度洗脱(0~15 min,15%A→21%A;15~20 min,21%A→25%A;20~70 min,25%A→43%A),流速1.0 mL·min-1,检测波长330 nm,柱温35 ℃,进样量10 μL。
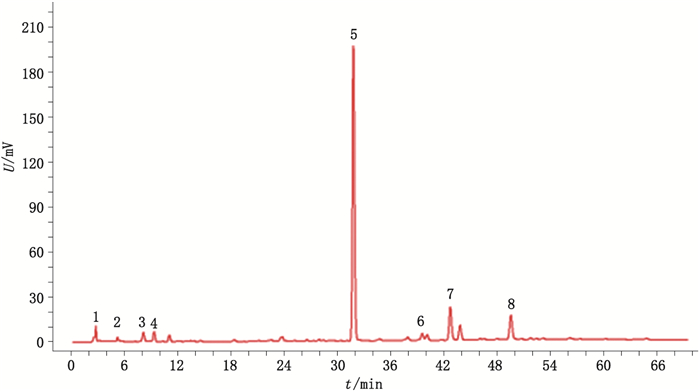
3.2 酒苁蓉特征图谱的建立取不同批次市售酒苁蓉样品粉末,按“2.2”项下方法制备供试品溶液,精密吸取10 μL,分别进样测定,记录色谱图,采用国家药典委员会“中药色谱指纹图谱相似度评价系统软件(2012版)”,以酒苁蓉样品J1的图谱为参照图谱,将其他酒苁蓉样品(J2-J15)色谱峰与参照图谱进行自动匹配,生成酒苁蓉特征图谱(R),见图 1。
|
图 1 酒苁蓉HPLC特征图谱 Fig.1 HPLC specific chromatograms of wine-processed Cistanche Herba |
根据15批酒苁蓉饮片的特征图谱测定结果,酒苁蓉主要有8个特征共有峰。以5号峰为参照峰,分别计算各特征共有峰的相对保留时间,结果[峰号(平均相对保留时间)]分别为峰1(0.084)、峰2(0.161)、峰3(0.254)、峰4(0.292)、峰5(1.000)、峰6(1.248)、峰7(1.348)、峰8(1.564)。
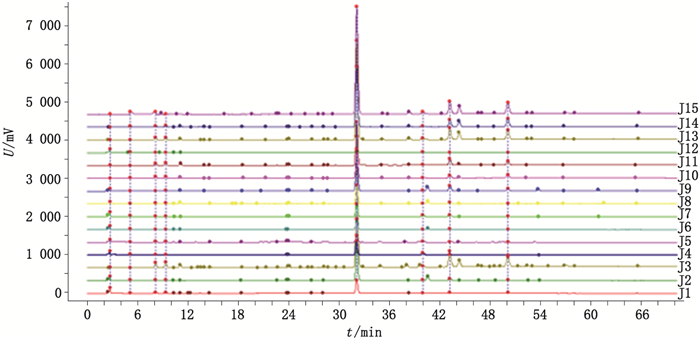
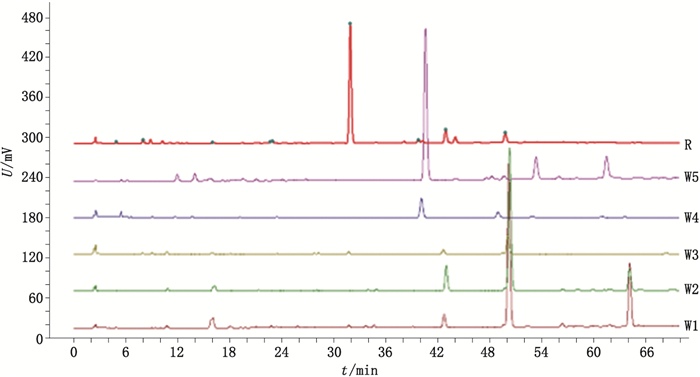
15批酒苁蓉饮片特征图谱见图 2。计算酒苁蓉样品J1-J15与酒苁蓉特征图谱相似度,分别为0.979、0.988、0.999、0.972、0.941、0.979、0.980、0.985、0.992、0.994、0.995、0.871、0.998、0.996、0.998。5批伪品特征图谱见图 3。计算伪品W1-W5与酒苁蓉特征图谱相似度,分别为0.000、0020、0.008、0.006、0.000。
|
图 2 15批酒苁蓉饮片(J1-J15)HPLC色谱图 Fig.2 HPLC chromatograms of 15 batches of wine-processed Cistanche Herba(J1-J15) |
|
图 3 5批伪品色谱图(W1-W5)与酒苁蓉特征图谱(R)比较 Fig.3 Comparison of 5 batches of counterfeits(W1-W5)with wine-processed Cistanche Herba(R) |
精密吸取同一供试品溶液(样品J1)10 μL,按“3.1”项下色谱条件连续进样测定6次,记录色谱图。以松果菊苷峰为参照峰,计算特征峰的相对保留时间及相对峰面积,结果各特征峰相对保留时间的RSD < 0.5%,单峰面积占总峰面积大于2%的特征峰,其相对峰面积的RSD < 2%,采用国家药典委员会“中药色谱指纹图谱相似度评价系统(2012)”进行评价,相似度为0. 99。结果表明仪器精密度良好。
3.4 稳定性试验精密吸取同一供试品溶液(样品J1)10 μL,分别于0、2、4、8、12、24 h进样测定,记录色谱图。以松果菊苷峰为参照峰,计算特征峰的相对保留时间及相对峰面积,结果各特征峰的相对保留时间的RSD < 0.5%,单峰面积占总峰面积大于2%的特征峰,其相对峰面积的RSD < 2%,相似度为0.98。结果表明,供试品溶液于24 h内测定结果稳定。
3.5 重复性试验取制酒苁蓉样品J1粉末6份,精密称定,按“2.2”项下方法制备供试品溶液。精密吸取供试品溶液10 μL,分别进样测定,记录色谱图。以松果菊苷峰为参照峰,计算特征峰的相对保留时间及相对峰面积,结果各特征峰的相对保留时间的RSD < 0.4%,单峰面积占总峰面积大于2%的特征峰,其相对峰面积的RSD < 1.8%,相似度为0.99。结果表明该方法重复性好。
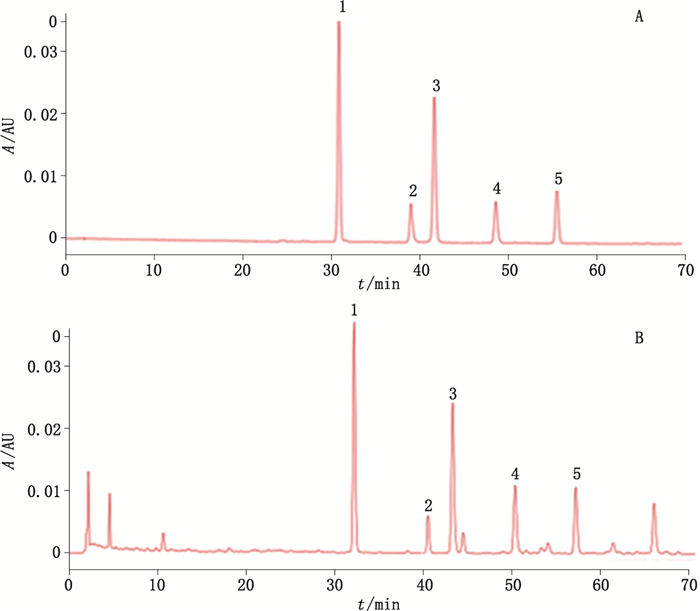
4 酒苁蓉中5个苯乙醇苷类成分的含量测定 4.1 色谱条件按“3.1”项下色谱条件进行检测。在该色谱条件下,5个苯乙醇苷类成分分离度良好,混合对照品及样品色谱图见图 4。
|
1.松果菊苷(echinacoside) 2.肉苁蓉苷A(cistanoside A) 3.毛蕊花糖苷(acteoside) 4.异毛蕊花糖苷(iso-acteoside) 5. 2′-乙酰基毛蕊花糖苷(2′-acetyacteoside) 图 4 混合对照品(A)、样品J10(B)色谱图 Fig.4 HPLC chromatograms of mixed reference substances(A)and sample J10 of wine-processed Cistanche Herba(B) |
精密量取“2.1”项下各对照品溶液0.1、0.5、1.0、2、5 mL,分别置5个10 mL量瓶中,加50%甲醇水定容至刻度,摇匀,即得各系列浓度混合对照品溶液。分别精密吸取各系列浓度混合对照品溶液10 μL,注入液相色谱仪,测定,以各对照品质量浓度(X,mg·mL-1)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,结果见表 2,表明各化合物在相应线性范围内线性关系良好。
|
|
表 2 回归方程、相关系数和线性范围 Tab.2 Regressive equations, correlation coefficients and linear ranges |
精密吸取混合对照品溶液(松果菊苷、肉苁蓉苷A、毛蕊花糖苷、异毛蕊花糖苷、2′-乙酰基毛蕊花糖质量浓度分别为0.201、0.040 4、0.040 8、0.040 2、0.040 4 mg·mL-1)10 μL,按“3.1”项下色谱条件,连续进样6次,计算松果菊苷、肉苁蓉苷A、毛蕊花糖苷、异毛蕊花糖苷及2′-乙酰基毛蕊花糖苷含量的RSD分别为0.41%、1.2%、0.91%、0.50%及2.3%,表明精密度良好。
4.4 稳定性试验精密吸取同一供试品溶液(样品J10)10 μL,按“3.1”项下色谱条件,分别于0、2、4、8、12、24 h进样测定,供试品溶液中松果菊苷、肉苁蓉苷A、毛蕊花糖苷、异毛蕊花糖苷及2’-乙酰基毛蕊花糖苷含量的RSD分别为0.59%、2.1%、0.51%、0.45%及2.3%,说明供试品溶液在24 h内稳定。
4.5 重复性试验取肉苁蓉样品J10粉末6份,按“2.2”项下方法操作,制备供试品溶液,按“3.1”项下色谱条件进样10 μL测定并计算,各供试品溶液中松果菊苷、肉苁蓉苷A、毛蕊花糖苷、异毛蕊花糖苷及2′-乙酰基毛蕊花糖苷的含量分别为0.25%、0.03%、0.13%、0.09%、0.07%,RSD分别为1.6%、2.6%、2.1%、1.4%及2.3%,说明样品分析结果稳定,该方法的重复性良好。
4.6 加样回收率试验精密称取肉苁蓉(J10)粉末约0.5 g,共6份,加入松果菊苷、肉苁蓉苷A、毛蕊花糖苷、异毛蕊花糖苷及2′-乙酰基毛蕊花糖苷的对照品溶液(相当于0.5 g肉苁蓉药材中松果菊苷、肉苁蓉苷A、毛蕊花糖苷、异毛蕊花糖苷及2′-乙酰基毛蕊花糖苷的100%的含有量),按“2.2”项下方法操作,制备供试溶液,在“2.1”项色谱条件下分析,计算平均回收率。结果松果菊苷、肉苁蓉苷A、毛蕊花糖苷、异毛蕊花糖苷、2′-乙酰基毛蕊花糖苷平均回收率(n=6)分别为99.8%(RSD=0.30%)、99.5%(RSD=1.6%)、100.2%(RSD=0.44%)、99.5%(RSD=0.53%)和99.8%(RSD=0.36%)。
4.7 样品测定精密称取肉苁蓉粉末1 g共2份,分别按“2.2”项下方法制备供试品溶液。精密吸取各供试溶液10 μL,按“3.1”项下色谱条件进行测定,计算出含量,结果见表 3。
|
|
表 3 酒苁蓉中5个成分的含量(%,n=2) Tab.3 Contents of five components in wine-processed Cistanche Herba |
本实验采用梯度洗脱法分离酒苁蓉中的5个主要化学成分,对流动相进行了优选,考察了甲醇-水、甲醇-甲酸水、乙腈-水和乙腈-甲酸水系统[5-6],结果甲醇-0.1%甲酸水作为流动相梯度洗脱时,5个成分均可获得良好的分离度和峰形。通过紫外吸收光谱全波长扫描,发现5个成分在330 nm处有最大吸收,确定本实验的测定波长为330 nm。
5.2 特征图谱15批酒苁蓉HPLC图谱与特征图谱之间相似度计算结果显示,其中14批合格饮片相似度均大于0.940,相似度好,具有一致性,不同来源的酒苁蓉成分比例相似,除此之外,样品J12质量较差,相似度为0.871,说明该方法可作为酒苁蓉饮片的质量评价方法,建立的特征图谱具有较强的专属性,具备定性定量双重作用,对酒苁蓉饮片真伪优劣的鉴定具有参考意义。
5.3 苯乙醇苷类含量测定由表 3可见,各批酒苁蓉中苯乙醇苷类含量相差较大。以松果菊苷为例,各批次酒苁蓉松果菊苷含量相差近30倍,分析可能是由于品种、产地或加工炮制方式不同等原因导致[7-9]。样品中2′-乙酰基毛蕊花糖苷的含量很低,根据文献研究,推测可能受采收季节或炮制加工的影响[10]。
根据酒苁蓉饮片市场收集情况,发现肉苁蓉存在严重品种混乱,真伪混杂,质量不一等问题,后续可在现有基础上,收集来源明确的药材或饮片,分析不同基源、不同产地、不同栽培方式、不同采收季节、不同加工炮制方式的肉苁蓉中化合物种类与含量,进一步完善肉苁蓉质量标准,以期达到规范药材饮片市场,合理用药的目的。
5.4 小结本实验在同一色谱条件下,建立了酒苁蓉饮片的特征图谱,并同时测定不同批次酒苁蓉中松果菊苷、肉苁蓉苷A、毛蕊花糖苷、异毛蕊花糖苷及2′-乙酰基毛蕊花糖苷5个苯乙醇苷类成分的含量,方法简便、快速、准确,具备定性定量双重作用,为有效控制酒苁蓉饮片质量提供了科学依据。
| [1] |
中华人民共和国药典2015年版.一部[S]. 2015: 216 ChP 2015. Vol Ⅰ[S]. 2015: 216 |
| [2] |
雷丽, 宋志宏, 屠鹏飞. 肉苁蓉属植物的化学成分研究进展[J]. 中草药, 2003, 34(5): 473. LEI L, SONG ZH, TU PF. Advances in research of chemical constituents in plants of Cistanche Hoffing. et Link[J]. Chin Tradit Herb Drugs, 2003, 34(5): 473. DOI:10.3321/j.issn:0253-2670.2003.05.044 |
| [3] |
曹振杰, 赵文军, 吴雪萍. 肉苁蓉中苯乙醇甙类化合物的LC-MS分析[J]. 中药材, 2004, 27(3): 175. CAO ZJ, ZHAO WJ, WU XP. Determination of phenylethanoid glycosides from Cistanche deserticola in spring and autumn with LC-MS[J]. J Chin Med Mater, 2004, 27(3): 175. DOI:10.3321/j.issn:1001-4454.2004.03.011 |
| [4] |
宋志宏, 雷丽, 屠鹏飞. 肉苁蓉属植物的药理活性研究进展[J]. 中草药, 2003, 34(9): 113. SONG ZH, LEI L, TU PF. Advances in research of pharmacological activity in plants of Cistanche Hoffing. et Link[J]. Chin Tradit Herb Drugs, 2003, 34(9): 113. |
| [5] |
马志国. 沙苁蓉与肉苁蓉饮片HPLC指纹图谱鉴别研究[J]. 中国药学杂志, 2011, 46(12): 899. MA ZG. Differentiation of processed Cistanche sinensis G. Beck and Herba Cistanches by HPLC[J]. Chin Pharm J, 2011, 46(12): 899. |
| [6] |
朱乃亮, 徐荣, 吴海峰, 等. 荒漠肉苁蓉和管花肉苁蓉指纹图谱比较研究[J]. 中国药学杂志, 2016, 51(13): 1116. ZHU NL, XU R, WU HF, et al. Fingerprint comparative analysis of Cistanche deserticola Y. C. Ma and Cistanche tubulosa(Schrenk) Wight[J]. Chin Pharm J, 2016, 51(13): 1116. |
| [7] |
李承花, 刘婧慧, 徐珍霞, 等. RP-HPLC同时测定管花肉苁蓉中4种苯乙醇苷的含量[J]. 药物分析杂志, 2010, 30(6): 1003. LI CH, LIU JH, XU ZX, et al. RP-HPLC simultaneous determination of four phenylethanoid glycosides in Cistanche tubulosa (Schrenk)[J]. Chin J Pharm Anal, 2010, 30(6): 1003. |
| [8] |
彭芳, 徐荣, 王夏, 等. 不同等级整株肉苁蓉的药材品质和产地加工蒸制时间研究[J]. 中药材, 2016, 39(2): 302. PENG F, XU R, WANG X, et al. Effect of grade and steaming time on quality of cultivated Cistanche deserticola[J]. J Chin Med Mater, 2016, 39(2): 302. |
| [9] |
马志国, 谭咏欣. 酒蒸不同时间肉苁蓉中6种苯乙醇苷类成分的变化[J]. 中成药, 2011, 33(11): 1951. MA ZG, TAN YX. Contents changes of six phenylethanoid glycosides under steaming time spans with wine in desertliving Cistanche[J]. Chin Tradit Pat Med, 2011, 33(11): 1951. DOI:10.3969/j.issn.1001-1528.2011.11.029 |
| [10] |
钱浩, 喻芳君, 耿宗成, 等. 不同季节采收的肉苁蓉中4种苯乙醇苷的含量比较研究[J]. 药物分析杂志, 2016, 36(11): 1971. QIAN H, YU FJ, GENG ZC, et al. Comparative study of the content of four phenylethanoid glycosides in Cistanche deserticola Y. C. Ma from different seasons[J]. Chin J Pharm Anal, 2016, 36(11): 1971. |
 2019, Vol. 39
2019, Vol. 39 
