2. 北京协和药厂, 北京 102629;
3. 中国药科大学, 南京 210009
2. Beijing Union Pharmaceutical Factory, Beijing 102629, China;
3. China Pharmaceutical University, Nanjing 210009, China
分析方法是药品质量标准中的要素之一,稳健可靠的分析方法是控制药品质量的重要基础;各国药典和相关法规对方法验证都非常重视,并提出相应的规范要求[1-3],重点指导方法验证的规范性。但目前这些法规之间存在差异,对一些基本问题的回答还存在含糊不清之处,如ICH对方法验证的LOD值给出了不同的获取方式,但对于不同方式并未作深入比较,如何更全面规范地描述方法满足其预期用途仍然值得探讨。本文拟通过对双环醇片的含量检测方法[4],结合方法验证的最新进展[5-6]和本专栏中《定量理化分析方法满足预期用途的判断标准探讨》《方法验证性能参数的获取和评价新方式探讨》的论述,从顶层设计出发,在原有方法[7]的基础上,引入更多统计分析手段,对其方法验证进行深入评价,同时为今后含量测定类方法的验证提供参考依据。
1 仪器和试药 1.1 仪器2台不同编号的U3000高效液相色谱仪(带DAD检测器,Thermo公司);XS 2015十万分之一电子天平(Mettler Toledo公司);Thermo超纯水机(Thermo公司);KQ2200E超声波清洗器(昆山市超声仪器有限公司)。
1.2 试剂和试药对照品:双环醇(批号101044-201001,纯度99.7%)、联苯双酯(批号100192-201504,纯度99.9%)、甲醚化双环醇(批号420032-201501,用于鉴别),均由中国食品药品检定研究院提供。
样品:双环醇片(批号181104,规格25 mg,北京协和药厂)。
试剂:乙腈(色谱级,批号178496,Fisher Chemical公司);乙酸(色谱纯,批号20140307,天津福晨化学试剂厂);自制超纯水、纯化水。
2 溶液的制备 2.1 供试品溶液取本品10片,用乳钵研细至无颗粒感,取约145 mg(约相当于双环醇25 mg),精密称定,置25 mL量瓶中,加入乙腈超声(功率100 W,频率40 kHz)溶解,用乙腈稀释至刻度,滤过,精密吸取续滤液5 mL,置50 mL量瓶中,用乙腈稀释至刻度,摇匀,制成每1 mL中约含双环醇100 μg的溶液,即得。
2.2 空白辅料溶液取空白片粉末约120 mg,按“2.1”项下方法配制,即得。
2.3 杂质增敏供试溶液精密称取双环醇杂质Ⅰ对照品(联苯双酯)20 mg与双环醇杂质Ⅱ对照品(甲醚化双环醇)60 mg,置20 mL量瓶中,用乙腈稀释至刻度,即得杂质储备液;精密量取杂质储备液和“2.1”项下的续滤液各5 mL,置50 mL量瓶中,用乙腈稀释至刻度,即得。
2.4 双环醇对照品溶液取双环醇对照品适量,按“2.1”项下方法配制,制成每1 mL中约含双环醇100 μg的溶液,即得。
3 色谱条件色谱柱:Waters C18 Symmetry(4.6 mm×250 mm,5 μm);柱温:40 ℃;流动相:乙腈-水-醋酸(55:45:0.01);流速:0.5 mL·min-1;检测波长:228 nm;进样体积:10 μL;分析时间:16 min。
4 统计分析软件本文所用统计软件包括JMP和《理化方法验证统计软件(PCMV)》
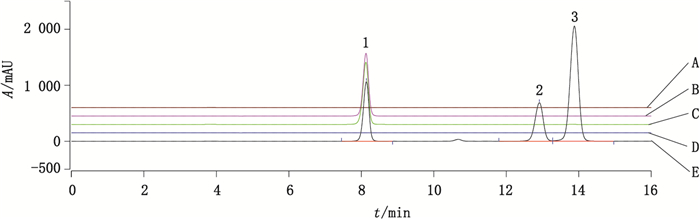
5 方法验证及结果 5.1 系统适用性和专属性精密量取“2”项下各溶液10 μL,以及空白溶剂10 μL,注入液相色谱仪,获得色谱图(图 1)。双环醇的保留时间大约在8 min,主峰与相邻杂质联苯双酯峰的分离度为13.67 > 2,理论塔板数以双环醇计为131 55,双环醇的回收率为100.6%。空白溶剂、空白片及主要杂质均对双环醇的测定均无干扰。
|
1.双环醇(bicyclol) 2.联苯双酯(bifendate) 3.甲醚化双环醇(methyl etherified bicyclol) 图 1 空白辅料溶液(A)、供试品溶液(B)、双环醇对照品溶液(C)、空白溶剂(D)、杂质增敏供试溶液(E)的色谱图 Fig.1 HPLC chromatograms of blank excipient solution (A), sample solution (B), bicyclol reference solution (C), blank solvent (D) and impurity sensitized sample solution (E) |
对于原料药或制剂的含量测定,USP < 1225 > 及ICH指南均推荐线性的最小范围应包括80%~120%的5个浓度点。在此基础上,期望考察更宽范围的线性关系,因此检测了7个浓度点,即相对于标示量的70%、80%、90%、100%、110%、120%、130%。
5.2.2 操作步骤精密称定双环醇对照品7份,按“2.1”项下方法配制,得到质量浓度分别为70、80、90、100、110、120、130 μg·mL-1的系列对照品溶液,相当于标示量的70%~130%。取上述系列对照品溶液各10 μL,注入液相色谱仪,记录色谱图(各溶液平行2次测定),检测结果见表 1。
|
|
表 1 线性试验的原始数据 Tab.1 Raw data for linear test |
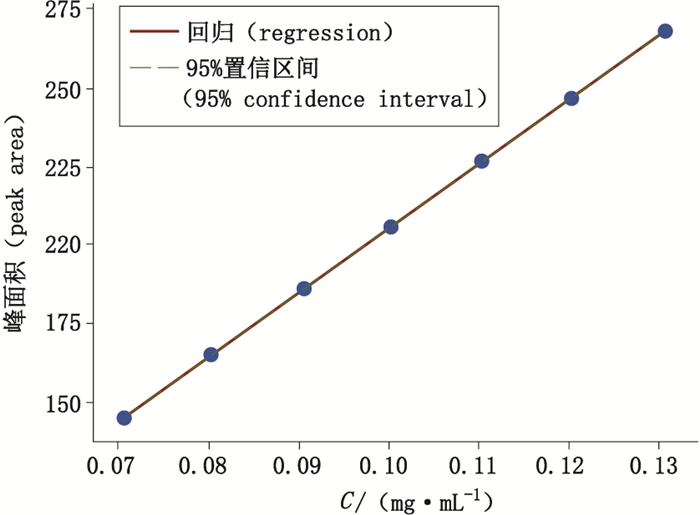
线性方程:在判断各个浓度下的数据均满足方差齐性的前提以后,以双环醇对照品浓度X(mg·mL-1)为横坐标,色谱峰峰面积Y为纵坐标,进行线性回归,得到的线性曲线如图 2所示。可知曲线的回归方程:
| $ Y = 2\;050.868X + 0.134\;\;\;\;{R^2} > 0.999\;9\;\;\;{\rm{RSME}} = 0.299\;6 $ |
|
图 2 线性拟合结果 Fig.2 Linear fitting result |
截距的检验:将截距与零点做统计学比较[8],结果如表 2所示。进行截距与零点的t检验得概率P=0.749 > 0.05,证明截距与零点无显著差异;截距的95%置信区间为[-0.761,1.030],此区间包括了零点,因此可以使用外标法计算浓度。
|
|
表 2 截距的检验结果 Tab.2 Intercept test results |
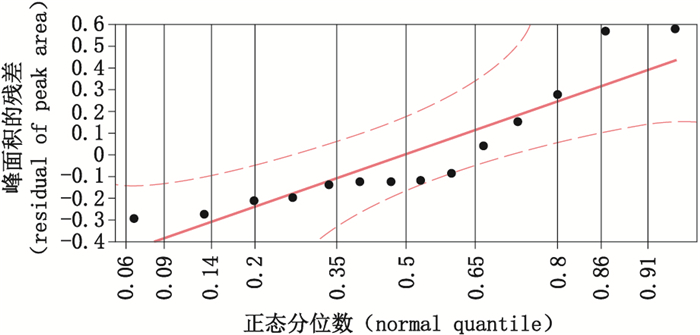
残差分布:所得线性方程的残差分布情况如图 3所示。正态分位数图显示残差分布趋于正态,表明在标示量70%~130%的范围内,残差的分布不会受到浓度变化的影响,所得线性方程在标示量70%~130%的范围内,浓度与峰面积的线性关系良好。
|
图 3 残差正态分位数图 Fig.3 Residual normal quantile map |
(1) 实验样本量的计算:合适的实验样本量n[9]可以确保所获得性能参数的可靠性,同时满足了验证试验的完整性和把握度。根据预实验情况,在JMP软件中输入方法的偏倚θ值(不超过5%),中间精密度σP值(不超过2%),α值(0.05)、1-β值(β=0.1),得到n=5。
(2) 实验影响因素:对影响方法准确度和精密度的关键因素进行风险分析[10],同时考虑到实验室现有设备与人员条件,最终确定考察的因素有仪器、人员和运行间隔。
(3) 采取完全析因[11]法,确定了包含3因素2水平的8个不同试验模式,见表 3。
|
|
表 3 8组试验的回收率结果 Tab.3 Recovery results of 8 groups of tests |
(4) 浓度点的设置:结合USP < 1225 > 及ICH要求,一般可采用包含80%~120%的3个浓度点,考虑到外标法的使用可能会导致低浓度点,如80%的点产生的偏倚较大,为了更好地反映回收率情况,最终确定浓度考察点为80%、90%、100%、110%、120%。
5.3.2 操作步骤精密称定双环醇原料药5份,分别置25 mL量瓶中,再向各量瓶中分别加入空白辅料120 mg,按“2.1”项下方法操作,得到质量浓度约为80、90、100、110、120 μg·mL-1的溶液,即相当于标示量的80%~130%,每个浓度独立制备3份。按表 3进行8组实验,检测结果见表 3。
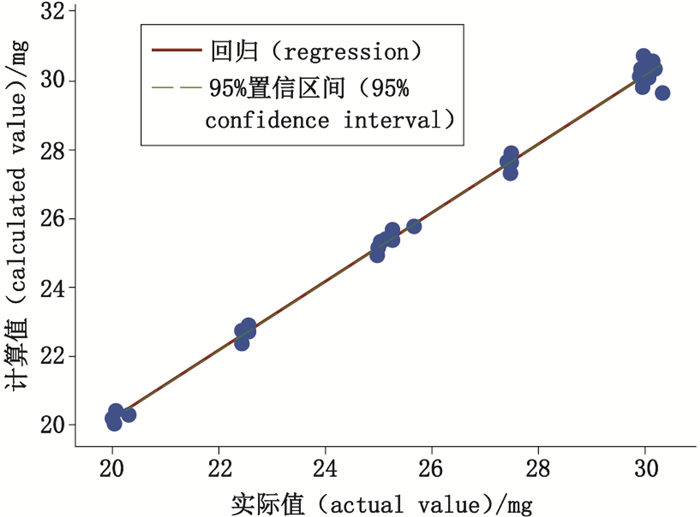
5.3.3 结果分析 5.3.3.1 准确度“预测值-实际值”的线性:根据USP < 1225 > 的提议,可通过比较预测浓度和实际浓度的差异来评估准确度,期望其斜率接近1或置信区间包含1。因此对不同浓度下的“预测含量-实际含量”做了线性拟合,结果见图 4。可知线性方程:
| $ Y = 0.999X + 0.158 $ |
|
图 4 准确度曲线 Fig.4 Accuracy curve |
根据表 4,将斜率与1做检验,可知斜率与1无显著性差异(P=0.894 > 0.05),并给出了斜率的95%置信区间[0.991,1.008],包括1,满足USP < 1225 > 相关要求。
|
|
表 4 斜率的检验结果 Tab.4 Slope test results |
表 5是根据软件评估准确度获得的的结果,可知平均偏倚为0.59%,且各浓度下的偏倚置信上下限均未超过±2%,因此在标示量80%~120%的范围内,方法的准确度均能满足需求。
|
|
表 5 各浓度下的准确度分析 Tab.5 Accuracy analysis at different concentrations |
同时对表 3数据进行精密度评估,结果见表 6,可知总中间精密度为0.59%,且各浓度下的中间精密度上限均未超过1.43%,因此在标示量80%~120%的范围内,方法的精密度能够满足要求。
|
|
表 6 各浓度下的精密度分析 Tab.6 Precision analysis at different concentrations |
联合了方法的准确度与精密度,设置产品的可接受变异为±10%(因为产品的可接受标准即为90.0%~110.0%),对总体方法能力进行评价,结果如表 7和图 5、6所示。可知在80.0%~120.0%的范围内,方法能力指数均达到了一级,由于方法变异造成的误判率可以忽略不计[11],此方法在该范围内能够很好地满足检测需求。
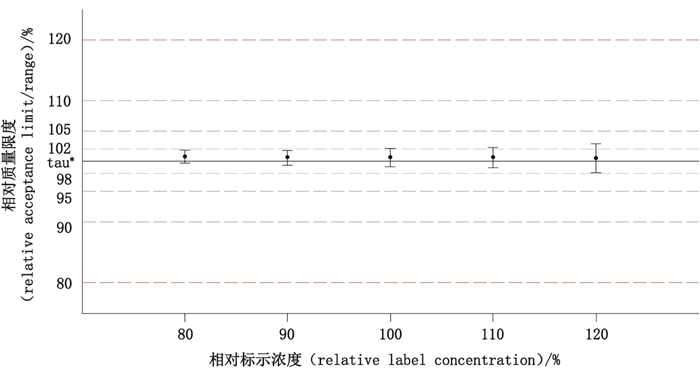
|
*目标值(target value) 图 5 95%/90%容忍区间 Fig.5 95%/90% tolerance interval |
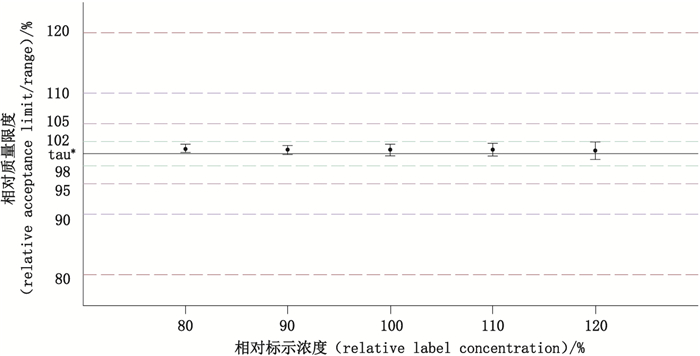
|
*目标值(target value) 图 6 95%预测区间 Fig.6 95% prediction interval |
|
|
表 7 不同浓度水平下的方法能力评价 Tab.7 The evaluation of method capability at different concentrations |
以往含量测定的方法验证[2-3],多采用单独实验设计分别获得准确度和精密度;该方式割裂了这些参数的相互关系,使所获参数的可靠性受到损失[12]。USP < 1210 > [5]所采用的实验设计虽然引入了多因素综合设计的方式(3个浓度,每个浓度制备3份样品得到9次实验结果),但这种设计一旦出现浓度范围设置不当,如出现异常值或其他偶然变异因素,很可能导致对方法适用范围的损失或错误结论;同时,因每个浓度点的样本量过少,也无法获得可靠的准确度和精密度。
为克服上述设计的局限性,本实验首先根据方法的预期用途,选定不同的浓度范围,然后在充分考虑样本量[13]基础上,对每个浓度点采用3因素2水平的完全析因设计[9](2仪器、2人员和2运行间隔)进行8次实验,以确保每个浓度点所获得各方法性能参数真实可靠。
该设计除具有能获得各浓度点的可靠方法性能参数、有利于更好地判断方法适应范围外,还有利于从验证试验结果中计算出各因素的变异分量,从而识别出更多信息。如在本实验中:(1)通过方差分析可发现人员、仪器和运行间隔这3个主要因素中,不同仪器所产生的方差远大于分析人员和运行间隔,说明仪器是影响该方法的主要因素;进一步对仪器进行单独方差分析,发现仪器2的检测结果比仪器1产生更大的偏倚,说明就双环醇片的含量检测而言,仪器1的检测性能要优于仪器2。(2)根据各浓度点下的结果分布散点图,可以查找出异常数据点等。
6.2 含量测定类定量方法的判定标准或依据问题目前,《中华人民共和国药典》(简称《中国药典》) [2]和一些文献[6]对含量测定类方法采用Horwitz方程给出的方式作为判断其满足预期用途的标准。欧洲官方药品检定实验室(Official Medicines Control Laboratories,OMCL)内部采用方法能力指数的方式进行判断,但其仅用精密度来代替方法的总变异(variability)。检测方法是判定药品质量的重要量具,而前述的判断方式或依据已被证明过于粗糙,不能作为判断检测方法的标准[14]。
本文采用本专栏中《定量理化分析类方法满足预期用途的判断标准探讨》一文提出的方法能力指数和USP < 1210 > 容忍区间和预测区间的方式进行判断。方法能力指数的判断模式对于含量测定类方法,特别在已确定出所检测产品的质量标准时,更有利于根据方法误判率来判断方法是否可用,以及使用该方法的风险大小。本次实验结果表明,对产品的质量标准为90%~110%时,方法能力指数在80%~120%的范围内均在2以上,检测方法误判率可忽略不计。
本文所计算出的方法变异的预测区间和容忍区间[15]也可评估方法是否适于其预期用途;但没有方法能力指数直接。这2个指数的优势是可以为后续方法确认和转移的判断提供依据,即进行方法确认或转移时,其个体检测结果有95%的概率应落在其预测区间内,所有检测结果的90%有95%的概率会落在容忍区间内。
6.3 《中国药典》中双环醇片的测定方法完全满足其预期用途本次实验对于《中国药典》中收载的双环醇片的含量测定方法(即HPLC法)进行了更全面深入的验证:在标示量的70%~130%范围内,线性方程为Y=2050.868X+0.134(R2 > 0.999 9),回归线标准误(RSME)在0.30左右,符合要求。在标示量的80%~120%范围内,准确度中的最大相对偏倚发生在80%标示量点(0.78%);精密度中的最差浓度点发生在120%标示量点(中间精密度值为0.89%)。各浓度点的方法总变异位于0.67%~0.87%范围内,95%/90%容忍区间位于98.11%~102.78%范围内,95%预测区间位于98.95%~101.95%范围内。对于检测质量限度标准为98.0%~102.0%的原料药,其方法能力指数在0.8以上(Ⅳ级),方法的误判率不超过0.8%;对于检测质量限度标准为90.0%~110.0%的终产品,其方法能力指数均在2.0以上(Ⅰ级),方法的误判率可忽略。综上可见,该方法可用于双环醇原料药和终产品的含量检测。
| [1] |
USP 41-NF 36[S]. 2018: 7665(<1225>Validation Of Compendial Procedures)
|
| [2] |
中华人民共和国药典2015年版.四部[S]. 2015: 374 Ch P 2015. Vol Ⅳ[S]. 2015: 374 |
| [3] |
ICH Q2(R1): Harmonised Tripartite Guideline Validation of Analytical Procedure: Text and Methodology[S]. 2005
|
| [4] |
唐静. 双环醇片防治抗癌药物所致肝损害临床研究[J]. 中国药业, 2015, 24(16): 43. TANG J. Clinical research on bicyclol tablet for preventing and treating anti-cancer drug induced liver[J]. China Pharm, 2015, 24(16): 43. |
| [5] |
USP 41-NF 36[S]. 2018: 7663(<1210>Statistical Tools For Procedures Validation)
|
| [6] |
<1200> Requirements for Compendial Validation[J/OL]. USP Pharmacoperial Forum, 2015, 41(5)[2017-08-07]. http://www.usppf.com/pf/pub/index.html
|
| [7] |
中华人民共和国药典2015年版.二部[S]. 2015: 93 ChP 2015. Vol Ⅱ[S]. 2015: 93 |
| [8] |
ERMER J, MILLER J. Method Validation in Pharmaceutical Analysis[M]. Weinheim: Wiley-Vch, 2005: 30.
|
| [9] |
USP 41-NF 36[S]. 2018: 1803(<1033>Bilogical Assay Validation)
|
| [10] |
FDA. Analytical Procedures and Methods Validation for Drugs and Biologics Guidance for Industry[S]. 2015
|
| [11] |
谭德讲, 马双成. 药品监督与检定中的统计学应用[M]. 北京: 中国科学技术出版社, 2011. TAN DJ, MA SC. Statistical Application in Drug Supervision and Verification[M]. Beijing: China Science and Technology Press, 2011. |
| [12] |
胡良平. 检验医学科研设计与统计分析[M]. 北京: 人民军医出版社, 2004. HU LP. Scientific Research Design and Statistical Analysis in Laboratory medicine[M]. Beijing: People' Military Medical Press, 2004. |
| [13] |
USP 41-NF 36[S]. 2018: 6706(<1010>Analytical Data-Interpretation and Treatment)
|
| [14] |
DESIMONI E, BRUNETTI B. Uncertainty of measurement and conformity assessment:a review[J]. Anal Bioanal Chem, 2011, 400(6): 1729. DOI:10.1007/s00216-011-4776-y |
| [15] |
张横, 谭德讲. 统计区间的作用及在药品质量控制中的应用[J]. 药物分析杂志, 2013, 33(11): 1840. ZHANG H, TAN DJ. The effects of statistical intervals and their application in pharmaceutical quality control[J]. Chin J Pharm Anal, 2013, 33(11): 1840. |
 2019, Vol. 39
2019, Vol. 39 
