溶栓是治疗急性心肌梗死的重要手段[1-2],溶栓药物能够使纤溶酶原转化为纤溶酶,纤溶酶能溶解血栓中的纤维蛋白,从而使血管再通。针对组织型纤溶酶原激活剂(t-PA)进行研究的溶栓药物已发展到第三代[3-4]。
第一代重组t-PA类溶栓药是由美国基因泰克公司研制的重组人组织型纤溶酶原激活剂(rt-PA),该药虽然疗效好,但半衰期非常短[5-6];第二代是由德国BM(宝灵曼)公司开发的组织型纤溶酶原激活剂缺失变异体(r-PA),相比于第一代rt-PA,其半衰期延长了4~5倍[7];第三代是由美国基因泰克公司研制的点突变体(TNK-tPA),相比于第一代rt-PA,降低了血浆清除速度,半衰期延长4倍,结合能力增强10~14倍,对抑制剂PAI-1的拮抗能力增强80倍[8-9],无抗原性,不引起过敏反应,具有溶通率高、特异性强、出血风险低等特点[10]。
目前,国产TNK-tPA已经获批并投放市场,质量控制贯穿于产品从研发到生产的整个生命周期中,生物学活性是产品有效性的主要控制指标。实验室用于定量测定溶栓活性的方法依然是传统的纤维蛋白平板溶圈法[11-13]和气泡上升法[14-15],为了更好地控制产品质量,将2种方法进行了比对分析。
1 材料与方法 1.1 标准品及供试样品活性测定标准品、供试样品重组人组织型纤溶酶原激活剂TNK突变体(TNK-tPA)由企业提供。
1.2 主要试剂及仪器电泳级高强度琼脂糖、人纤维蛋白原(货号:F-4753,批号:SLBG1274V)、人纤溶酶原(货号:P7999-10 UN)为SIGMA公司产品;人凝血酶为中国食品药品检定研究院制备的国家标准品(批号20021105;127 IU·支-1);Na2HPO4·12H2O、NaH2PO4·2H2O、NaN3均为国产分析纯;无菌生理盐水为石家庄四药有限公司产品;精密天平(0.01 mg)为Sartorius公司产品;数显三用恒温水浴箱为江苏省金坛市荣华仪器制造有限公司产品;恒温培养箱为MMM公司产品。
1.3 溶液的制备 1.3.1 稀释液称取Na2HPO4·12H2O 17.4 g,NaH2PO4·2H2O 1.778 g,NaN3 0.1 g,加入超纯水充分溶解后,定容至1 000 mL,加入少许NaH2PO4·2H2O调节pH至7.2。
1.3.2 凝血酶标准品用稀释液将凝血酶标准品溶解并稀释为100 IU·mL-1和30 IU·mL-1 2个浓度备用,分装后-20 ℃保存。
1.3.3 纤维蛋白原分别称取纤维蛋白原130 mg和20 mg,分别加入稀释液10 mL,放入37 ℃水浴中,不可摇动,待充分溶解,浓度为13 mg·mL-1和2 mg·mL-1,现用现配。
1.3.4 纤溶酶原用稀释液1.0 mL将纤溶酶原溶解,按标示装量稀释为0.5 mg·mL-1和0.1 mg·mL-1 2个浓度,分装后-20 ℃保存。
1.4 溶圈法称取琼脂糖150 mg,加入生理盐水23 mL,煮沸溶解,60 ℃水浴平衡,加入浓度为100 IU·mL-1凝血酶20 μL,加入浓度为0.5 mg·mL-1纤溶酶原300 μL,边加边摇匀,加入浓度为13.2 mg·mL-1纤维蛋白原1 mL,摇匀,混浊后马上倒入直径9 cm的平板中,水平放置,充分凝固后,放置4 ℃冰箱至少0.5 h,待用(应在2 d内使用)。将活性测定标准品用稀释液稀释至1 000、500、250、125、62.5 IU·mL-1,供试样品稀释至约250 IU·mL-1;用直径2 mm打孔器在制备好的纤维蛋白平板内打孔,每孔点样6 μL,每个样品2复孔,放入湿盒中,置37 ℃恒温培养箱16 h,纵横2次量取溶圈直径,以标准品各个稀释度活性的对数为横坐标(X),溶圈直径的平均值(4次量取的数值)的对数为纵坐标(Y)。利用统计学软件中的回归分析方法作标准曲线,并求得Y=a+bX中的a和b及拟合优度(R2)值,根据样品的溶圈直径计算样品的活性。
1.5 气泡上升法用稀释液将活性测定标准品稀释至3 000、1 500、750、375、187.5、93.75 IU·mL-1,供试样品稀释至约500 IU·mL-1;取质量浓度为0.1 mg·mL-1的纤溶酶原20 μL与质量浓度为2 mg·mL-1的纤维蛋白原溶液1 mL混合,冰浴保存备用(以下称A液);取活性标准品或供试样品120 μL与浓度为30IU·mL-1的凝血酶溶液120 μL混合,冰浴保存备用(以下称B液);取B液200 μL,加入A液中快速混匀,置37 ℃水浴中,开始用秒表计时,当气泡全部上升至表面时为终点,记录时间。以各稀释度标准品活性的对数为横坐标(X),气泡上升时间的对数为纵坐标(Y),利用统计学软件中的回归分析方法作标准曲线,并求得Y=a+bX中的a和b及拟合优度(R2)值,根据样品的气泡上升时间可求得样品的活性。
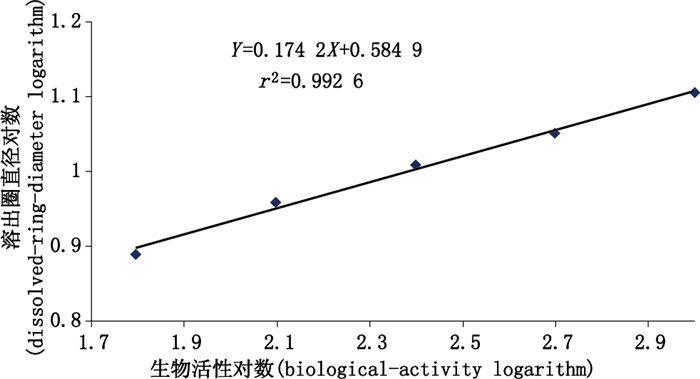
1.6 统计分析 2 结果 2.1 溶圈法用活性测定标准品绘制标准曲线,所测数据符合直线回归方程Y=0.174 2+0.584 9X(r2=0.992 6),见图 1。不同时间内测得TNK-tPA供试样品生物学活性8次结果几何平均值为2.89×104 IU·支-1,GCV-1为9.71%。结果见表 1。
|
注(notes):对数值没有单位,转换前生物学活性单位为IU·mL-1,转换前时间的单位为毫米(There is no unit for the logarithm value. The biological activity unit before conversion is IU·mL-1,and the length before conversion is millimeter) 图 1 溶圈法测定标准曲线 Figure 1 Standard curve of dissolving-ring method |
|
|
表 1 2种方法测定的TNK-tPA生物学活性结果 Table 1 TNK-tPA biological activity results measured by two methods |
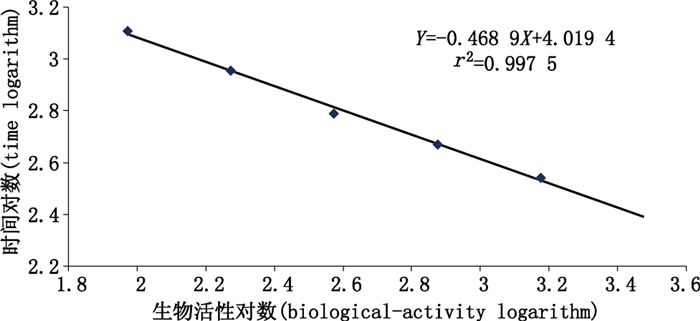
测得活性标准品数据符合直线回归方程Y=-0.468 9+4.019 4X(r2=0.997 5),见图 2。不同时间内测得TNK-tPA供试品生物学活性8次结果几何平均值为2.95×104IU·支-1,GCV-1为5.7%。结果见表 1。
|
注(notes):对数值没有单位,转换前生物学活性单位为IU·mL-1,转换前时间的单位为s(There is no unit for the logarithm value. The biological activity unit before conversion is IU·mL-1,and the time before conversion is a second.) 图 2 气泡法测定标准曲线 Figure 2 Standard curve of bubble-rising method |
2种方法检测结果,经方差齐性检验,方差齐(P > 0.05);经t检验分析,t=0.475,小于t界值,2.145(双侧,自由度=14,显著水平=0.05),P=0.64大于0.05,故2种方法检测结果差别不显著。
2种方法检测结果转换为对数后,经方差齐性检验,方差齐(P > 0.05);经t检验分析,t=0.530,小于t界值2.145(双侧,自由度=14,显著水平=0.05),P=0.60大于0.05,故2种方法检测结果差别不显著。
经置换检验分析,2组数据间差值分布的标准差为0.30×104 IU·支-1,2组数据平均值差值为0.056×104 IU·支-1,在约90%接受度下,以落入数据间差值分布0.2SD范围,即≤0.06×104IU·支-1,差值小于2组数据均值的2%,2组数据相当。
3 讨论虽然文献报道的溶栓药物生物学活性测定方法较多,如纤维蛋白平板溶圈法、发色底物法、酶联纤维蛋白溶解法、气泡上升法、酶联免疫吸附法等[18-19],但目前实验室用于定量测定溶栓活性的方法仍然是纤维蛋白平板溶圈法和气泡上升法。其原理是利用纤维蛋白原和凝血酶在体外模拟血栓,溶栓药物可以激活游离的纤溶酶原为有活性的纤溶酶,纤溶酶降解纤维蛋白为可溶性片断;纤维蛋白平板法在平板上形成透明的溶解圈,溶圈的大小跟活性成正比例关系;气泡上升法则在试管中形成小气泡逐步上升到表面,活性越高,气泡上升速度越快,全部气泡上升到表面所用的时间越短。
从实验结果来看,2种方法检测结果几何均值差值小于5%,结果一致。平板法有其操作简单,结果比较直观的优点,但在操作上影响因素较多,例如琼脂糖浓度跟平板的硬度有关,平板的软硬直接影响打孔的质量,纤维蛋白原和凝血酶浓度跟平板的混浊度有关,并且实验需要时间较长(16 h以上),用卡尺测量直径误差较大,易受主观因素影响;气泡法在操作上相对影响因素较少,操作简单,实验周期短(1 h以内),只要注意及时冰浴及37 ℃水浴时用秒表准确记录时间,RSD较小。鉴于以上分析,建议在TNK-tPA的生物学活性检中使用气泡上升法。
2种检测方法数据的一致性主要源于使用了同一生物学活性标准品,虽然不同方法选取的监测指标不同,溶圈法的溶圈直径与供试品浓度(或稀释度)呈正相关;气泡法的气泡开始上升时间与供试品浓度(或稀释度)呈负相关,在标准品的校正下,排除了大部分干扰,较好地保证了2种检测方法数据的一致性。
2种数据一致性推断慎用t检验进行分析,因为t检验设计的目的是为了分辨2种数据的差别,如果数据量足够大,差别总可见(两均数差不为零)。
本文用到的置换检验是用2组数据间的差值分布作为比较基础,来判断2组数据平均值所在位置,如果其落入数据间差值分布0.2SD(点考察参数)的区域内,在90%接受度下,可认为2组数据相当。
本文分析了溶圈法和气泡法检测数据的一致,说明2种检测TNK-tPA生物学活性的方法相当,为TNK-tPA生物学活性的综合利用和一致性分析进行铺垫。
| [1] |
梁峰, 胡大一. 替奈普酶[J]. 临床药物治疗杂志, 2003, 1(1): 58. LIANG F, HU DY. TNK-tPA[J]. Clin Med J, 2003, 1(1): 58. DOI:10.3969/j.issn.1672-3384.2003.01.022 |
| [2] |
焦昕, 胡大一, 梁峰, 等. 急性心肌梗死患者TNK-tPA与rt-PA溶栓出血发生率的比对研究[J]. 中国医院用药评价与分析, 2009, 9(4): 302. JIAO X, HU DY, LIANG F, et al. Incidence of hemmorrhage in patients with acute myocardial treated with TNK-tPA versus rt-PA[J]. Eval Anal Drug-Use Hosp China, 2009, 9(4): 302. |
| [3] |
王泽, 杜莉. 急性心肌梗死溶栓药物的进展[J]. 世界最新医学信息文摘, 2015, 15(19): 21. WANG Z, DU L. The progress in thrombolytic drugs for acute myocardial infarction[J]. World Lat Med Inf, 2015, 15(19): 21. DOI:10.3969/j.issn.1671-3141.2015.19.012 |
| [4] |
鲁振华, 李永东. 急性心肌梗死溶栓药物的研究进展[J]. 医学综述, 2016, 22(19): 3838. LU ZH, LI YD. The research progress in thrombolytic drugs for acute myocardial infarction[J]. Med Recapitul, 2016, 22(19): 3838. DOI:10.3969/j.issn.1006-2084.2016.19.026 |
| [5] |
NORDT TK, BODE C. Thrombolysis:newer thrombolytic agents and their role in clinical medicine[J]. Heart, 2003, 89(11): 1358. DOI:10.1136/heart.89.11.1358 |
| [6] |
BOUDREAU DM, GUZAUSKAS GF, CHEN E, et al. Cost-effectiveness of recombinant tissue-type plasminogen activator within 3 hours of actue ischemic stroke:current evidence[J]. Stroke, 2014, 45(10): 3032. DOI:10.1161/STROKEAHA.114.005852 |
| [7] |
VERDTRAETE M, LIJNEN HR, COLLEN D. Thromboly-ticagentsin development[J]. Drugs, 1995, 50(1): 29. DOI:10.2165/00003495-199550010-00003 |
| [8] |
徐蜀远, 季晓丽. 第三代溶栓药物[J]. 国外医药:合成药.生化药.制剂分册, 2001, 22(5): 301. XU SY, JI XL. The third generation of thrombolytic drugs[J]. Word Pharm Synth Drug Biochem Med Prep Fasc, 2001, 22(5): 301. |
| [9] |
PERLER B. Thrombolytic therapies:the current state of affairs[J]. J Endovas Ther, 2005, 12(2): 224. DOI:10.1583/04-1438.1 |
| [10] |
VENU M, ROBERT AH, JUDITH SH, et al. Thrombolysis and adjunctive therapy in acute myocardial infarction:The seventh ACCP conference on antithrombotic and thrombolytic therapy[J]. Chest, 2004, 126(3): 549. DOI:10.1378/chest.126.3_suppl.549S |
| [11] |
ASTRUPT T, MULLERZ S. The fibrin plate method for estimating fibrinolytic activity[J]. Arch Biochem Biophys, 1952, 40(2): 346. DOI:10.1016/0003-9861(52)90121-5 |
| [12] |
中华人民共和国药典2015年版.三部[S].2015: 通则3529 ChP 2015.Vol Ⅲ[S].2015: General 3529 |
| [13] |
丁有学, 李响, 韩春梅. 重组人尿激酶原质控方法和质量标准的研究[J]. 中国生物制品学杂志, 2007, 20(7): 515. DING YX, LI X, HAN CM, et al. Development of methods and standard for quality of recombinant human pro-urokinase[J]. Chin J Biol, 2007, 20(7): 515. DOI:10.3969/j.issn.1004-5503.2007.07.013 |
| [14] |
丁有学, 韩春梅, 刘兰. 重组人组织型纤溶酶原激活剂改构体指控方法的建立[J]. 中国生物制品学杂志, 2013, 26(7): 1015. DING YX, HAN CM, LIU L, et al. Study on methods for quality control of recombinant human tenecteplase[J]. Chin J Biol, 2013, 26(7): 1015. |
| [15] |
EP 7.0[S].2008: 1170
|
| [16] |
SONDHI A, RICE KM. Fast permutation tests and related methods, for association between rare variants and binary outcomes[J]. Ann Hum Genet, 2018, 82(2): 93. DOI:10.1111/ahg.2018.82.issue-2 |
| [17] |
ENDRENYI L, CHI E, CHOW SC, et al. Bioequivalence and biosimilarity of highly variable drugs[J]. Chin J Pharm Anal, 2015, 35(5): 803. |
| [18] |
赵明, 潘映红, 王一丁. 溶栓活性体外检测方法概况[J]. 中国药事, 2006, 20(2): 117. ZHAO M, PAN YH, WANG YD. Review on the in vitro detection method of thrombolysis activity[J]. Chin Pharm Aff, 2006, 20(2): 117. DOI:10.3969/j.issn.1002-7777.2006.02.027 |
| [19] |
魏华, 赵祥颖, 刘建军. 纳豆激酶溶栓活性的测定方法[J]. 食品与药品, 2006, 8(8A): 59. WEI H, ZHAO XY, LIU JJ. An assay method for thrombolysis activity of nattokinase[J]. Food Drug, 2006, 8(8A): 59. |
 2018, Vol. 38
2018, Vol. 38 
