中药巴戟天为茜草科植物巴戟天(Morinda officinalis How)的干燥根,味甘、辛,性微温,入肾经,为补肾助阳之要药[1]。现代药理研究表明,巴戟天具有抗抑郁、抗炎、抗疲劳、抗骨质疏松、降低血糖、增强免疫[2-4]等作用。大量研究表明,巴戟天多糖具有多种生物活性[5],是巴戟天促进免疫活性[6]、抗骨质疏松[7-8]等作用的物质基础;亦有研究显示[9-10],巴戟天中含有的近50%的糖类成分是以低聚糖类为主,目前分离得到的活性低聚糖有巴戟甲素、蔗果三糖、耐斯糖、及1F-果呋喃耐斯糖[11-13]等。
生物酶因其反应条件温和、高效、无毒等优点,在中药提取中得到了广泛的关注[14-15],但在有关生物酶辅助提取中药多糖的文献报道中,许多报道仅以总多糖含量的高低来说明生物酶辅助提取法优于传统提取法,而忽略了生物酶在自身降解和将植物细胞壁降解为多糖或单糖后可能引起的多糖含量增加,因此,选择适宜的评价指标优化生物酶辅助提取中药材的工艺参数显得非常重要。本实验在工艺优选中,同时以多糖及活性低聚糖—耐斯糖的含量为考察指标,采用二次通用旋转组合设计优化巴戟天的生物酶辅助提取工艺,以期为巴戟天的高效利用提供参考依据。
1 材料 1.1 仪器Agilent 1260高效液相色谱仪(美国安捷伦有限公司),Leb Tech紫外可见分光光度计(北京莱佰泰科技有限公司),ME电子分析天平(梅特勒-托利多仪器上海有限公司),MH-1000型调温型电热套(北京科伟永兴仪器有限公司),HH-S恒温水浴锅(金坛市环保仪器厂)。
1.2 试药巴戟天药材购自兰州复兴厚药材有限责任公司,经甘肃中医药大学晋玲教授鉴定为茜草科植物巴戟天(Morinda officinalis How)的干燥根(批号20150103);耐斯糖对照品(成都曼思特生物科技有限公司,纯度≥98.0%,批号MUST-16092714);葡萄糖对照品(中国食品药品检定研究院,批号110833-200904);纤维素酶(宁夏和氏璧生物技术有限公司,批号CNC1048447624);甲醇为色谱纯,其他试剂为分析纯。
2 方法与结果 2.1 耐斯糖的含量测定 2.1.1 色谱条件Agilent ZORBAX SB-C18色谱柱(5 μm,4.6mm×150 mm);流动相:甲醇-水(3: 97);流速:0.8 mL·min-1;进样量:5 μL;漂移管及雾化温度:40和80 ℃。耐斯糖对照品及巴戟天药材溶液色谱图见图 1。
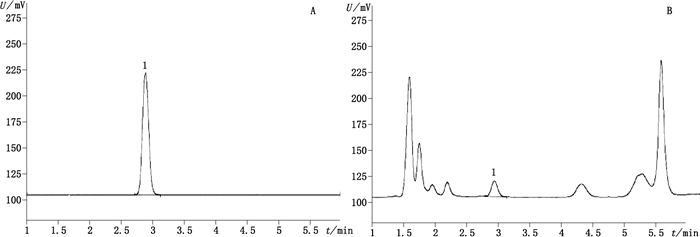
|
1.耐斯糖(Nisi sugar) 图 1 对照品(A)及样品(B)溶液色谱图 Figure 1 Chromatograms of reference substance(A)and sample solution(B) |
精密称取耐斯糖对照品0.017 5 g于25 mL量瓶中,加流动相溶解并定容,即得质量浓度为0.70 mg·mL-1的对照品溶液。
2.1.3 供试品溶液的制备取巴戟天药材粉碎,精密称5.0 g,加入0.18%的纤维素酶,再加入30 mL pH为5.0的磷酸盐缓冲液(磷酸氢二钠-柠檬酸),55 ℃酶解2.0 h后沸水浴10 min灭酶活性,将其全部转移至圆底烧瓶,加入20倍量水,回流提取3次,提取3.5 h,滤过,合并滤液,浓缩至10 mL(相当于1 mL浓缩液中含有0.5 g原药材)后,加入无水乙醇使溶液中醇浓度达80%,低温静置12 h,取沉淀部分水浴挥至无醇味,加水溶解定容至250 mL,吸取2.5 mL于蒸发皿中,水浴蒸干后加流动相溶解,过0.45 μm微孔滤膜,即得供试品溶液。
2.1.4 线性关系考察分别精密吸取对照品储备液于5 mL量瓶中,用流动相定容,制成质量浓度为0.07、0.14、0.28、0.42、0.56、0.7 mg·mL-1系列对照品溶液,照“2.1.1”项下条件进样测定,以峰面积(Y)对对照品质量浓度(X)作线性回归,得回归方程:
Y=3.276X+7.547 r2=0.999 7
线性范围为0.07~0.7μg·μL-1。
2.1.5 精密度试验将同一浓度对照品溶液,按照“2.1.1”项下条件连续进样6次,计算峰面积的RSD为2.4%,表明精密度良好。
2.1.6 重复性试验根据“2.1.3”项下方法平行制备6份供试品溶液,按照“2.1.1”项下条件分别进样测定。得6份供试品溶液中耐斯糖平均含量为8.1%,计算RSD为1.2%,表明重复性良好。
2.1.7 稳定性试验取同一供试品溶液,于0、2、4、6、12、24 h进样,测定峰面积,计算RSD为2.6%,表明稳定性良好。
2.1.8 加样回收率试验精密称取已测知含量的巴戟天药材5.0 g 9份,分别精密加入相当于样品中耐斯糖含量的80%、100%、120%的对照品溶液,按“2.1.3”项下方法处理,按照“2.1.1”项下条件测定峰面积,计算低、中、高回收率分别为94.9%、98.0%、97.6%,平均回收率(n=9)为96.8%,RSD为1.7%。
2.2 多糖含量的测定 2.2.1 标准曲线的制备分别精密吸取质量浓度为0. 1 mg·mL-1的对照品储备液1.0、2.0、4.0、6.0、8.0、10.0 mL,于10 mL量瓶中,用蒸馏水定容,配制成质量浓度分别为0.01、0.02、0.04、0.06、0.08、0.1 mg·mL-1的对照品溶液,分别移取1 mL于具塞试管中,加入5%苯酚溶液1.0 mL后快速加入5.0 mL浓硫酸,振荡,室温静置10 min,在40 ℃水浴15 min,流水冷却,在489 nm处测定不同浓度葡萄糖对照品溶液的吸收度,以葡萄糖对照品溶液质量浓度C为横坐标,吸收度A为纵坐标,绘制标准曲线,并计算回归方程。得回归方程:
A=0.103C-0.084 8 r2=0.999 6
线性范围0.01~0. 1 mg·mL-1呈良好线性关系。
2.2.2 多糖含量的测定精密吸取供试品溶液1 mL至250 mL量瓶,用蒸馏水定容,再从中吸取1 mL至具塞试管中,依“2.2.1”项下方法测定吸收度,按回归方程计算多糖(以葡萄糖计)含量。
2.3 单因素试验 2.3.1 酶解pH的考察精密称取巴戟天药材5.0 g,5份,分别加入pH 3.8、4.2、4.6、5.0、5.4、5.8的磷酸盐缓冲液30 mL,依“2.1.3”项下条件提取,以多糖得率为指标,按“2.2”项方法测定多糖含量,结果如图 2所示。由图 2可知,pH为5.0时多糖得率最高,pH < 5.0时,随pH的增大,多糖提取率随之增大,pH > 5.0后,随pH的增加,多糖得率随之减小,说明纤维素酶的最适pH为5.0。
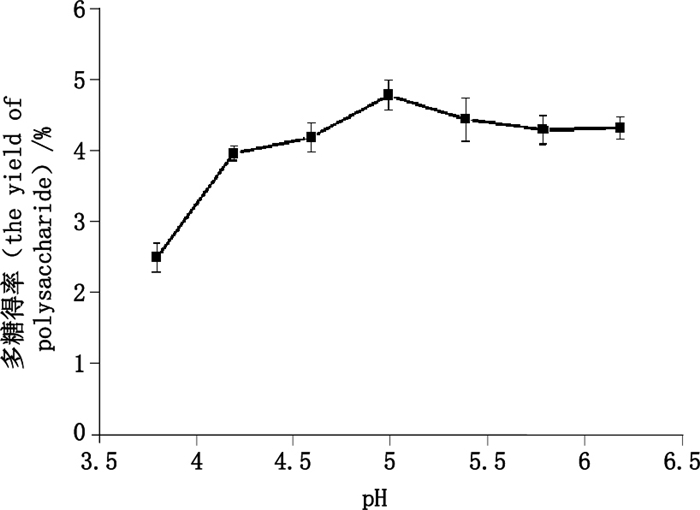
|
图 2 pH对多糖得率的影响 Figure 2 The effect of pH on the yield of polysaccharide |
精密称取巴戟天药材5.0 g,5份,加入pH 5.0磷酸盐缓冲液30 mL,分别于40、45、50、55、60 ℃酶解1 h,其他按照“2.1.3”项下条件提取,测定结果如图 3所示。
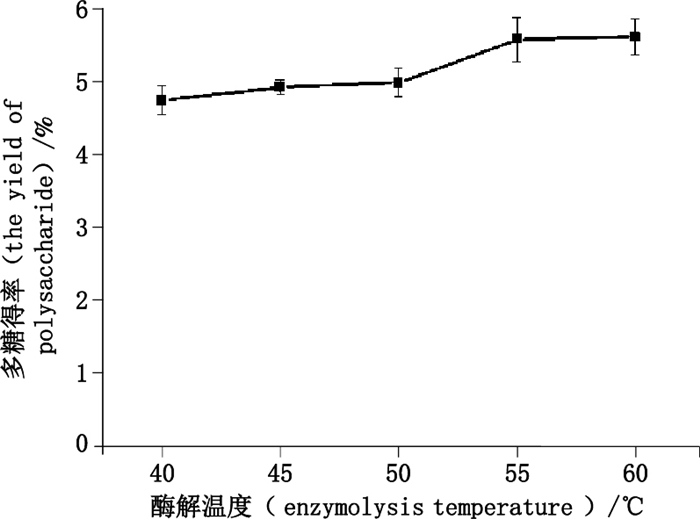
|
图 3 酶解温度对多糖得率的影响 Figure 3 The effect of enzymolysis temperature on the yield of polysa-ccharide |
由图 3可知,随酶解温度的增加,多糖得率随之增加,40~50 ℃时,随酶解温度的增加,多糖得率增加较50~55 ℃缓慢;当温度大于55 ℃时,随温度升高,多糖得率呈下降趋势,故纤维素酶的最适酶解温度为55 ℃。
2.3.3 酶用量的考察精密称取巴戟天药材5.0 g,5份,分别加入0.10%、0.15%、0.20%、0.25%、0.30%的纤维素酶,分别加入pH 5.0磷酸盐缓冲液30 mL,55 ℃酶解1.0 h,其他按照“2.1.3”项下条件提取,测定结果见图 4。
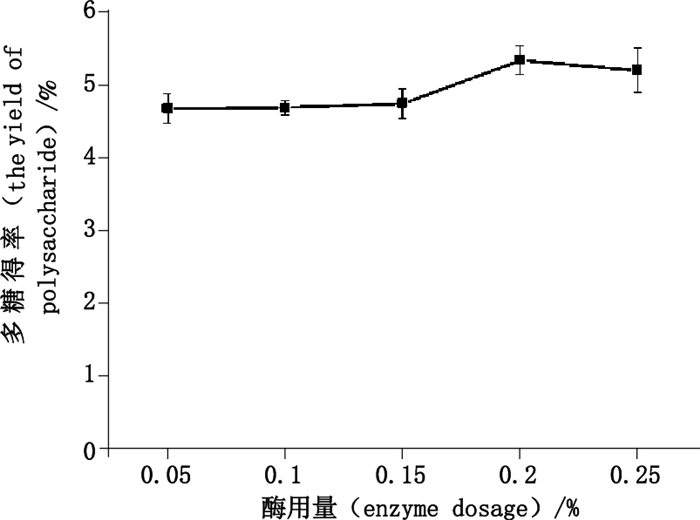
|
图 4 酶用量对多糖得率的影响 Figure 4 The effect of enzyme dosage on the yield of polysaccharide |
由图 4可知,随纤维素酶用量的增加,多糖得率先增加后趋于下降,用量达0.20%时,多糖得率达最大值,故后续试验中纤维素酶用量均为0.20%,且在工艺优选时将其设为酶用量的零水平值。
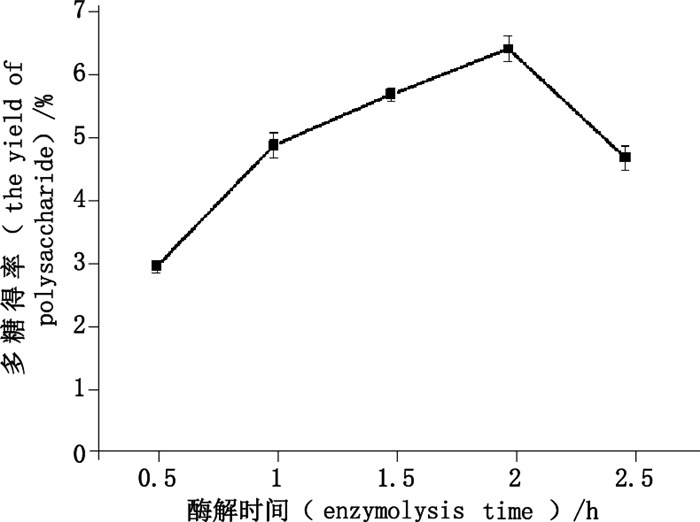
2.3.4 酶解时间的考察精密称取巴戟天药材5.0 g,5份,加入0.20%的纤维素酶,加入pH 5.0的磷酸盐缓冲液30 mL,55 ℃水浴中分别酶解0.50、1.0、1.5、2.0、2.5 h,其他按照“2.1.3”项下条件提取,测定结果见图 5。
|
图 5 酶解时间对多糖得率的影响 Figure 5 The effect of enzymolysis time on the yield of polysaccharide |
由图 5可知,随酶解时间的增加,多糖得率随之呈先升高后降低的趋势,酶解时间为2.0 h时多糖得率达最大。但当酶解时间大于2.0 h,随时间的增加,多糖得率呈降低趋势,故在后续试验中以2.0 h为酶解时间,同时也将其设为工艺优选时酶解时间的零水平值。
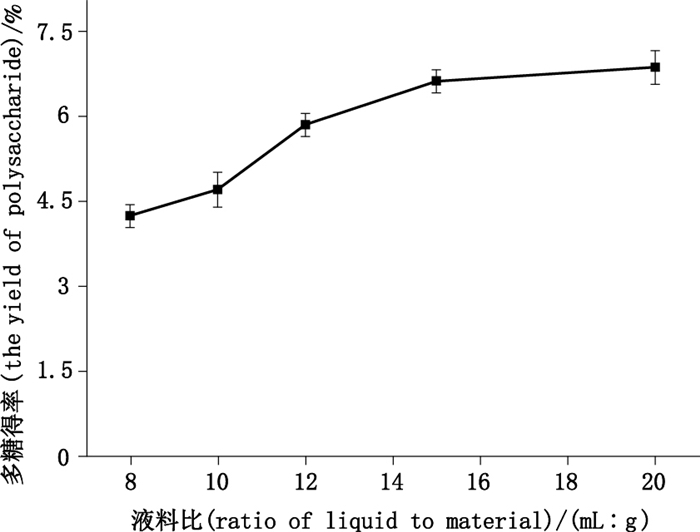
2.3.5 液料比的考察称取巴戟天药材5.0 g,5份,加入0.2%的纤维素酶,加入pH 5.0的磷酸盐缓冲液30 mL,55 ℃水浴中酶解2.0 h后,分别加入10、12、15、20、25倍量水,回流提取,其他按照“2.1.3”项下条件提取,测定结果见图 6。
|
图 6 液料比对多糖得率的影响 Figure 6 The effect of liquid and material ratio on the yield of polysaccharide |
图 6可看出,随液料比的增加,多糖得率随之增加,但液料比为20: 1时,多糖得率的增加趋势逐渐趋于平缓,故在后续试验中以20: 1为液料比,同时也将其作为工艺优选时将其作为液料比的零水平值。
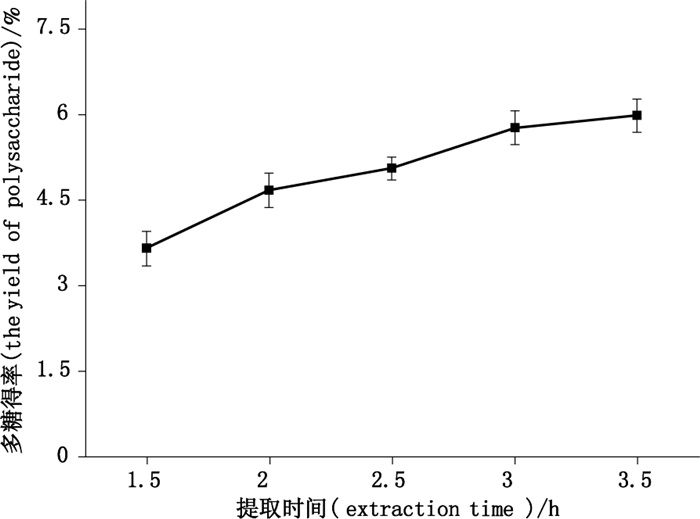
2.3.6 提取时间的考察精密称取巴戟天药材5.0 g,5份,加入0.20%的纤维素酶,加入pH 5.0的磷酸盐缓冲液30 mL,55 ℃水浴中酶解2.0 h后,加入20倍量水,分别提取1.5、2.0、2.5、3.0、3.5 h,提取3次,其他按照“2.1.3”项下条件提取,测定结果见图 7。
|
图 7 提取时间对多糖得率的影响 Figure 7 The effect of extraction time on the yield of polysaccharide |
由图 7可知,随提取时间的增加,多糖得率随之增加,当提取时间达3.5 h时,多糖得率增加趋于平缓,即多糖得率虽有增加,但增加幅度不明显,故在后续工艺优选时,将3.5 h作为提取时间的零水平值。
2.4 酶法辅助提取工艺的优选 2.4.1 数学模型的建立与检验以单因素结果为基础,确定试验因素和水平,采用四元二次通用旋转组合设计,筛选巴戟天多糖及耐斯糖的最佳酶解提取工艺。因素水平见表 1,试验设计及结果见表 2。
|
|
表 1 因素水平表 Table 1 Factor level tablet |
|
|
表 2 二次通用旋转组合试验设计及结果 Table 2 Design and result of two times of universal rotary combination test |
利用DPS软件拟合试验结果,分别得到多糖与耐斯糖二次回归模型:
Y1=5.987 7-0.367 5X1+0.398 7X2+0.027 5X3+0.068 9X4+0.013 6X12+0.102 2X22-0.358 2X32-0.136 2X42+0.282 5X1X2+0.486 1X1X3-0.377 1X1X4+0.803 9X2X3+0.460 9X2X4-0.083 4X3X4;
Y2=0.083 6-0.008 3X1+0.000 3X2+0.003 5X3+0.001 2X4+0.003 5X12+0.002 6X22+0.002 6X32+0.001 7X42+0.007 8X1X2+0.005 0X1X3+0.001 0X1X4+0.006 0X2X3+0.011 0X2X4+0.002 8X3X4
将试验结果进行方差分析,结果见表 3。
|
|
表 3 Y1与Y2方差分析 Table 3 Analysis of Y1 and Y2 variance |
由表 3可知,Y1和Y2回归方程失拟性检验PY1=0.096 3 > 0.05,PY2=0.147 6 > 0.05,失拟性不显著,说明建立的模型合理;显著性检验PY1=0.014 0 < 0.05,PY2=0.037 7 < 0.05回归显著,说明方程预测值与实际值吻合。检验模型中各项系数,剔除α=0.01不显著项后,简化的回归方程分别为
Y1=5.987 7-0.367 5X1+0.398 7X2-0.358 2X32+0.486 1X1X3-0.377 1X1X4+0.803 9X2X3+0.460 9X2X4;
Y2=0.083 6-0.008 3X1+0.003 5X3+0.003 5X12+0.007 8X1X2+0.005 0X1X3+0.006 0X2X3+0.011 0X2X4。
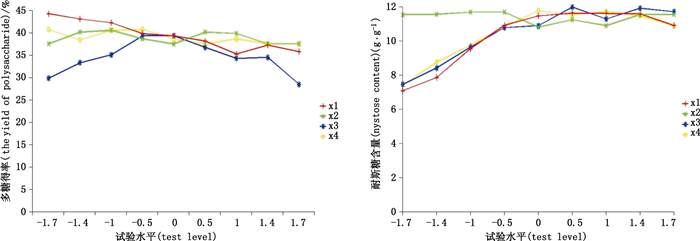
2.4.2 单因子效应分析采用降维分析法,分析各因子单因子效应影响,结果见图 8。
|
图 8 各单因素与多糖(A)及耐斯糖(B)提取率的关系 Figure 8 The relationship between the single factor and the polysaccharide extraction rate(A)and Nisi sugar(B) |
由图 8可知,X4(即酶解时间与提取时间)对Y1及Y2(即多糖及耐斯糖得率)几乎无影响,X2对Y2几乎无影响,随X2的增大Y1随之增大,说明巴戟天多糖得率与酶解时间呈线性相关;而Y1及Y2均随X1 (酶用量)的增加而降低,可能是因为酶用量过大时,底物量不足,未能使纤维素酶达到饱和状态,故而酶的活性受到抑制,底物所含成分不能完全释放于溶媒中。随X3(液料比)的增加,Y1与Y2均随之呈先增大后减小的趋势,可能是因为随着溶媒的增加,底物中其他成分释放增加,而使所需成分溶出受抑制,因此液料比的选择至关重要。
2.4.3 Y2的交互作用分析由表 3可知,X2X3及X2X4交互作用对耐斯糖含量均有显著影响(PY2=0.025 0 < 0.05,PY2=0.014 6 < 0.05),因此对X2X3及X2X4的交互作用进行曲面分析,即固定其中2个因素分析另外2个因素,结果见图 9、图 10。
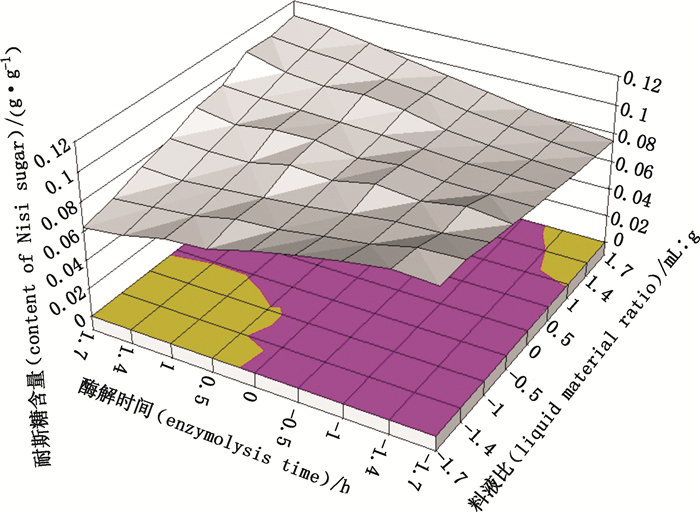
|
图 9 酶解时间(X2)与液料比(X3)的交互作用 Figure 9 Interaction between enzyme hydrolysis time(X2)and liquid material ratio (X3) |
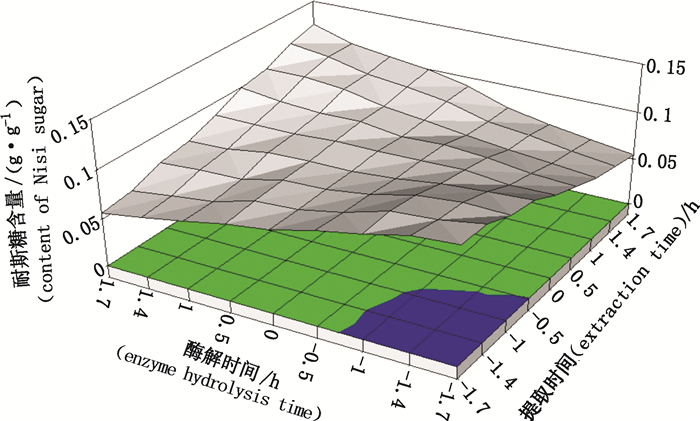
|
图 10 酶解时间(X2)与提取时间(X4)的交互作用 Figure 10 Interaction between enzyme hydrolysis time(X2)and extraction time(X4) |
由图 9可知,在较小的液料比范围内,随酶解时间的延长,耐斯糖提取率降低,可能是因为酶解时间过长,底物中其他成分溶出增加,使得耐斯糖的溶出被抑制或溶出的成分与耐斯糖发生作用,干扰了耐斯糖的含量测定,造成其含量降低;当液料比较高时,随酶解时间的延长,耐斯糖提取率升高,说明耐斯糖在溶媒中的溶出增加,但可以看出液料比的增加对耐斯糖的提取影响不显著,这与表 3中结果一致。
由图 10可知,在较短的提取时间内,随酶解时间的增加,耐斯糖提取率降低;但当提取时间达最大值时,随酶解时间的增加,耐斯糖提取率逐渐增加;而在较短的酶解时间内,随提取时间的增加,耐斯糖提取率呈下降趋势,但当酶解时间达最大值时,随提取时间的增加,耐斯糖提取率逐渐增加;但从图中可看出,在酶解时间与提取时间均达最大值时耐斯糖提取率并未显著高于酶解时间与提取时间均在最低水平时的提取率,故并不能从图 10中确定酶解提取的最优工艺条件。
2.4.4 提取工艺的优化由上述结果并不能确定最优酶解提取工艺条件,因此,本试验采用频率分析法分析回归模型,进而确定最优工艺,见表 4。结合实际操作,分析表 4结果,可知巴戟天酶解提取多糖及耐斯糖的最佳提取工艺为0.18%的纤维素酶,55 ℃酶解2.0 h,20倍量水提取3.5 h,提取3次。
|
|
表 4 巴戟天多糖及耐斯糖相关变量的频率分布 Table 4 The frequency distribution of polysaccharide in Morindae Officinalis Radix and Nisi sugar related variables |
依“2.4.4”项中提取条件,提取5组,依“2.1.4”项及“2.2”项中方法分别检测巴戟天多糖及耐斯糖的含量,多糖平均提取率10.44%(预测值10.13%),耐斯糖平均提取率0.083 g·g-1(预测值0.085 g·g-1),与预测值接近。
3 讨论在单因素试验中,酶解液最适条件为pH 5.0,因为生物酶在过酸或过碱环境中均易变性失活,故后续试验酶解液酸碱环境均设为pH 5.0;而酶解温度选择55 ℃是因为高温会使纤维素酶结构改变,进而失去活性,影响酶解效果,故在后续试验中再没对酶解液酸碱环境和酶解温度进行优化。在考察酶解时间时,多糖得率随酶解时间的增加呈先增加后降低的趋势,可能是因为随酶解时间增加,其他成分溶出增加干扰了多糖的含量测定,从而使多糖得率降低,但其机理仍需进一步研究。
为避免酶辅助提取中药时因酶自身降解或中药材的细胞壁降解,造成多糖含量升高,导致工艺参数的不科学性,本实验在单因素试验基础上,以结构有别于单糖的耐斯糖和巴戟天多糖为指标,采用试验次数少,精度高,适用于较多因素水平的二次通用旋转组合设计优化纤维素酶辅助巴戟天的最佳工艺参数[16],得到最佳工艺参数:纤维素酶用量0.18%、pH 5.0、酶解温度55 ℃、酶解时间2.0 h,加20倍量水提取3.5 h,提取3次。该工艺条件下多糖及耐斯糖提取率分别为10.44%和0.083 g·g-1,而在相同提取条件下,不加纤维素酶,多糖及耐斯糖提取率分别为4.37%和0.041g·g-1,均低于酶解提取工艺得率,说明生物酶辅助提取技术对于开发利用巴戟天资源有效可行。
| [1] |
邓少东, 肖凤霞, 林励, 等. 亲水作用色谱-蒸发光散射检测器联用法同时测定巴戟天中5种低聚糖的含量[J]. 中国中药杂志, 2012, 37(22): 3446. DENG SD, XIAO FX, LIN L, et al. HILIC-ELSD determination of five oligosaccharides contained in Morinda officinalis[J]. China J Chin Mater Med, 2012, 37(22): 3446. |
| [2] |
吴岩斌, 吴建国, 郑丽鋆, 等. 基于炎症细胞模型的巴戟天抗炎活性部位[J]. 福建中医学院学报, 2011, 21(1): 48. WU YB, WU JG, ZHENG LY, et al. Inflammatory cell model of Morinda officinalisanti-inflammatory active site[J]. J Fujian Univ Tradit Chin Med, 2011, 21(1): 48. DOI:10.3969/j.issn.1004-5627.2011.01.015 |
| [3] |
杨曦亮.湖北巴戟天抗衰老化学成分及作用机制的研究[D].武汉: 华中科技大学, 2012 YANG XL.Hubei Morinda Chemical Composition and Mechanism of Anti Aging Studies[D].Wuhan: Huazhong University of Science and Technology, 2012 |
| [4] |
刘霄. 巴戟天多糖的降血糖和抗氧化作用研究[J]. 中药材, 2009, 32(6): 949. LIU X. Hypoglycemic and antioxidant effects of Morinda officinalis polysaccharides[J]. J Chin Med Mater, 2009, 32(6): 949. DOI:10.3321/j.issn:1001-4454.2009.06.039 |
| [5] |
沈英超.巴戟天活性物质的研究[D].南京: 南京林业大学, 2008 SHEN YC.Study on Active Substances of Morinda officinalis[D].Nanjing: Nanjing Forestry University, 2008 |
| [6] |
何传波, 李琳, 汤凤霞, 等. 巴戟天多糖纯化及免疫活性的研究[J]. 食品科技, 2009(8): 167. HE CB, LI L, TANG FX, et al. Study of Morinda Root polysaccharide purification and immunological activity[J]. Food Sci Technol, 2009(8): 167. |
| [7] |
朱孟勇, 赫长胜, 王彩娇. 巴戟天多糖对骨质疏松大鼠骨密度及血清微量元素的影响[J]. 中草药, 2010, 41(9): 1513. ZHU MY, HE CS, WANG CJ. Effects of Morinda officinalis polysaccharides on osteoporosis rat bone density and serum trace elements[J]. Chin Tradit Herb Drugs, 2010, 41(9): 1513. |
| [8] |
崔可赜, 刘亦恒, 张寿, 等. 巴戟天多糖含药血清对体外成骨细胞DKK-1表达的影响[J]. 时珍国医国药, 2012, 23(4): 871. CUI KZ, LIU YH, ZHANG S, et al. The serum containing morinda root polysaccharide osteoblast DKK-1 expression in vitro[J]. Lishizhen Med Mater Med Res, 2012, 23(4): 871. DOI:10.3969/j.issn.1008-0805.2012.04.036 |
| [9] |
章润菁, 李倩, 屈敏红, 等. 不同产地、生长年限和种质的巴戟天药材寡糖含量分析[J]. 中国药学杂志, 2016, 51(4): 315. ZHANG RJ, LI Q, QU MH, et al. Different areas, the growth time and the germplasm of Morinda officinalis medicinal oligosaccharide content analysis of[J]. China Pharm J, 2016, 51(4): 315. |
| [10] |
冯峰, 王羚郦, 赖小平, 等. 巴戟天寡糖研究[J]. 中药材, 2012, 35(8): 1259. FENG F, WANG LL, LAI XP, et al. Study of Morinda officinalis oligosaccharides[J]. J Chin Med Mater, 2012, 35(8): 1259. |
| [11] |
周斌, 崔小弟, 李洁, 等. 高效薄层色谱法同时测定巴戟天中3种寡糖[J]. 中成药, 2013, 35(8): 1717. ZHOU B, CUI XD, LI J, et al. HPTLC method for simultaneous determination of 3 kinds of oligosaccharides in Morinda officinalis[J]. Chin Tradit Pat Med, 2013, 35(8): 1717. DOI:10.3969/j.issn.1001-1528.2013.08.030 |
| [12] |
郑素玉, 陈健. 巴戟天有效成分及其药理作用实验研究进展[J]. 世界中西医结合杂志, 2012, 7(9): 823. ZHENG SY, CHEN J. The progress of the constituents of Morinda officinalis and its pharmacological action research[J]. Word J Integrated Tradit Western Med, 2012, 7(9): 823. DOI:10.3969/j.issn.1673-6613.2012.09.033 |
| [13] |
崔承彬, 杨明, 姚志伟, 等. 中药巴戟天中抗抑郁活性成分的研究[J]. 中国中药杂志, 1995, 20(1): 36. CUI CB, YANG M, YAO ZW, et al. Study on the antidepressant components of Chinese medicine Morinda officinalis in Chinese[J]. China J Chin Mater Med, 1995, 20(1): 36. DOI:10.3321/j.issn:1001-5302.1995.01.003 |
| [14] |
陈选, 周波, 汪周俊, 等. 水酶法制备黄秋葵籽油工艺及其氧化稳定性的研究[J]. 中国油脂, 2016, 41(6): 10. CHEN X, ZHOU B, WANG ZJ, et al. Aqueous enzymatic preparation process and oxidation stability of Okra Seed Oil[J]. China Oils Fats, 2016, 41(6): 10. DOI:10.3969/j.issn.1003-7969.2016.06.003 |
| [15] |
李梦青, 聂媛, 张洁, 等. 酶解法提取虎杖中白藜芦醇、白藜芦醇苷、大黄素[J]. 精细化工, 2008, 25(5): 467. LI MQ, NIE Y, ZHANG J, et al. Enzymatic extraction of resveratrol, resveratrol, and emodin[J]. Fine Chem, 2008, 25(5): 467. DOI:10.3321/j.issn:1003-5214.2008.05.014 |
| [16] |
包旭宏, 王继龙, 魏舒畅, 等. 二次通用旋转组合法优化黄芪中毛蕊异黄酮苷和芒柄花素的酶解提取工艺[J]. 中草药, 2014, 45(18): 2641. BAO XH, WANG JL, WEI SC, et al. Optimization of enzymatic extraction of isoflavone glycosides from astragalus and almanetin in Astragalus by two times general rotation combination method[J]. Chin Tradit Herb Drugs, 2014, 45(18): 2641. DOI:10.7501/j.issn.0253-2670.2014.18.013 |
 2018, Vol. 38
2018, Vol. 38 
