2. 赛默飞世尔科技(中国)有限公司, 上海 201206
2. Thermo Fisher Scientific(China) Co., Ltd., Shanghai 201206, China
硫酸小诺霉素为氨基糖苷类抗生素,由于其抗菌谱较广,对革兰阴性菌和革兰阳性菌的敏感菌均显示抗菌活性,且副作用小,价格低,在临床中被广泛应用[1-2]。
与其他的氨基糖苷类药物相似,硫酸小诺霉素具有强极性、非挥发性且紫外吸收信号不明显等特征,这些特征给氨基糖苷类药物的分析带来了很大的挑战。早期药物分析人员采用对硫酸小诺霉素进行衍生化反应,使其产生紫外吸收,从而进行液相色谱分析。但是衍生化反应效率较低,且存在反应不完全产生副产物而导致结果偏差的可能[3]。《中华人民共和国药典》(简称《中国药典》)2015年版采用蒸发光散射检测器(ELSD)对小诺霉素组分进行分析。尽管蒸发光散射检测器号称为广谱检测器,但是同样存在局限性。首先,蒸发光散射检测器的峰面积与样品进样量不成正比,需要将其换算成对数值再计算线性,这必然导致结果的准确性降低;其次,蒸发光散射需要挥发性物质作为媒介,这就导致流动相可选择性范围很小;除此之外,不同的仪器参数、不同的仪器品牌均能影响蒸发光散射测定结果的重现性。
据文献报道,液相色谱-脉冲安培检测器目前已经成功用于硫酸新霉素[4]、硫酸依替米星[5]、庆大霉素[6-7]、卡那霉素[8]、阿米卡星[9]、盐酸大观霉素[10]等药品的分析中,该检测器有灵敏度高、稳定性好等特点。其中,脉冲安培检测器对硫酸依替米星的分析应用已经收入于《中国药典》2015年版二部中。本文将采用液相色谱-脉冲安培检测器对小诺霉素组分进行分析。
1 仪器和试剂DIONEX ICS-5000+ DP(液相色谱安培检测器)(赛默飞世尔科技有限公司),DIONEX ICS-5000+ DP(安培检测器,赛默飞世尔科技有限公司),MS105型电子天平(METTLER TOLEDO)。水为Millipore超纯水。对照品小诺霉素(批号130342-201404,含量51.8%)、庆大霉素C1a,(批号130515-201603,供系统适用性试验用)和西索米星(批号130635-201301,含量56.0%)由中国食品药品检定研究院提供。三氟乙酸(含量≥99.5%;规格约100 mL;批号432291000)、五氟丙酸(含量100.0%;规格100 mL;批号110728-201506)、氢氧化钠(含量≥96.0%;规格约500 g;批号20110919)、乙腈(色谱纯;规格4 000 mL;批号110710-201619)。硫酸小诺霉素氯化钠注射液6批,江西制药责任有限公司提供,批号分别为170314111、170315111、170316111、170317111、170318111、170319111。
2 方法和结果 2.1 溶液的制备 2.1.1 对照品储备液称取小诺霉素对照品96.20 mg,加超纯水溶解并稀释至50 mL,摇匀,即得。
2.1.2 供试品溶液精密量取本品5 mL,置100 mL量瓶中,加水稀释至刻度,制成每1 mL中约含小诺霉素0.030 mg的溶液,作为供试品溶液,摇匀,即得。
2.2 色谱条件色谱柱:IonpacTMAMGTM(3 μm,4.0 mm×150 mm);以1.25%(v/v)三氟乙酸溶液[含0.025%五氟丙酸,0.85%(v/v)50%氢氧化钠溶液,用0.5 mol·L-1氢氧化钠溶液调节pH至2.6]-乙腈(97.5: 2.5)为流动相;柱温30 ℃;流速0.7 mL·min-1,柱后加0.5 mol·L-1的氢氧化钠溶液冲洗,流速0.3 mL·min-1;进样体积20 μL。
2.3 系统适应性试验取庆大霉素C1a、西索米星、小诺霉素对照品各适量,配成浓度分别为30 μg·mL-1的混合对照品溶液,精密吸取20 μL,注入液相色谱仪,各峰的分离度符合《中国药典》要求。色谱图见图 1。
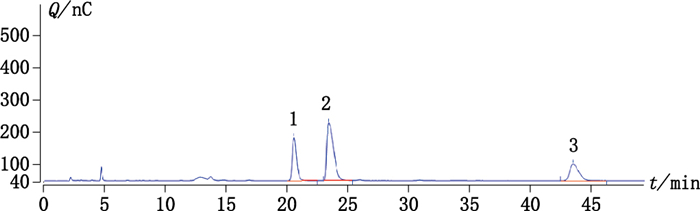
|
1.西索米星(sisomicin) 2.庆大霉素C1a(gentamicin C1a) 3.小诺霉素(micronomicin) 图 1 对照溶液色谱分离图 Figure 1 HPLC chromatogram of standard solutions |
精密吸取对照品储备液1、1.5、2、2.5、3 mL,分别置50 mL量瓶中,加水稀释至刻度,摇匀,配制成小诺霉素质量浓度分别为19.93、29.90、39.86、49.83、59.80 μg·mL-1的溶液。分别精密吸取20 μL,注入液相色谱仪,记录色谱图。以峰面积Y为纵坐标,质量浓度X(μg·mL-1)为横坐标,得回归方程:
Y=1.484X+1.344 r=0.999 6
结果表明,小诺霉素质量浓度在19.93~59.80 μg·mL-1范围内呈良好的线性关系。
2.5 精密度试验取小诺霉素质量浓度为39.86 μg·mL-1的对照品溶液,连续进样6针。以主峰的峰面积计算,得RSD为0.55%(n=6)结果显示精密度良好。
2.6 重复性试验分别精密量取同一批号样品(170314111)6份,按“2.12”项下方法制备供试品溶液,精密吸取20 μL,注入色谱仪,测定峰面积并计算小诺霉素含量。结果小诺霉素的平均含量为0.541 0 mg·mL-1,RSD为1.2%(n=6)重复性试验结果符合要求。
2.7 回收率试验精密量取已知含量样品9份各5 mL,置50 mL量瓶中,再按照80%、100%和120% 3个水平分别精密加入小诺霉素对照品17.51、22.73和26.96 mg,加纯化水稀释至刻度,摇匀。精密吸取20 μL注入液相色谱仪,测得峰面积并计算含量,结果小诺霉素平均回收率分别为99.1%,RSD=0.39%(n=9)。结果表明该方法的准确度较好。
2.8 定量下限取对照品溶液逐步稀释,按上述色谱条件测定,定量下限按S/N=10计算,为5.98 μg·mL-1。
2.9 稳定性试验精密量取本品适量,加水溶解并稀释制成每1 mL中约含小诺霉素0.030 mg的溶液。将供试品溶液放置0、4、8、14、48 h,吸取20 μL注入离子色谱仪,测定小诺霉素组分含量。计算RSD为1.1%。结果表明,供试品溶液48 h内稳定。
2.10 样品测定采用本法测定6批硫酸小诺霉素氯化钠注射液中小诺霉素的含量。取样品,按“2.1.2”项下方法配制供试品溶液。精密吸取20 μL,注入色谱仪,色谱图见图 2。
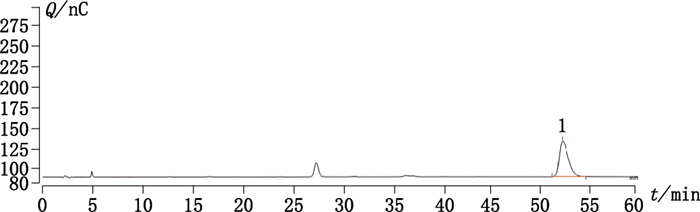
|
1.小诺霉素(micronomicin) 图 2 样品色谱图 Figure 2 Sample chromatogram |
采用《中国药典》2015年版的蒸发光散射检测方法对该6批硫酸小诺霉素氯化钠注射液的小诺霉素组分进行了比较测定。精密量取供试品溶液和对照品溶液各20 μL,注入液相色谱仪,分别计算样品中小诺霉素含量,结果见表 1。
|
|
表 1 6批样品小诺霉素含量测定结果及比较 Table 1 Assay for six batches of samples |
《中国药典》2015年版采用ELSD法对小诺霉素组分进行检测分析。与蒸发光散射相比,液相色谱-脉冲安培具有稳定性好、重复性高、灵敏度强等特点。蒸发光检测检出限约为320 mg·L-1,本文采用的脉冲安培检测方法的定量限为5.98 μg·mL-1,灵敏度得到了很大的提升。用《中国药典》方法测定相同6批样品的小诺霉素组分,与本方法的测定结果进行比较,结果表明,两者无显著差别。脉冲安培检测为小诺霉素含量测定提供了新的检测方法。
| [1] |
张静, 王庆全, 刘绪平. 离子色谱法测定硫酸小诺霉素中硫酸盐的含量[J]. 药物分析杂志, 2012, 32(10): 1845. ZHANG J, WANG QQ, LIU XP. Ion chromatography determination of the sulfate content in micronomicin sulfate[J]. Chin J Pharm Anal, 2012, 32(10): 1845. |
| [2] |
李晖, 康秉学, 贺浪冲. 小诺霉素临床研究进展[J]. 西北药学杂志, 1995, 10(6): 267. LI H, KANG BX, HE LC. Clinical research advances of micronomicin[J]. Northwest Pharm J, 1995, 10(6): 267. |
| [3] |
YUAN YZ, CHOPRA S, DENG XL, et al. Analysis of micronomicin by liquid chromatography with pulsed electrochemical detection[J]. J Chromatogr A, 2013, 1295(5): 90. |
| [4] |
王琰, 王明娟, 姚尚辰, 等. 电化学检测器及其在中美欧药典中的应用与展望[J]. 中国抗生素杂志, 2012, 37(11): 801. WANG Y, WANG MJ, YAO SC, et al. The application and outlook of electrochemical detector(ECD) in the Chinese Pharmacopeia, the US Pharmacopeia and the European Pharmacopeia[J]. Chin J Antibiot, 2012, 37(11): 801. DOI:10.3969/j.issn.1001-8689.2012.11.001 |
| [5] |
中华人民共和国药典2015年版.二部S].2015: 1310 ChP 2015.Vol Ⅱ[S].2015: 1310 |
| [6] |
秦峰, 赵敬丹, 刘浩, 等. 庆大霉素中C组分含量及有关物质的HPLC-PAD法测定[J]. 中国医药工业杂志, 2015, 46(2): 193. QIN F, ZHAO JD, LIU H, et al. Determination of gentamicin C and related substances by HPLC-PAD[J]. Chin J Pharm, 2015, 46(2): 193. |
| [7] |
习玲玲, 朱岩. 反相离子对色谱-脉冲安培电化学测定硫酸庆大霉素中各组分含量[J]. 分析化学, 2006, 34(12): 1763. XI LL, ZHU Y. Analysis of gentamicin sulfate by liquid chromatography with pulsed amperometric detection[J]. Chin J Anal Chem, 2006, 34(12): 1763. DOI:10.3321/j.issn:0253-3820.2006.12.023 |
| [8] |
习玲玲, 朱岩. 液相色谱-脉冲安培电化学法测定硫酸卡那霉素中各组分含量[J]. 分析化学, 2007, 35(5): 703. XI LL, ZHU Y. Determination of kanamycin sulfate by liquid chromatography with plused amperometric detection[J]. Chin J Anal Chem, 2007, 35(5): 703. DOI:10.3321/j.issn:0253-3820.2007.05.019 |
| [9] |
习玲玲, 潘向阳, 张嘉捷. 液相色谱-脉冲安培电化学法测定硫酸阿米卡星注射液中主要组分和杂质[J]. 浙江大学学报(理学版), 2008, 35(5): 557. XI LL, PAN XY, ZHANG JJ. Analysis of amikacin sulfate injection by liquid chromatography with plused amperometric detection[J]. J Zhejiang Univ(Sci Ed), 2008, 35(5): 557. DOI:10.3785/j.issn.1008-9497.2008.05.019 |
| [10] |
王琰, 姚尚辰, 王明娟, 等. HPLC-PAD法测定盐酸大观霉素含量及有关物质[J]. 中国抗生素杂志, 2014, 39(6): 439. WANG Y, YAO SC, WANG MJ, et al. Determination of spectinomycin and related substances by HPLC-PAD[J]. Chin J Antibiot, 2014, 39(6): 439. DOI:10.3969/j.issn.1001-8689.2014.06.008 |
 2018, Vol. 38
2018, Vol. 38 
