疏风散热胶囊是在银翘散的基础上加工制成的中药胶囊[1],现行标准收载于《中华人民共和国卫生部药品标准中药成方制剂》第十二册,具有清热解毒,疏风散热的功效,临床上用于风热感冒,发热头痛,咳嗽口干,咽喉疼痛。本研究以提高疏风散热胶囊质量评价标准为目的,以获得有效控制疏风散热胶囊质量的方法,为风热感冒病人提供更安全、有效的药物。
疏风散热胶囊由金银花、连翘、忍冬藤、桔梗、薄荷、牛蒡子、地黄、淡竹叶、荆芥、栀子、淡豆豉和甘草共12味中药组成[2],金银花、连翘、忍冬藤为君药,薄荷、牛蒡子、荆芥穗、淡豆豉为臣药,淡竹叶、栀子、地黄、桔梗为佐药,甘草是属佐使之用[3]。通过分析组方中各味药材的化学成分[4-15],笔者以高效液相色谱法,在同一色谱条件下测定疏风散热胶囊中栀子苷、马钱苷、甘草苷、连翘苷和牛蒡苷的含量,为该制剂的质量控制提供参考。
1 仪器与试药Waters 2695高效液相色谱仪;Mettler AE200万分之一电子分析天平;Mettler XP26百万分之一电子分析天平;AS7240BT超声波清洗器(天津奥特赛恩斯仪器有限公司);元素1810A超纯水器(上海摩勒科技有限公司)。
对照品栀子苷(批号110749-201617,含量:98.4%)、马钱苷(批号111640-200604,含量:100%)、甘草苷(批号111610-201005,含量:94.9%)、连翘苷(批号110821-200711,含量:98.9%)和牛蒡苷(批号110819-201611,含量:95.9%),均来自中国食品药品检定研究院;疏风散热胶囊(批号150302、150303、150304、150305、160801、160802、160401、160404、160406,规格:0.25 g,黑龙江省济仁药业有限公司;批号:20150601,规格:0.25 g,贵州民族药业股份有限公司);乙腈(色谱纯,J & K Scientific Ltd.公司);水(纯水),其他试剂(分析纯,成都市科龙化工试剂厂)。
2 方法与结果 2.1 色谱条件采用Zorbax SB-Aq C18色谱柱(4.6 mm×250 mm,5 μm,十八烷基硅烷键合硅胶为填充剂,Agilent公司);以乙腈(A)-0.2%磷酸水溶液(B)为流动相,梯度洗脱(0~15 min,10%A;15~20 min,10%A→20%A;20~25 min,20%A;25~30 min,20%A→25%A;30~35 min,25%A;35~40 min,25%A→10%A);流速:1.0 mL·min-1;检测波长:0~32 min为237 nm,32~50 min为228 nm;进样量:20μL,柱温:40 ℃。
2.2 溶液制备 2.2.1 混合对照品溶液精密称取对照品栀子苷11.18 mg、马钱苷11.06 mg、甘草苷11.80 mg、连翘苷11.14 mg和牛蒡苷10.91 mg,分别置于10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成各对照品储备液。精密吸取各储备液,栀子苷1 mL、马钱苷0.25 mL、甘草苷0.25 mL、连翘苷0.25 mL、牛蒡苷4 mL,置同一10 mL量瓶中,加甲醇定容至刻度,摇匀,即得含栀子苷100.0 μg·mL-1、马钱苷27.65 μg·mL-1、甘草苷28.00 μg·mL-1、连翘苷27.54 μg·mL-1、牛蒡苷418.5 μg·mL-1的混合对照品溶液。
2.2.2 供试品溶液将本品内容物混匀,取约0.25 g,精密称定,置100 mL锥形瓶中,精密加入甲醇20 mL,精密称定,超声处理(功率250 W,频率40 kHz)30 min,取出放冷后,用甲醇补足减失的量,摇匀,滤过,精密量取续滤液10 mL,蒸至近干,加中性氧化铝1 g拌匀,加在中性氧化铝柱(100~200目,3 g,内径为1.5 cm)上,用70%乙醇水80 mL洗脱,收集洗脱液,浓缩至干,残渣用50%甲醇水溶解,转移至10 mL量瓶中,并稀释至刻度,摇匀,以0.45 μm滤膜过滤,取续滤液,作为供试品溶液。
2.2.3 阴性样品溶液按疏风散热胶囊制备工艺分别制成缺栀子、缺忍冬藤、缺甘草、缺连翘和缺牛蒡子的5种阴性样品,按“2.2.2”项下方法分别制得各阴性样品溶液。
2.3 专属性试验取混合对照品溶液、供试品溶液及阴性样品溶液各20 μL,在上述色谱条件下进行测定,记录色谱图。结果阴性样品溶液在与混合对照品溶液相同的保留时间位置上无色谱峰出现,见图 1。
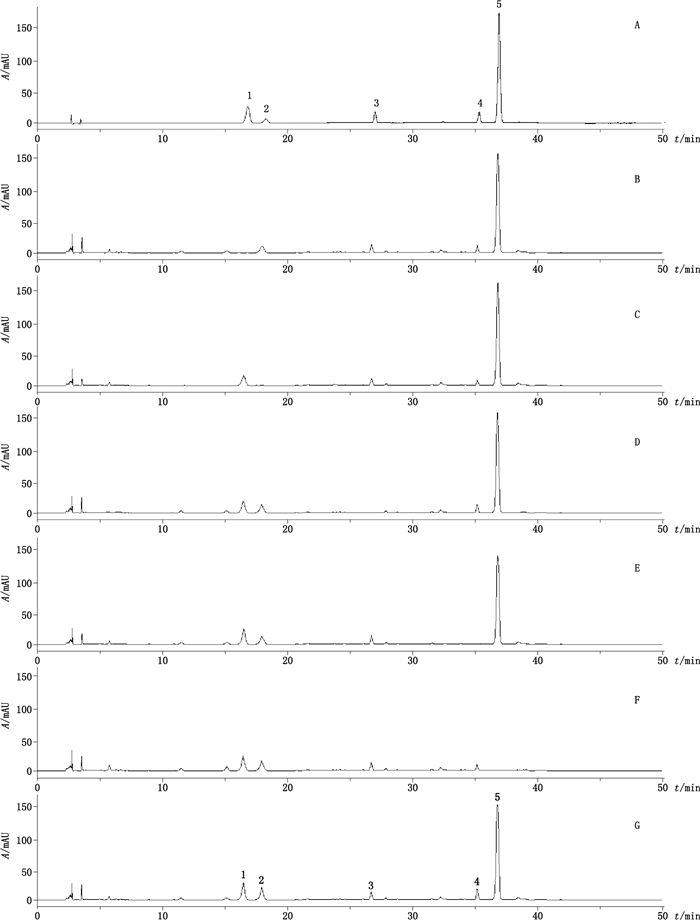
|
1.栀子苷(geniposide) 2.马钱苷(loganin) 3.甘草苷(liquiritin) 4.连翘苷(forsythin) 5.牛蒡苷(arctiin) A.对照品(reference substances) B.缺栀子阴性样品(negative sample without Gardeniae Fructus) C.缺忍冬藤阴性样品(negative sample without Lonicerae Japonicae Caulis) D.缺甘草阴性样品(negative sample without Glycyrrhizae Radix Et Rhizoma) E.缺连翘阴性样品(negative sample without Forsythiae Fructus) F.缺牛蒡子阴性样品(negative sample without Arctii Fructus) G.样品(sample) 图 1 疏风散热胶囊中5个化合物的HPLC色谱图 Figure 1 HPLC chromatograms of 5 compounds in sufengsanre capsules |
分别精密吸取混合对照品溶液1、4、10、20、40 μL进样,测定其峰面积。以进样量X(μg)为横坐标,峰面积Y为纵坐标进行线性回归,得疏风散热胶囊中5个化合物的标准曲线方程、相关系数及线性范围。取混合对照品溶液逐步稀释并分析,以10倍信噪比计算各指标成分的定量下限。结果见表 1。表明各化合物进样量和峰面积线性关系良好。
|
|
表 1 回归方程及线性范围 Table 1 Regression equations and linear ranges |
精密吸取混合对照品溶液20μL,按“2.1”项下色谱条件连续进样6次,测定各指标成分峰面积,计算其精密度,栀子苷、马钱苷、甘草苷、连翘苷和牛蒡苷峰面积的RSD分别为0.21%、0.34%、0.32%、0.68%和0.13%,结果表明该仪器精密度良好。
2.6 稳定性试验取同一份供试品溶液(批号160406),分别于0、2、4、6、8、12h进样测定,结果供试品中栀子苷、马钱苷、甘草苷、连翘苷和牛蒡苷峰面积的RSD分别为0.29%、0.27%、0.53%、0.99%和0.40%,表明供试品溶液在12 h内基本稳定。
2.7 重复性试验取同一批号疏风散热胶囊(批号160406)内容物适量,按“2.2.2”项下方法平行制备6份供试品溶液进行测定,结果供试品中栀子苷、马钱苷、甘草苷、连翘苷和牛蒡苷的含量平均值(n=6)分别为0.51、0.39、0.13、0.08、3.33 mg·粒-1,RSD分别为0.68%、0.77%、0.82%、0.56%、0.79%。结果表明该方法重复性良好。
2.8 加样回收率试验精密称取已知含量的样品约0.12 g,共9份,分别精密加入一定量的栀子苷、马钱苷、甘草苷、连翘苷和牛蒡苷对照品,按“2.2.2”项下方法制备溶液,每个浓度制备3份,按“2.1”项下色谱条件进样测定,结果见表 2。
|
|
表 2 回收率试验结果(n=3) Table 2 Results of recovery |
按“2.2.2”项下方法制备10批样品的供试品溶液各2份。精密吸取各供试品溶液20μL,按“2.1”项下色谱条件进样测定,将峰面积代入线性回归方程进行计算,结果见表 3。
|
|
表 3 样品中5个化合物的含量(n=2,mg·粒-1) Table 3 Contents of 5 compounds(n=2, mg per capsule) |
实验考察的5个化合物,连翘苷、马钱苷、牛蒡苷、栀子苷、甘草苷分别为连翘、忍冬藤、牛蒡子、栀子、甘草的指标性成分[16],基本覆盖了疏风散热胶囊组方中的君臣佐使,能较为全面地反映疏风散热胶囊的质量。
3.2 提取方法的选择疏风散热胶囊组方包含了12味药材,成分相对复杂,简单的甲醇提取所含成分较多,无法用液相色谱完全分离。笔者尝试了甲醇提取后蒸干,用水溶解,再用水饱和正丁醇萃取和甲醇提取后过中性氧化铝柱,用70%乙醇水洗脱2种纯化方法,结果后者更为有效且相对简便,重现性也更好。
3.3 检测波长的选择考察了5个化合物的紫外吸收光谱,结合《中华人民共和国药典》2015年版一部中对应各成分的检测波长和相应成分在本实验洗脱程序上的保留时间,最终确定0~32 min选择237 nm作为检测波长,32~50 min选择228 nm作为检测波长。仅做1次波长转变,就能使5种目标化合物基本都在最大吸收处检测。
3.4 提取方法的优化供试品提取方法中有提取溶剂用量、超声时间和洗脱液用量3个因素明显影响目标成分的提取效果,故以正交试验的方法,比较了以上3个因素在3个水平下对目标成分的提取效果。结果表明,以甲醇20 mL,超声30 min,过柱,用70%乙醇水洗脱收集80 mL即可基本完全提取目标成分。
3.5 样品结果分析比较了2个厂家10个不同批次的的样品后发现,上述5个化合物在不同批次中差异较大,分析原因认为最大可能是不同批次原料药的差异造成。
| [1] |
贵州省药品标准[S].1989: 98 Guizhou Drug Standards[S].1989: 98 |
| [2] |
卫生部药品标准中药成方制剂第12册[S].1997: 161 Drug Specifications Promulgated by Ministry of Public Health, P. R. China. Prescription of Chinese Patent Medicine Vol 12[S].1997: 161 |
| [3] |
邓中甲. 方剂学[M]. 北京: 中国中医药出版社, 2003: 28. DENG ZJ. Pharmacology of Traditional Chinese Medical Formulae[M]. Beijing: Chinese Medicine Press, 2003: 28. |
| [4] |
王亚丹, 杨建波, 戴忠, 等. 中药金银花的研究进展[J]. 药物分析杂志, 2014, 34(11): 1928. WANG YD, YANG JB, DAI Z, et al. Research progress on Lonicerae Japonicae Flos[J]. Chin J Pharm Anal, 2014, 34(11): 1928. |
| [5] |
胡静, 马琳, 常艳旭. 连翘的研究进展[J]. 中南药学, 2012, 10(10): 760. HU J, MA L, CHANG YX. Research progress on Forsythiae Fructus[J]. Cent South Pharm, 2012, 10(10): 760. |
| [6] |
张聪, 殷志琦, 叶文才, 等. 忍冬藤的化学成分研究[J]. 中国中药杂志, 2009(12): 3051. ZHANG C, YIN ZQ, YE WC, et al. Study on chemical composition of Lonicerae Japonicae Caulis[J]. China J Chin Mat Med, 2009(12): 3051. |
| [7] |
郭丽, 张村, 李丽, 等. 中药桔梗的研究进展[J]. 中国中药杂志, 2007, 52(3): 181. GUO L, ZHANG C, LI L, et al. Research progress on Chinese herb Platycodonis Radix[J]. China J Chin Mat Med, 2007, 52(3): 181. DOI:10.3321/j.issn:1001-5302.2007.03.001 |
| [8] |
李祥, 邢文峰. 薄荷的化学成分及临床应用研究进展[J]. 中南药学, 2011, 5(9): 362. LI X, XING WF. Research progress on chemical composition and clinical application of Menthae Haplocalycis Herba[J]. Cent South Pharm, 2011, 5(9): 362. |
| [9] |
李卓恒, 于彩平, 管海燕, 等. 牛蒡子化学成分的分离与鉴定[J]. 中国药房, 2012, 23(39): 3696. LI ZH, YU CP, GUAN HY, et al. Separation and identification of chemical constituents of Arctium lappa[J]. China Pharm, 2012, 23(39): 3696. DOI:10.6039/j.issn.1001-0408.2012.39.17 |
| [10] |
李红伟, 孟祥乐. 地黄化学成分及其药理作用研究进展[J]. 药物评价研究, 2015, 38(2): 218. LI HW, MENG XL. Research progress on chemical constituents and pharmacological activities of Rehmannia glutinosa[J]. Drug Eval Res, 2015, 38(2): 218. |
| [11] |
陈烨. 淡竹叶化学成分与药理作用研究进展[J]. 亚太传统医药, 2014, 10(13): 50. CHEN Y. Review on research of the chemical constiuents and pharmacological activities of Lophatherum Gracile Brongn[J]. Asia-Pac Tradit Med, 2014, 10(13): 50. |
| [12] |
赵立子, 魏建和. 中药荆芥最新研究进展[J]. 中国农学通报, 2013, 29(4): 39. ZHAO LZ, WEI JH. Latest research and development of Schizonepeta tenuifolia Briq[J]. Chin Agr Sci Bull, 2013, 29(4): 39. DOI:10.3969/j.issn.1000-6850.2013.04.010 |
| [13] |
孟祥乐, 李红伟, 李颜, 等. 栀子化学成分及其药理作用研究进展[J]. 中国新药杂志, 2011, 20(11): 959. MENG XL, LI HW, LI Y, et al. Advances in studies on chemical constituents and pharmacological activities of Gardenia jasminoides[J]. Chin J New Drugs, 2011, 20(11): 959. |
| [14] |
张景, 冯亭亭, 张明柱. UPLC同时测定淡豆豉中6种异黄酮的含量[J]. 中药材, 2016, 39(11): 2566. ZHANG J, FENG TT, ZHANG MZ. UPLC simultaneous determination of 6 kinds of isoflavone in Glycine max[J]. J Chin Med Mater, 2016, 39(11): 2566. |
| [15] |
刘育辰, 陈有根, 王丹, 等. 甘草化学成分研究[J]. 药物分析杂志, 2011, 31(7): 1251. LIU YC, CHEN YG, WANG D, et al. Studies on chemical constituents on roots of Glycyrrhiza Uralensis[J]. Chin J Pharm Anal, 2011, 31(7): 1251. |
| [16] |
中华人民共和国药典2015年版.一部[S].2015: 72, 86, 170, 193, 248
|
 2018, Vol. 38
2018, Vol. 38 