2. 湖北中医药大学药学院, 武汉 430065
2. College of Pharmacy, Hubei University of Chinese Medicine, Wuhan 430065, China
贝母是我国传统中药材,药用历史悠久,早在《神农本草经》就有记载,具清热润肺、止咳化痰的功效[1]。传统上,中医将贝母分为“川贝”、“浙贝”两类,但随着长期实践及深入研究,《中华人民共和国药典》(简称《中国药典》)2015年版将收载的贝母分为五类,即川贝母、平贝母、伊贝母、浙贝母和湖北贝母,涉及贝母属植物川贝母、暗紫贝母、甘肃贝母、梭砂贝母、太白贝母、瓦布贝母、平贝母、新疆贝母、伊犁贝母及湖北贝母。由于贝母种类繁多,分布广泛,不同植物形态相似,且同种植物生境不同,形态变化大,所以难以鉴别[2-3]。
在贝母类药材中,川贝母疗效好且毒副作用小[4-5],但资源短缺且价格高[6],药材市场常以次充好,以假乱真,同属近缘物种充当川贝母的现象非常普遍,利用DNA条形码鉴定技术对市场流通药材抽样调查发现川贝母伪品率达20%。Wang等依据川贝母ITS1特异区“CCCGGG”及非川贝对应区“CTCGGG”,使用聚合酶链式反应-限制性片段长度多态性法(PCR-RFLP)实现了川贝母的鉴别[7-8],该方法收录于《中国药典》2015年版并规定川贝母在100~250 base-pairs处应有2条DNA条带,为川贝母真伪鉴别提供了有效技术手段。而此方法的不足在于取样难以均一,整体磨粉混合后掺伪50%仍能得到阳性结果[9]。而电泳条带灰度在掺伪情况判断上具一定潜力,但易受酶切程度、电泳状态、曝光强度等影响[9],在实际操作上具有一定难度,且川贝母与其近缘物种序列相似度极高,在混合样中易形成杂合双链造成偏差。因此,如何行之有效的检出川贝母掺伪已然是川贝母检验工作的难点。
近年发展起来的一种高灵敏核酸检测技术,多重连接探针扩增(MLPA)技术[10],杂交、连接及PCR扩增相结合实现了靶分子高效特异性分析。该方法核心在于用连接酶将与靶序列杂交的长探针和短探针连接成含通用引物的全长探针,每个探针扩增产物的长度唯一,可通过毛细管电泳分离[11]。在单一反应管内可同时实现多达40个靶序列的检测,通量高,操作简便,结果准确[10],近年来在遗传疾病、病原体等方面基因检测工作中已得到大量研究和应用[12-17]。本研究拟利用MLPA技术特异、敏感和多重检测等优势,建立同时检测川贝母及其近缘掺伪品的方法,探讨其在中药材掺伪检测中的应用潜力。
1 材料与方法 1.1 材料本研究所用实验材料中,川贝母(批号121000-201609)、湖北贝母(批号120962-201005)、伊贝母(批号121739-201701)、浙贝母(批号120972-201405)及平贝母(批号120924-201711)的对照药材购自中国食品药品检定研究院,贝母类商品药材为湖北市场流通中药材抽样。MLPA探针由生工生物工程(上海)股份有限公司合成,SALSA MLPA EK1试剂盒购自荷兰MRC Holland公司,植物基因组DNA提取试剂盒购自天根生化科技(北京)有限公司。
1.2 方法 1.2.1 探针设计及合成从NCBI数据库中获得药材川贝母基原川贝母(Fritillaria cirrhosa)、梭砂贝母(F. delavayi)、暗紫贝母(F. unibiacteata)、甘肃贝母(F. przewalskii)、太白贝母(F. taipaiensis)、瓦布贝母(F. wabuensis),平贝母基原平贝母(F. ussuriensis),伊贝母基原新疆贝母(F. walujewii)、伊犁贝母(F. pallidiflora)及湖北贝母基原湖北贝母(F. hupehensis)的ITS1序列,在其特异性识别区(CCCGGG/CTCGGG)上下游各截取40 base-pairs,利用Perl脚本程序剔除冗余序列,以各单倍型序列为模板,使用Primer 3(http://primer3.ut.ee/)设计对应MLPA探针对,UseUNAfold(http://unafold.rna.albany.edu/?q=mfold)评价探针质量,探针采用HPLC纯化,右侧探针(RPO)进行5’段磷酸化处理,每个探针的储藏浓度是10 μmol·L-1,用时稀释成工作浓度为1 μmol·L-1,探针信息见表 1。扩增引物使用试剂盒自带引物。
|
|
表 1 MPLA杂交探针序列 Table 1 HybProbe sequences for MPLA analysis |
按图 1比例混合川贝母及同属贝母类(伊贝母、平贝母、湖北贝母及浙贝母)对照药材,用球磨仪磨成极细粉末制备成掺混样品,涉及掺伪90%、70%、50%、30%、10%、3%、1%及4种非贝母类药材各10%和5%,共9组30份。分别称取对照药材、掺混样品及药材样品粉末约30 mg,照植物基因组DNA提取试剂盒说明书标准操作流程进行操作,使用超微量分光光度计进行DNA含量测定和质量评估。

|
图 1 川贝母与伊贝母、平贝母、湖北贝母及浙贝母对照药材掺混比例图 Figure 1 Referenle crude drugs mixing proportion diagram of F. Cirrhosae Bulbus, F. Ussuriensis Bulbus, F. Pallidiflorae Bulbus, F. Thunbergii Bulbus and F. Hupehensis Bulbus |
主要步骤按MLPA试剂盒说明书进行,具体如下:取样品DNA(20~30 ng·μL-1)5 μL置PCR扩增仪(Bio-Rad T100)中98 ℃变性15 min,冷却至25 ℃,加入3 μL杂交混合液(1.5 μL探针+1.5 μL MLPA缓冲液),95 ℃ 1 min,63 ℃孵育16 h;冷却至54 ℃后,加入Ligase-65连接酶反应体系,54 ℃ 15 min,98 ℃ 5 min;冷却至20 ℃后加入PCR反应混合液,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s,循环35次,72 ℃ 20 min,川贝母扩增长度99 base-pairs,非川贝母扩增长度116 base-pairs。每个反应重复进行3次。
取PCR产物1 μL、LIZ500 0.2 μL和去离子甲酰胺9 μL混合,在ABI 3730基因分析仪上进行毛细管电泳检测,该部分委托武汉擎科创新生物科技有限公司完成。使用GeneMarker V2.4.0软件分析MLPA实验图谱,得出目的扩增产物的峰高、峰面积、片段长度等参数。
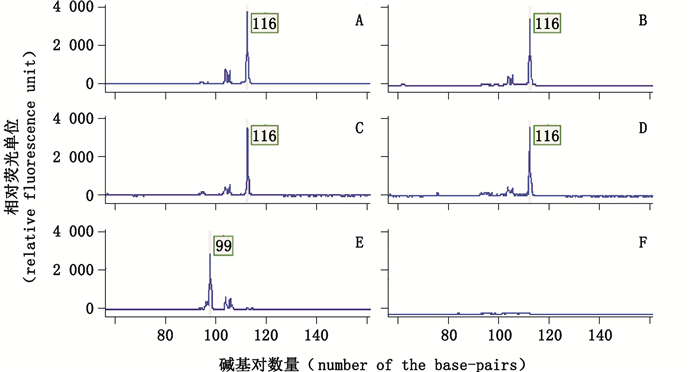
2 结果与分析 2.1 探针特异性分析将表 1中所列探针按照MLPA扩增反应要求制备成混合探针,分别以川贝母、伊贝母、平贝母、湖北贝母及浙贝母对照药材提取的DNA为模板进行MLPA扩增,从图 2中可以看出,从伊贝母、平贝母、湖北贝母及浙贝母中扩增出的目的扩增峰大小约为116 base-pairs(图 2-A~D),从川贝母中扩增出的目的扩增峰大小约为99 base-pairs(图 2-E),从无模板空白对照中没有扩增出任何目的扩增峰(图 2-F)。
|
A.伊贝母(F.Pallidiflorae Bulbus)B.平贝母(F.Ussuriensis Bulbus)C.湖北贝母(F.Hupehensis Bulbus)D.浙贝母(F.Thunbergii Bulbus)E.川贝母(F.Cirrhosae Bulbus);F.空白对照(blank control) 图 2 MLPA混合探针扩增单一贝母类对照药材的特异性图谱 Figure 2 Specific MLPA amplification graphs for the single control Fritillariae materials |
探针特异性分析结果说明,本研究所设计的MLPA探针及对应的反应体系具有较好的特异性,川贝母对应的MPLA探针组只能从川贝母对照药材中扩增出目的扩增峰(99 base-pairs),非川贝母对应的MPLA探针组只能从非川贝母对照药材中扩增出目的扩增峰(116 base-pairs)。
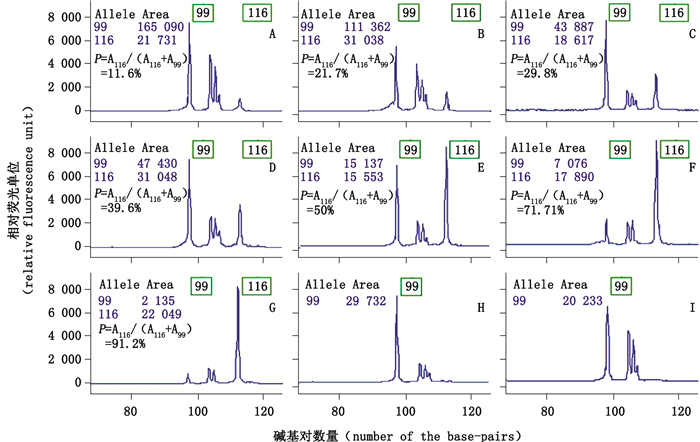
2.2 敏感性分析按图 1所示比例混合川贝母及伊贝母、平贝母、湖北贝母和浙贝母对照药材,共制备掺混样品30份涉及9个掺伪比例梯度,分别以从各掺混样品中提取的DNA为模板进行MLPA扩增,评价掺伪检测敏感性。从检测结果可以看出,分别将伊贝母、平贝母、湖北贝母和浙贝母对照药材按照10%、30%、50%、70%、90%的比例掺混川贝母对照药材,均能检测到目的扩增峰,且峰面积比例与掺伪比例基本一致,如图 3所示,当样品掺伪10%时,非川贝目的扩增峰的峰面积比例为11.6%(图 3-A);掺伪30%时,计算结果为29.8%(图 3-C);掺伪50%时,MLPA实验结果为50.6%(图 3-E);掺伪70%,峰面积比值是71.7%(图 3-F);掺伪90%,实验结果比值为91.2%(图 3-G)。掺杂伊贝母、平贝母、湖北贝母和浙贝母各5%和10%时,得到的非川贝目的扩增峰比例分别是21.7%(图 3-B)和39.6%(图 3-D),但掺伪3%和1%时,并不能检测到可信的掺伪品目的扩增峰(图 3-H~I)。在所有的MLPA实验图谱中,在约104 base-pairs和105 base-pairs的位置上都发现存在非目的扩增峰(图 3),但并不影响结果的判断。
|
A.掺混比例10%样品(samples with 10% adulteration)B.掺混伊贝母、平贝母、湖北贝母和浙贝母各5%样品(samples adulterated with each 5% of F.Ussuriensis Bulbus,F.Pallidiflorae Bulbus,F.Thunbergii Bulbus and F.Hupehensis Bulbus)C.掺混比例30%样品(samples with 30% adulteration)D.掺混伊贝母、平贝母、湖北贝母和浙贝母各10%样品(samples adulterated with each 10% of F.Ussuriensis Bulbus,F.Pallidiflorae Bulbus,F.Thunbergii Bulbus and F.Hupehensis Bulbus)E.掺混比例50%样品(samples with 50% adulteration)F.掺混比例70%样品(samples with 70% adulteration)G.掺混比例90%样品(samples with 90% adulteration)H.掺混比例3%样品(samples with 3% adulteration)I掺混比例1%样品(samples with 1% adulteration) 图 3 MLPA混合探针扩增贝母类对照药材掺混样品的特异性图谱 Figure 3 Specific MLPA amplification graphs for the mixed Fritillariae samples |
敏感性分析实验结果说明,本研究基于MLPA技术所设计的川贝母掺伪检测方法具较高的敏感性,以不同比例的伊贝母、平贝母、湖北贝母和浙贝母掺杂川贝母,发现最低检测限度可达到掺伪10%,且根据目的扩增峰面积比还可较准确的判断出掺伪比例。
2.3 适用性分析市场收集的伊贝母、平贝母、湖北贝母和浙贝母药材各6份,经PCR-RFLP验证的川贝母药材72份,共96份贝母类药材样品用于评估MLPA技术检测川贝母掺伪适用性分析。所检测的24份非川贝母药材(伊贝母、平贝母、湖北贝母和浙贝母)均只能检测到大小约为116 base-pairs的目的扩增峰,72份川贝母样品中发现有34份样品存在掺伪,掺伪比例10%~15%的样品2份,16%~20%的样品5份,21%~25%的样品6份,26%~30%的样品8份,31%~35%的样品5份,36%~40%的样品3份,41%~45%的样品3份,46%以上的样品2份。
适用性分析结果表明该方法可有效检出川贝母药材掺伪及评估其掺伪比例情况,弥补PCR-RFLP法在掺伪检测中的不足。
3 讨论本研究基于MLPA技术建立了一种可有效检出川贝母药材掺伪的检测方法。方法特异性分析结果表明每组探针只能从对应的模板中扩增出预期大小的目的片段,MLPA反应特异性取决于探针,探针与目的序列间仅有1个碱基差异也可导致反应无法继续,探针的高度特异决定了MLPA技术的强特异性,在本研究中,针对不同药材均只能扩增出单一的扩增峰(图 2),且相互之间没有干扰,特异性很好。按照不同比例(图 1)将伊贝母、平贝母、湖北贝母和浙贝母对照药材掺混川贝母,检测下限达到掺伪10%,《中国药典》2015年版药材及饮片检定通则规定药屑杂质通常不得过3%,且根据实际操作情况,检测下限10%符合实际检测需求。
本研究扩增的目的片段大小约为99 base-pairs和116 base-pairs,包含了通用扩增引物序列和填充序列,实际参与反应的模板序列仅57 base-pairs和74 base-pairs,可满足在川贝母、梭砂贝母、暗紫贝母、甘肃贝母、太白贝母和瓦布贝母及平贝母、新疆贝母、伊犁贝母和湖北贝母间找到保守序列设计探针。贝母类药材常经过硫熏处理导致DNA降解严重,DNA提取质量低,本研究中扩增的贝母类药材模板序列仅几十个碱基对,对药材DNA的完整性要求大幅降低,避免了因核酸提取效果不同导致的检测结果差异,保障了方法的稳定性。在本研究中所涉及的物种亲缘关系近,采用的核基因拷贝数差异不明显,也是能通过目的扩增峰面积比计算掺伪比例的重要前提。由于针对同类药材不同单倍型的探针序列间同源性较高,导致毛细管电泳检测时通常会在目的扩增峰相隔1~2 base-pairs的位置出现峰面积大小相近的峰,属于正常现象,可在数据处理时将其平均峰面积纳入掺伪比例计算。经多次实验发现同一个样品不同批次的对应扩增峰也存在1~3 base-pairs的差异,属于正常波动范围,在检测中应使用对照品进行目的扩增峰定位。
| [1] |
朱瑄. 贝母的药理研究及临床应用[J]. 中国现代药物应用, 2010, 4(17): 98. ZHU X. Pharmacological research and clinical application of fritillaria[J]. Chin J Mod Drug Appl, 2010, 4(17): 98. DOI:10.3969/j.issn.1673-9523.2010.17.085 |
| [2] |
刘辉, 陈士林, 姚辉, 等. 川贝母的资源学研究进展[J]. 中国中药杂志, 2008, 33(14): 1645. LIU H, CHEN SL, YAO H, et al. Research progress on resources in Bulbus Fritillariae Cirrhosae[J]. China J Chin Mater Med, 2008, 33(14): 1645. |
| [3] |
张惠源, 张志英, 岳俊三. 中国中药资源志要[M]. 北京: 科学出版社, 1994. ZHANG HY, ZHANG ZY, YUE JS. China's Ambition to Traditional Chinese Medicine Resources[M]. Beijing: Science Press, 1994. |
| [4] |
于晓琳, 季晖, 王长礼, 等. 贝母的药理作用研究概况[J]. 中草药, 2000, 31(4): 313. YU XL, JI H, WANG CL, et al. Survey of pharmacology researches of Bulbus Fritillariae[J]. Chin Tradit Herb Drugs, 2000, 31(4): 313. DOI:10.3321/j.issn:0253-2670.2000.04.038 |
| [5] |
CHAN SW, LI SL, LIN G, et al. Pharmacokinetic study and determination of imperialine, the major bioactive component in antitussive Fritillaria cirrhosa, in rat by high-performance liquid chromatography coupled with evaporative light-scattering detector[J]. Anal Biochem, 2000, 285(1): 172. DOI:10.1006/abio.2000.4756 |
| [6] |
桂镜生, 杨树德. 川贝母与平贝母的资源状况调查及市场供求分析[J]. 云南中医学院学报, 2008, 31(6): 36. GUI JS, YANG SD. An analysis of Bulbus Fritillariae cirrhosae and Bulbus Fritillaria ussuriensis resources survey and market supply and demand[J]. J Yunnan Univ Tradit Chin Med, 2008, 31(6): 36. DOI:10.3969/j.issn.1000-2723.2008.06.013 |
| [7] |
WANG C, LI P, DING J, et al. Simultaneous identification of Bulbus Fritillariae Cirrhosae using PCR-RFLP analysis[J]. Phytomedicine, 2007, 14: 628. DOI:10.1016/j.phymed.2006.09.008 |
| [8] |
徐传林, 李会军, 李萍, 等. 川贝母药材分子鉴定方法研究[J]. 中国药科大学学报, 2010, 41(3): 226. XU CL, LI HJ, LI P, et al. Molecular method for the identification of Bulbus Fritillariae Cirrhosae[J]. J China Pharm Univ, 2010, 41(3): 226. |
| [9] |
张文娟, 刘薇, 魏锋, 等. 聚合酶链式反应-限制性片段长度多态性法用于检定川贝母掺伪情况的研究[J]. 药物分析杂志, 2014, 34(10): 1830. ZHANG WJ, LIU W, WEI F, et al. Study on identifying adulterants in Fritillariae Cirrhosae Bulbus with polymerase chain reaction-restriction fragment length polymorphisms(PCR-RFLP) method[J]. Chin J Pharm Anal, 2014, 34(10): 1830. |
| [10] |
SCHOUTEN JP, MCELGUNN CJ, WAAIJER R, et al. Relative quantification of 40 nucleic acid sequences by multiplex ligation-dependent probe amplification[J]. Nucl Acid Res, 2002, 30(12): e57. DOI:10.1093/nar/gnf056 |
| [11] |
REIJANS M, DINGEMANS G, KLAASSEN CH, et al. RespiFinder:a new multiparameter test to differentially identify fifteen respiratory viruses[J]. J Clin Microbiol, 2008, 46(4): 1232. DOI:10.1128/JCM.02294-07 |
| [12] |
史喜菊, 马贵平, 乔彩霞, 等. 多重连接探针扩增(MLPA)技术同时检测五种病毒的研究[J]. 农业生物技术学报, 2013, 21(6): 745. SHI XJ, MA GP, QIAO CX, et al. Simultaneous detection of five virues by multiplex ligation-dependent probe amplification(MLPA) technology[J]. J Agric Biotechnol, 2013, 21(6): 745. |
| [13] |
姚凤霞, 睢瑞芳, 张为民, 等. 多重连接探针扩增技术检测常见线粒体疾病[J]. 协和医学杂志, 2013, 4(2): 104. YAO FX, SUI RF, ZHANG WM, et al. Multiplex ligation-dependent probe amplification technology for detection of mitochondriopathy[J]. Med J Peking Union Med Coll Hosp, 2013, 4(2): 104. DOI:10.3969/j.issn.1674-9081.2013.02.004 |
| [14] |
杨祖铭, 王三南, 刘敏娟, 等. 多重连接依赖的探针扩增技术在检测先天性心脏病遗传学病因中的应用[J]. 中国优生与遗传杂志, 2017, 25(25): 20. YANG ZM, WANG SN, LIU MJ, et al. Detection of major genetic causation of congenital heart disease by multiplex ligation-dependent probe amplification[J]. Chin J Birth Health Hered, 2017, 25(6): 20. |
| [15] |
张丹妍, 冯雪菲, 戴礼猛, 等. 应用多重连接依赖探针扩增和微阵列比较基因组杂交术检测不明原因智力障碍患儿[J]. 中国优生与遗传杂志, 2017, 25(25): 11. ZHANG DY, FENG XF, DAI LM, et al. Application of MLPA and aCGH technology in the detection of unknown causes of mental retardation in child[J]. Chin J Birth Health Hered, 2017, 25(2): 11. |
| [16] |
GUERTLER P, GOERLICH O, BUSCH U. Development of a multiplex ligation dependent probe amplification(MLPA) module for simultaneous detection of five genetically modified rapeseed events[J]. Agric Sci, 2014, 5(6): 530. |
| [17] |
SAMELAK-CZAJKA A, MARSZALEK-ZENCZAK M, MARCINKOWSKA-SWOJAK M, et al. MLPA-based Analysis of copy number variation in plant populations[J]. Front Plant Sci, 2017, 8: 22. |
 2018, Vol. 38
2018, Vol. 38 
