2. 武汉理工大学, 武汉 430070
2. Wuhan University of Technology, Wuhan 430070, China
翠云草Selaginella uncinata(Desv.)Spring为卷柏科卷柏属多年生草本植物,具有清热解毒、凉血止血等功效,用于治疗肺热咳嗽、黄疸、痢疾、咽喉肿痛、跌打损伤、多种出血等病症[1-3]。主要分布于广西、贵州、四川、湖北、湖南等地,目前收载于湖北、广东、广西等地方中药材质量标准。
据文献报道,卷柏属植物中主要化学成分为黄酮类化合物,以芹菜素及其衍生物为基本母核,如穗花衫双黄酮、异柳杉双黄酮、扁柏双黄酮、苏铁双黄酮及芹菜素等。通过C-C或者C-O-C连接而成,按照母核连接方式可分为3种类型[4]:3′,8″-双芹菜素型(即amentoflavone型)(A型)、3′,6″-双芹菜素型(即robustaflavone型)(B型)及4′-O-6″双苯醚型(即hinokiflavone型)(C型)。翠云草据报道含有多种双黄酮类成分[5-12],结构以穗花杉双黄酮与罗波斯塔双黄酮母核为主,包括氢化母核、甲氧基取代等多种类型。
本文首先采用提取分离结合谱学分析技术,从翠云草中分离得到4个单体双黄酮类化合物;再采用LC-UV-MS技术,研究翠云草中已知化合物的质谱裂解规律,推测出其他成分,共归属14个成分峰;分析翠云草中双黄酮化合物的结构特点,为整体评价翠云草质量提供依据。
1 仪器与材料BUCHI公司B-540型BUCHI熔点测定仪;Bruker公司AV-500核磁共振仪;Waters ACQUITY UPLCXevo G2-Q-TOF液质联用色谱仪;安捷伦公司1200高效液相色谱仪DAD检测器;薄层色谱硅胶及柱色谱硅胶(青岛海洋化工有限公司)。ACQUITY UPLC BEH Shield RP18色谱柱(2.1 mm×100 mm,1.7 μm);Mettler XP-204电子天平。纯净水为Milli-Q超纯水,其余试剂均为分析纯。
穗花杉双黄酮对照品含量90.2%,(批号111902-201102)购于中国食品药品检定研究院;白果黄素(含量 > 98%)购于天津一方科技有限公司。
样品于2016年9月采自湖北宜昌车溪,由中南民族大学万定荣教授鉴定为卷柏科植物翠云草Selaginella uncinata(Desv.)Spring的干燥全草。
2 方法与结果 2.1 提取与分离取翠云草5 kg,加10倍量的95%乙醇水加热回流提取2次,每次1 h,合并提取液,减压浓缩至无醇味,依次用石油醚、乙酸乙酯萃取,减压回收溶剂,干燥,得乙酸乙酯部位60 g。取乙酸乙酯部位60 g,以三氯甲烷-甲醇(1:1)超声(功率160 W,频率30 kHz)处理30 min使溶解,上硅胶柱(200~300目),用三氯甲烷-甲醇(80:1→5:1)梯度洗脱,经色谱分析得到目标成分的组分,经半制备HPLC(250 mm×20 mm,5 μm)精制,乙腈-水(40:60)为流动相洗脱,继而重结晶精制,分别得到化合物1(65 mg)、2(10 mg)、3(10 mg)、4(10 mg)。
2.2 LC-MS方法 2.2.1 液相色谱条件色谱柱:ACQUITY UPLC BEH Shield RP18(2.1 mm×100 mm,1.7 μm);流动相:以乙腈为流动相A、以水(含0.1%甲酸)为流动相B,流速0.2 ml·min-1,进行梯度洗脱(0~40 min,35%B→60%B,40~42 min,60%B→90%B,42~45 min,90%B→35%B,45~52 min,35%B);DAD检测波长:270 nm;柱温:30 ℃;进样量:1 μL。
2.2.2 质谱条件电喷雾负离子模式(ESI-)检测;毛细管电压2. 8 kV;锥孔电压20 V;离子源温度100 ℃;洗脱溶剂温度300 ℃;脱溶剂气流量350 L·h-1,锥孔反吹气50 L·h-1。采集:采集方法是MSE,采集时间52 min。扫描范围m/z 100~1 500。碰撞能量:低能量6 V,梯度高能量20~40 V。碰撞气体:高纯氮气。
2.2.3 供试品溶液的制备取翠云草粉末(过3号筛)约1 g,精密称定,加90%甲醇水40 mL,称量,加热回流1.5 h,冷却,再称量用90%甲醇水溶液补足减失的量,滤过,摇匀,用0.22 μm微孔滤膜滤过,即得。
2.2.4 对照品溶液的制备分别精密称取6种对照品,加甲醇溶解配制成含2,3,2″,3″-四氢穗花杉双黄酮47.41 μg·mL-1,2,3,-二氢穗花杉双黄酮49.88 μg·mL-1,穗花杉双黄酮47.45 μg·mL-1,2,3,-二氢穗花杉双黄酮-4′-甲醚47.88 μg·mL-1,白果黄素12.82 μg·mL-1和罗波斯塔双黄酮-4′-甲醚58.11 μg·mL-1的溶液,作为对照品溶液。
2.3 分离化合物鉴定化合物1 淡黄色结晶性粉末,分子式C31H20O10;UV λmax:280、330 nm;ESI(-):m/z 551([M-H]-)、519([M-H2O]-)。1H-NMR(500 MHz,DMSO-d6)δ:13.23(1H,s,5″-OH),12.96(1H,s,5-OH),10.81(1H,s,7-OH),10.80(1H,s,7″-OH),10.36(1H,s,4″′-OH),8.09(1H,brd,J=8.5 Hz,H-6′),7.97(2H,d,J=8.5 Hz,H-2″′,6″′),7.84(1H,brs,H-2′),7.25(1H,d,J = 9.0 Hz,H-5′),6.95(2H,d,J=8.5 Hz,H-3″′,5-″′),6.89(1H,s,H-3),6.83(1H,s,H-3″),6.65(1H,s,H-8″),6.51(1H,brs,H-8),6.20(1H,brs,H-6),3.81(3H,s,4′-OCH3)。以上数据与文献报道的罗波斯塔双黄酮-4′-甲醚数据[13]基本一致,故鉴定化合物1为罗波斯塔双黄酮-4′-甲醚,结构式见图 1。
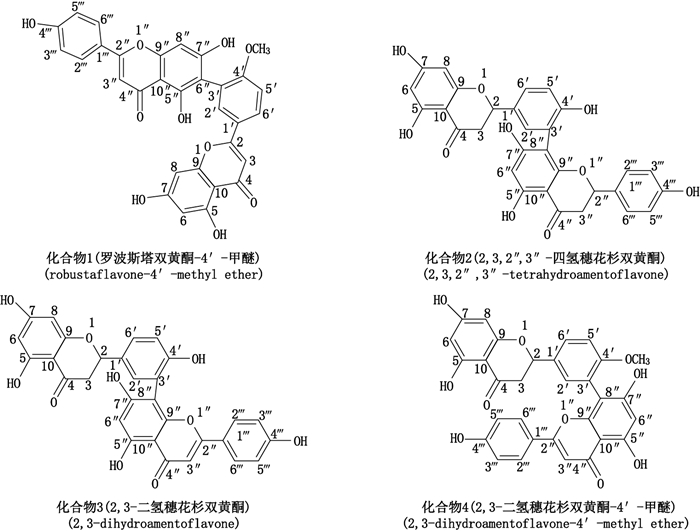
|
图 1 分离鉴定的4个化合物的结构式 Figure 1 Structural formula of four compounds isolated and identified |
化合物2 淡黄色结晶性粉末,分子式C30H22O10;UV λmax:290 nm;ESI(-):m/z 541([M-H]-)、389(Ⅰ环RDA裂解4位羰基开环)。1H-NMR(500 MHz,DMSO-d6)δ:2.60~2.80和3.10~3.30(4H,m,H-3,3″),5.40(2H,m,H-2,2″),5.88(2H,s,H-6,8),6.02(1H,s,H-6″),6.68(2H,d,J=10.5 Hz,H-3″′,5″′),6.82(1H,d,J = 11.0 Hz,H-5′),7.20(2H,overlap,H-2′,6′),7.19(2H,d,J = 10.5 Hz,H-2″′,6″′),9.48~10.77(7,7″,4′,4″′-OH),12.16(s,1H,5-OH),12.27(s,1H,5″-OH)。以上数据与文献报道的2,3,2″,3″-四氢穗花杉双黄酮数据[14]基本一致,因此鉴定化合物2为2,3,2″,3″-四氢穗花杉双黄酮,结构式见图 1。
化合物3 淡黄色结晶性粉末,分子式C30H20O10;UVmax λ:280、330 nm。ESI(-):m/z539([M-H]-)、387(Ⅰ环RDA裂解4位羰基开环)。1H-NMR(500 MHz,DMSO-d6)δ:2.66和3.32(2H,m,H-3),5.51(1H,dd,J=14.5,2.5 Hz,H-2),5.88(2H,s,H-6,8),6.30(1H,s,H-6″),6.76(1H,s,H-3″),6.77(2H,d,J=8.5 Hz,H-3″′,5″′),6.99(1H,d,J=8.0 Hz,H-5′),7.40(1H,d,J=8.5 Hz,H-6′),7.41(1H,s,H-2′),7.59(2H,d,J=8.5 Hz,H-2″′,6″′),10.31(4H,7,4′,7″,4″′-OH),12.15(s,1H,5-OH),13.08(s,1H,5″-OH).以上数据与文献[9]报道的基本一致,因此鉴定化合物3为2,3-二氢穗花杉双黄酮,结构式见图 1。
化合物4 淡黄色结晶性粉末,分子式C31H22O10;UVmax λ:270、340 nm。ESI(-):m/z553([M-H]-)、509([M-COO]-)。1H-NMR(500 MHz,DMSO-d6)δ:2.65和3.30(2H,m,H-3),3.60(3H,s,4′-OMe),5.51(1H,brd,J=13.0 Hz,H-2),5.77(1H,s,H-6),5.81(1H,s,H-8),6.30(1H,s,H-6″),6.73(1H,s,H-3″),6.77(2H,dd,J=9.0,5.0 Hz,H-3″′,5″′),7.17(1H,dd,J=8.5 Hz,H-5′),7.45(1H,overlap,H-2′),7.49(2H,dd,J=9.0,5.0 Hz,H-2″′,6″′),7.55(1H,m,H-6′),12.19(s,1H,5-OH),13.05(s,1H,5″-OH)。以上数据与文献报道的2,3-二氢穗花杉双黄酮-4′-甲醚数据[15]基本一致,因此鉴定化合物4为2,3-二氢穗花杉双黄酮-4′-甲醚,结构式见图 1。
2.4 LC-MS特征峰的归属取“2.2”项下制备的对照品及供试品溶液,采用超高效液相色谱-二极管阵列-四极杆-飞行时间色谱仪(UPLC-DAD-Q-TOF),按“2.2”项下所述液相色谱及质谱条件进样分析得供试品溶液紫外图(图 2-A)及总离子流图(图 2-B),其中峰1、4、6、11、12、13分别与对照品进行对照确定。对未知化合物进行定性,利用MSE和MSn采集方式,在一级质谱信息中获得高精准的母离子,二级质谱信息中获得碎片信息,根据MS/MS裂解途径,分析已知双黄酮化合物裂解规律,参考裂解规律及文献报道[16],推断目标未知化合物的结构。

|
1. 2,3,2″,3″-四氢穗花杉双黄酮(2,3,2″,3″-tetrahydroamentoflavone)4. 2,3,-二氢穗花杉双黄酮(2,3-dihydroamentoflavone)6.穗花杉双黄酮(amentoflavone)11. 2,3-二氢穗花杉双黄酮-4′-甲醚(2,3-dihydroamentoflavone-4′-methyl ether)12.白果黄素(bilotein)13.罗波斯塔双黄酮-4′-甲醚(robustaflavone-4′-methyl ether) 图 2 翠云草供试品溶液色谱图(A)及总离子流图(ESI-)(B) Figure 2 Chromatograms (A) and TIC chromatogram (B) of sample S.uncinata |
双黄酮化合物的裂解途径和黄酮的裂解有共通之处[17],母核C环会发生开裂,产生RDA裂解;其次会发生各种中性丢失,如失去CO2、H2O、CO等分子;另外还会发生C环断裂后重排失去中性分子C2H2O等。饱和双黄酮(穗花杉双黄酮)易发生Ⅱ-C环0,2位和0,4位的断裂,四氢化(2,3,2″′,3″′-四氢穗花杉双黄酮)后的双黄酮易发生Ⅰ-C环1,3位和0,4位的断裂。二氢双黄酮(2,3,-二氢穗花杉双黄酮)优先发生氢化的C环开裂,因为当环的C2和C3间为单键连接时,3个六元环不能形成大共扼体系,环的稳定性相对较差,很容易发生开环反应。罗波斯塔类双黄酮为3′,6″双芹菜素型双黄酮,Ⅱ环5′,7′位羟基易于Ⅰ环4′的羟基(或甲氧基)发生脱水(或CH3OH)。而穗花杉类为3′,8′双芹菜素型双黄酮,只能发生Ⅰ环4′与Ⅱ环7′位的脱水(或CH3OH),故罗波斯塔双黄酮比穗花杉双黄酮更易脱水(或CH3OH)。对照品及分离鉴定化合物质谱图(图 3)。

|
图 3 对照品及分离鉴定化合物MS图(A)MS2图(B) Figure 3 MS spectra (A) and MS2spectra (B) of two standards and four compounds isolated and identified |
罗波斯塔双黄酮-4′-甲醚,其为C′3-C″6连接的双黄酮类化合物,其负离子模式下的电喷雾质谱碎片见图 4。推断罗波斯塔双黄酮-4′-甲醚可能的裂解途径:Ⅱ-C环发生0,4键断裂,得到m/z 389的碎片离子峰;第2种裂解途径Ⅰ-B环C-4′位的甲氧基与Ⅱ-A环C7″上的羟基出现分子内脱CH3OH,产生m/z 519的碎片,紧接着m/z 519的碎片连续发生Ⅱ-C环1,3键和Ⅰ-C环0,4键的断裂,生成m/z 293的碎片离子;第3种的裂解途径为:Ⅰ-C环脱去-CH3和CO2得到m/z 493的碎片离子峰;第4种的裂解途径为Ⅱ-C环出现0,2键断裂,得到m/z 431的碎片离子峰,其中m/z 431、389丰度很小。
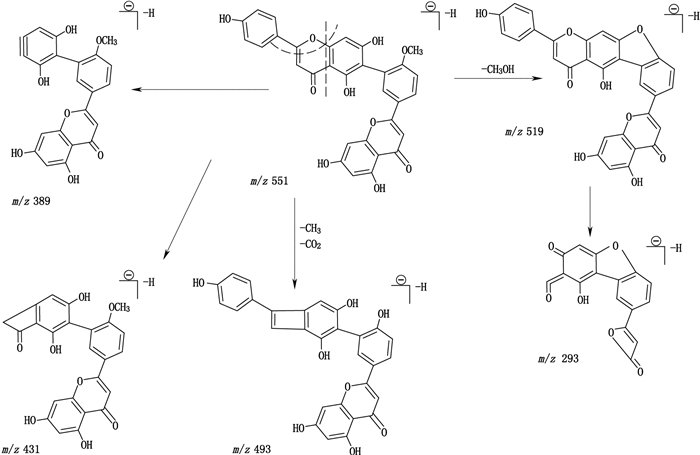
|
图 4 罗波斯塔双黄酮-4′-甲醚可能的裂解途径 Figure 4 Supposed fragmentation pathway of robustaflavone-4′-methyl ether |
根据已知对照品裂解规律及DAD图紫外吸收特征,对翠云草的其他峰进行定性分析。黄酮结构中的桂皮酰基及苯甲酰基组成的交叉共扼体系,双黄酮的吸收具有强度很高的2个紫外吸收带,峰带Ⅱ最大吸收位于280 nm左右,峰带Ⅰ最大吸收位于330 nm左右。饱和双黄酮在280 nm、330 nm处有强吸收,饱和穗花杉双黄酮类在280 nm和330 nm的紫外吸收强度相差不大,表现为280 nm略强于330 nm,而饱和罗波斯塔双黄酮类则相反,表现为330 nm略强于280 nm处紫外吸收。二氢双黄酮的1个C环被氢化,失去1个桂皮酰基系统,表现为在330 nm左右处有弱吸收。四氢双黄酮的2个C环都被氢化,不具有桂皮酰基系统,在330 nm处无吸收,由此可以判断双黄酮化合物的母核。以峰3(四氢双黄酮类)及峰10(二氢双黄酮-4′-甲醚)为例说明推断过程。
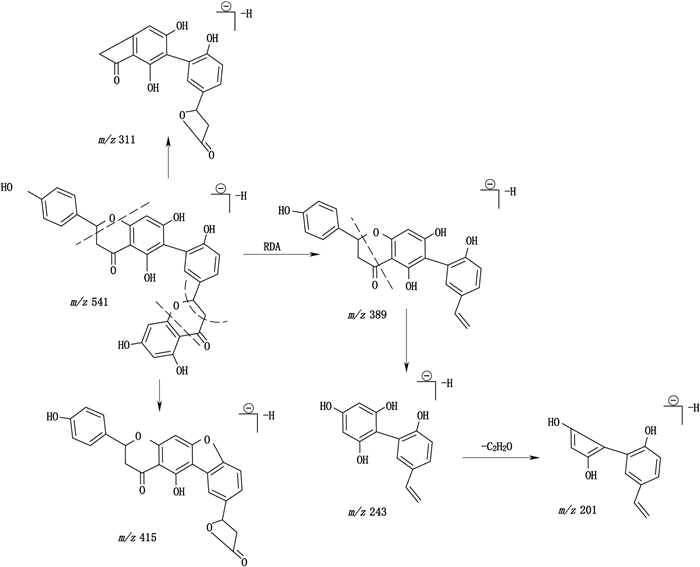
峰3:通过紫外吸收及[M-H]-分子离子峰判断其为四氢双黄酮类化合物,一级质谱图见图 5-A1、二级质谱图见图 5-B1,紫外吸收图见图 6-A1。对比质谱图发现,此化合物的质谱图与峰1的质谱图基本一致,通过对照品对比可知峰1为四氢穗花杉双黄酮,故此化合物结构与四氢穗花杉双黄酮相似,而卷柏中双黄酮类母核一般为穗花杉双黄酮型、罗波斯塔双黄酮型和扁柏双黄酮型,扁柏双黄酮与穗花杉双黄酮和罗波斯塔双黄酮结构差异大,为醚型,故推测此化合物为2,3,2″,3″-四氢罗波斯塔双黄酮。推测此化合物的裂解途径可能如图 7。
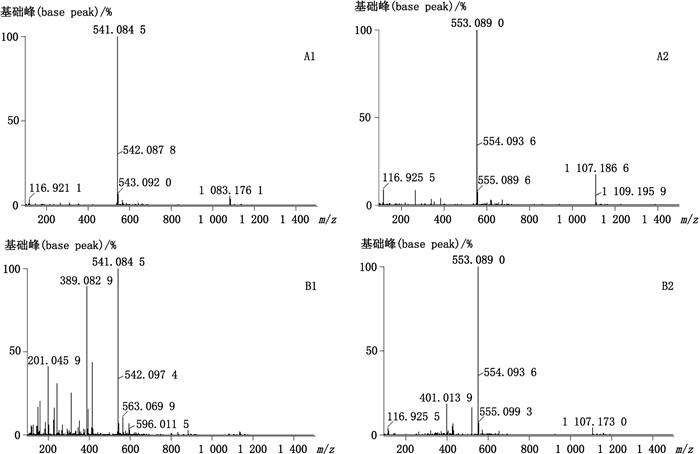
|
图 5 峰3MS(A1)、峰3MS2(B1)、峰10MS(A2)和峰10MS2(B2)图 Figure 5 MS spectra of peak 3(A1), peak 10(B1) and MS2 spectra of peak 3(A2), peak 10(B2) |
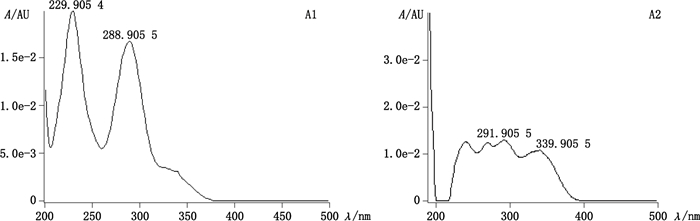
|
图 6 峰3(A1)、峰10(A2)紫外吸收图 Figure 6 UV spectra of of peak 3(A1) and peak 10(A2) |
|
图 7 供试品峰3可能的裂解途径 Figure 7 Supposed fragmentation pathway of peak 3 |
峰10:通过紫外判断其为二氢双黄酮,[M-H]-分子离子峰判断为二氢双黄酮-甲醚类化合物,一级质谱图见图 5-A2、二级质谱图见图 5-B2,紫外吸收图见图 6-A2。该化合物存在m/z 521碎片离子,为Ⅰ-B环C4′位上的羟基或甲氧基与Ⅱ-B环7″位上的羟基或甲氧基脱CH3OH形成,故甲氧基可能位置为4′或7″,根据m/z 375可推断此化合物为2″,3″-二氢双黄酮,故可推断此化合物为二氢穗花杉双黄酮-7″-甲醚或2″,3″-二氢穗花杉双黄酮-4′-甲醚。通过文献报道[10],翠云草中含有2″,3″-二氢穗花杉双黄酮-4′-甲醚,故推测此化合物为2″,3″-二氢穗花杉双黄酮-4′-甲醚。可能的裂解途径如图 8。

|
图 8 供试品峰10可能的裂解途径 Figure 8 Supposed fragmentation pathway of peak 10 |
经MS及DAD定性研究,共鉴定14个成分,其中6个由对照品比对,8个根据已知对照品的裂解规律并结合文献推导而得。具体结论见表 1。
|
|
表 1 翠云草中黄酮类化合物结构推断 Table 1 Supposed flavnoid compounds of S. uncinata |
本研究通过柱色谱分离、波谱解析得到4个单体成分,为制订翠云草质量标准提供了对照品物质基础;通过LC-MS方法结合对照品质谱裂解规律,归属了另外10个双黄酮类成分,为其指纹图谱分析提供了依据。初步分析,翠云草中双黄酮母核以穗花杉双黄桐及罗波斯塔双黄酮为主,结构中有氢化或甲氧取代,所鉴定的14个成分均在260~280 nm有最大吸收,可选择在该波长范围内,制订双黄酮类成分总量的紫外测定方法。
| [1] |
孙颖桢, 陈科力, 刘震. 翠云草总黄酮对结肠癌HT-29细胞COX-2 mRNA表达的抑制作用[J]. 中国药师, 2010, 3(2): 163. SUN YZ, CHEN KL, LIU Z. Inhibiting action of total flavones from Selaginella uncinata ON COX-2 mRNA expression in HT-29 cells[J]. China Pharm, 2010, 3(2): 163. DOI:10.3969/j.issn.1008-049X.2010.02.001 |
| [2] |
马家宝, 韦丽富, 梁建莉, 等. 翠云草的化学成分及药理作用研究概况[J]. 广西中医药大学学报, 2014, 17(3): 67. MA JB, WEI LF, LIANG JL, et al. Review the chemical components and pharmacological activities of Selaginella uncinata[J]. J Guangxi Univ Chin Med, 2014, 17(3): 67. |
| [3] |
缪刘萍, 王鑫杰, 周海凤, 等. 双黄酮类化合物药理作用研究[J]. 世界临床药物, 2012, 33(6): 369. MIAO LP, WANG XJ, ZHOU HF, et al. Advance in the pharmacological effects of biflavonoids[J]. World Clin Drugs, 2012, 33(6): 369. |
| [4] |
张红伟, 孙晓飞, 田景奎. 卷柏属植物黄酮类成分研究概况[J]. 亚太传统医药, 2007, 3(10): 63. ZHANG HW, SUN XF, TIAN JK. Survey of the research of flavones and flavonoids in Selaginellaceae[J]. Asia Pac Tradit Med, 2007, 3(10): 63. DOI:10.3969/j.issn.1673-2197.2007.10.020 |
| [5] |
ZHANG LP, LIANG YM, WEI XC, et al. A new unusual natural pigment from Selaginella sinensis and its noticeable physicochemical properties[J]. J Org Chem, 2007, 72(10): 3921. DOI:10.1021/jo0701177 |
| [6] |
CHENG X, MA S, YU J, et al. Selaginellin A and B, two novel natural pigments isolated from Selaginella tamariscina[J]. Chem Pharm Bull, 2008, 56(7): 982. DOI:10.1248/cpb.56.982 |
| [7] |
CHAO Y, SHAO YT, LI K. Bioactive selaginellins from Selaginella tamariscina (Beauv.) Spring.Beilstein[J]. J Org Chem, 2012, 8(11): 1884. |
| [8] |
WANG CJ, HU CP. Protective effect of selaginellin on glutamate-induced cytotoxicity and apoptosis in differentiated PC12 cells.Naunyn Schmiedebergs[J]. Arch Pharmacol, 2010, 381(1): 73. DOI:10.1007/s00210-009-0470-4 |
| [9] |
易美玲, 盛习锋, 徐康平, 等. 翠云草中黄酮类成分的研究[J]. 中国中药杂志, 2015, 40(15): 3005. YI ML, SHENG XF, XU KP, et al. Flavonoids from Selaginella uncinata[J]. China J of Chin Mate Med, 2015, 40(15): 3005. |
| [10] |
范晓磊, 徐嘉成, 林幸华, 等. 翠云草中双黄酮类成分研究[J]. 中国药学杂志, 2009, 44(1): 15. FAN XL, XU JC, LIN XH, et al. Study on biflavonoids from Selaginella uncinata (Desv.) Spring[J]. Chin Pharm J, 2009, 44(1): 15. DOI:10.3321/j.issn:1001-2494.2009.01.006 |
| [11] |
郑俊霞, 郑扬, 张磊, 等. 翠云草中黄酮及酚性成分研究[J]. 时珍国医国药, 2012, 23(12): 3006. ZHENG JX, ZHENG Y, ZHANG L, et al. Isolation and identification of flavonoids and phenolic constituents from Selaginella uncinata (Desv.) Spring[J]. Lishizhen Med Mater Med Res, 2012, 23(12): 3006. DOI:10.3969/j.issn.1008-0805.2012.12.025 |
| [12] |
邹辉, 徐康平, 易美玲, 等. 翠云草中1个新的双黄酮类化合物[J]. 中草药, 2016, 47(9): 1477. ZOU H, XU KP, YI ML, et al. A new biflavonoid from Selaginella uncinata[J]. Chin Tradit Herb Drugs, 2016, 47(9): 1477. |
| [13] |
邹振兴, 徐康平, 邹辉, 等. 江南卷柏中双黄酮类化学成分研究[J]. 中南药学, 2012, 10(1): 4. ZOU ZX, XU KP, ZOU H, et al. Biflavonoids from Selaginella moellendorfii Hieron[J]. Cent South Pharm, 2012, 10(1): 4. DOI:10.3969/j.issn.1672-2981.2012.01.002 |
| [14] |
Ahmad I. Tetrahydroamentoflavone from nuts of Semecarpus prainii[J]. Phytochemistry, 1981, 20(5): 1169. DOI:10.1016/0031-9422(81)83061-0 |
| [15] |
MOAAWD A. Phytochemical investigation of Cycas circinalis and Cycas revoluta leaflets:moderately active antibacterial biflavonoids[J]. Plant Med, 2010, 76: 796. DOI:10.1055/s-0029-1240743 |
| [16] |
毕跃峰, 郑晓珂, 冯卫生, 等. 卷柏中化学成分的分离方法与结构鉴定[J]. 药学学报, 2004, 39(9): 41. BI YF, ZHENG XK, FENG WS, et al. Isolation and structural identification of chemical constituents from Selaginella tamariscina(Beauv.) Spring[J]. Acta Pharm Sin, 2004, 39(9): 41. |
| [17] |
徐英, 董静, 王弘, 等. 电喷雾-离子阱-飞行时间质谱联用研究黄酮和异黄酮苷元C环上的裂解规律[J]. 高等学校化学学报, 2009, 30(1): 46. XU Y, DONG J, WANG H, et al. Fragmentation study of the C ring in flavone and isoflavone aglycones by electrospray ion trap time-of-flight mass spectrometry[J]. Chem J Chin Univ, 2009, 30(1): 46. DOI:10.3321/j.issn:0251-0790.2009.01.011 |
 2018, Vol. 38
2018, Vol. 38 
