2. 中国药科大学药物一致性评价重点实验室, 南京 210009
2. Key Laboratory of Drug Consistency Evaluation, China Pharmaceutical University, Nanjing 210009, China
杂质是指任何影响药物纯度的物质[1],通常在药物的生产和储存过程中产生,其不仅可能影响药物疗效,且与药物不良反应密切相关[2]。阐明杂质是控制药物质量,保证用药安全的前提之一,也是近年来行业内关注的热点。对杂质的系统研究和合理控制,无论对新药研发还是仿制药质量疗效一致性评价,都是一项十分重要的内容。杂质水平还是评价处方工艺合理可行的重要依据[3],但有时仅靠限定某个或某些杂质的含量并不能完全反映药物的杂质水平[4],系统的杂质谱研究是目前的发展趋势,以实现杂质控制的更加全面、合理,切实保障药品质量和安全[5]。
二氢吡啶类药物因疗效确切,不良反应少且可显著减少心血管事件的发生等特点,成为临床抗高血压药物的一线用药,目前约占降压药市场份额的40%[6]。随着我国心血管疾病发病率的逐年增加,市场需求将继续上升[7],且由于其多为长期用药、终身用药[8],对其杂质的控制更显得尤为重要。本文通过对二氢吡啶类药物杂质研究现状的思考,探讨了研究过程中应注意的问题及相应的解决建议,希望为该类药物的杂质研究与控制提供参考。
1 二氢吡啶类药物杂质来源化学药物从原料合成、制剂制备到储存放置的整个过程中,都可能伴随着杂质的产生[5, 9-10]。根据来源不同,可将杂质分为合成工艺杂质、活性成分降解产物、辅料相关杂质等。
1.1 合成工艺杂质药物在合成过程中未反应完全的反应物、中间体、副产物等是杂质的重要来源。二氢吡啶类药物具有一个基本的活性结构1,4-二氢吡啶环[11-12](如图 1和表 1),其成环反应是此类药物合成的关键步骤[13],环合过程的中间产物可能会与反应物中的杂质相互作用形成副产物,如尼莫地平侧链甲酸甲氧基乙酯被甲酸异丙酯取代的杂质,是由中间体与原料中杂质乙酰乙酸异丙酯环合后形成的。原料合成和产物纯化过程残存的反应物、中间体等亦是原料药中的杂质来源,如氨氯地平的氨基保护是其合成过程的重要步骤[14],但是脱去保护基团时由于水解不完全可产生含酰胺类基团侧链的中间体杂质。另外,在复杂的化学合成反应条件下,一些反应物和中间体会发生氧化、水解、脱羧等反应生成新的杂质,如氯维地平的吡啶二羧酸单酯类合成中间体,在加热条件下可脱羧生成羧酸单酯类杂质[15]。
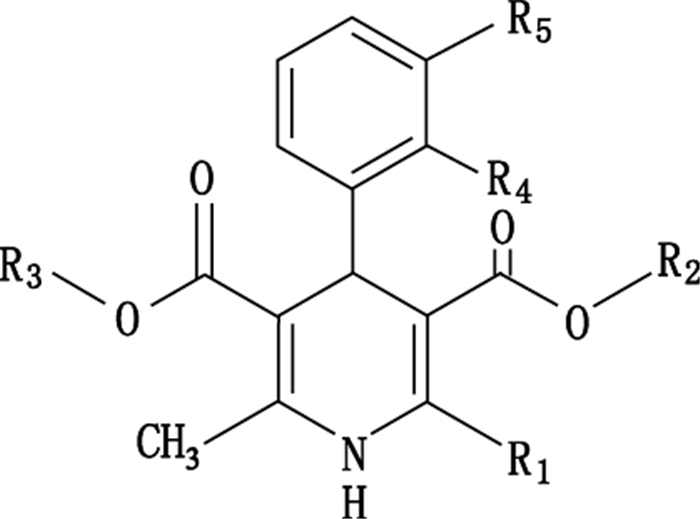
|
图 1 二氢吡啶类药物结构通式 Figure 1 Dihydropyridine drug chemical structure |
|
|
表 1 二氢吡啶类药物的结构基团 Table 1 Dihydropyridine drug structural groups |
该类杂质与药物的生产工艺密切相关,可根据合成工艺推测可能的杂质,为进一步研究提供依据,也可依据杂质分析结果优化药物生产工艺。由于仿制药和原研药合成工艺可能不同,在一致性评价时应着重研究此类杂质,以保证仿制药与原研药的质量可比性。
1.2 活性成分降解产物药物活性成分合成后,在提纯、成盐、干燥、制剂制备、储存放置等过程中,会受到光、热、湿、空气等外界因素影响,活性成分可能发生氧化、水解、聚合等反应,生成的杂质可归类为降解产物。二氢吡啶类药物具有光敏性,二氢吡啶环在光照下易氧化成吡啶环,生成的降解物是该类药物的共性杂质,也是有关物质检查中的特殊杂质。硝苯地平和尼索地平还含有邻硝基苯基,在光照下硝基可转变为亚硝基[10]。此外,二氢吡啶环3位和5位的酯基侧链,还可能发生水解,如氯维地平的3位侧链的酯基水解后可形成吡啶二羧酸单酯类化合物[16]。
由于降解产物与药物结构特征密切相关,故可根据结构特点和外界条件分析降解产物的类型及结构,如通过强制降解试验研究潜在的降解产物,并分析其可能的降解途径[17]。二氢吡啶类药物结构对光、氧不稳定的特点,使降解产物成为该类药物中含量最大的杂质,所以应对其重点控制。
1.3 辅料相关杂质辅料是药物制剂中除主药外其他物料的总称,是制剂的重要组成部分[18]。辅料在制剂中的含量占比较大,且其质量及性质会影响制剂的质量和药物在体内的吸收代谢。在药物生产储存过程中,辅料也可能与主药发生相互作用或促进其降解产生杂质,如苯磺酸氨氯地平在硅化微晶纤维素存在情况下可发生较明显的降解[19],在硬脂酸镁存在时可与还原性糖类(乳糖、葡萄糖、半乳糖、淀粉与纤维素水解物)发生Mailland反应而产生杂质[20]。药物处方开发时,应进行深入的辅料相容性研究,监测杂质变化,尽量避免不相容辅料的使用。若采用此类辅料,应注意处方优化,严格控制相关杂质。
另外,辅料在外界因素影响下产生的降解物,如加氨法制得的焦糖可产生4-甲基咪唑[21],以及辅料本身引入的杂质,都可能影响药物的质量和安全,所以药用辅料同药物一样也需进行严格的质量控制[22]。
1.4 基因毒性杂质基因毒性杂质是在低水平情况下可能引起DNA损伤,导致DNA诱变的物质,具有遗传毒性和致癌毒性[23]。常见的基因毒性杂质有卤代烷烃、磺酸酯、肼类、环氧化物、酰卤类以及芳硝基类化合物[24]。氨氯地平通常以苯磺酸或甲磺酸盐形式给药,而这2种酸根可与溶剂甲醇、乙醇、正丙醇、异丙醇反应生成具有烷基化作用的磺酸酯[25-27]。另外,大部分二氢吡啶类药物含有基因毒性结构警示基团芳硝基[24],需注意含硝基类杂质的控制。由于基因毒性杂质对人类健康存在很大危害,需要优化工艺以保证该类杂质不高于可接受的癌症风险水平[28]。
1.5 基于数据挖掘技术的杂质谱分析药物从原料药合成、制剂制备到储存放置的整个过程中都可能伴随着杂质的生成,故人用药品注册技术要求国际协调会(ICH)于2002年引入了杂质谱概念。杂质谱是对存在于药物中所有已知杂质和未知杂质总的描述(种类和含量)[29],可全面评估药物的质量与安全性,并支撑对工艺的优化[4]。
应用于药物质量疗效一致性评价时,通过系统比较仿制药与参比制剂的杂质谱,可更全面反映两者间的差异。刘雁鸣等[30]针对3种不同来源的样品,通过比较谱图中杂质峰位置、数量、单个杂质含量、紫外特征光谱图等建立了杂质谱的一致性分析方法;张明媛等[31]利用中药指纹图谱的研究思路,结合化学计量学方法,比较了5个不同厂家仿制的硝苯地平片与原研药的相似程度,并提出了杂质谱一致性评价的具体流程。
采用高灵敏、高通量分析技术采集的杂质谱,包含多种物质信息。但目前对杂质谱的分析多是针对谱图上的具体目标成分,而较少结合化学计量学方法对整个谱图进行全面分析。数据挖掘技术作为一种信息处理工具,可从复杂数据中提取有效信息并使之以特定模式呈现[32],更适合于解析和提取杂质谱中潜在信息,以评价和控制药物中的杂质。相似度分析与聚类分析是根据相关系数、欧氏距离或夹角余弦计算谱图峰面积积分相似度、整体轮廓谱相似度等表征样品之间相似性的方法,相似度系数越接近1,则被认为样品的谱图越相似[33]。但由于杂质为非主要成分,且在种类和含量上存在较大差异,所以当不同来源药物样品的杂质谱相似度低或不能聚为一类时,通常也不能确证相互间不一致。主成分分析和偏最小二乘分析既可根据样本间的空间距离,采用多元统计分析判别组间的相似性,又能根据变量投影重要性筛出药物杂质谱间的差异杂质,结果更为合理、可靠。
2 杂质分析检测方法对杂质分析而言,由于其化学结构及性质差异大,种类多,相对主成分含量低,制剂中辅料干扰多等,所以分析检测方法除要求较高的灵敏度和专属性外,也应具有较好的适用性和抗干扰能力。常用的杂质分析检测方法,主要包括薄层色谱法、气相色谱法、高效液相色谱-紫外光谱法、高效液相色谱-质谱联用法等。另外,毛细管电泳、超临界流体色谱等技术也在杂质分析中逐渐得到应用。
2.1 薄层色谱法(TLC)TLC采用供试品与限量的杂质对照品,在同一薄层板上点样,展开后在紫外/荧光下比较杂质斑点的大小、数量、颜色来制定供试品中杂质含量。Marciniec等[12]采用硅胶60F254薄层色谱板,研究了7种二氢吡啶类药物在电离辐射前后降解产物数量的变化。结果发现,辐射后尼莫地平杂质增加最多,说明其电离辐射稳定性最差。2015年版《中华人民共和国药典》(以下简称《中国药典》)二部的苯磺酸氨氯地平检查项有关物质Ⅰ法[34],即根据薄层色谱板上斑点的颜色和数量,控制其有关物质含量。
TLC法对仪器设备要求不高,且操作简便,经济易行。但由于薄层板的涂覆厚度可能不均匀,点样量一致性差,目视法判断颜色深浅会因人而异,影响结果的重现性和精密度,且只有特定结构的杂质在紫外/荧光下才会显色,故该法主要用于一般杂质的检查[35],在色谱仪器越来越普及的情况下,其应用也逐渐减少,通常只用于快速、粗略地比较杂质差异。
2.2 高效液相色谱法(HPLC)HPLC可与多种检测器联用实现对复杂样品的分离分析,由于灵敏度高,专属性好,快速高效,是药物杂质分析应用最广的方法。本文主要总结了HPLC与紫外或质谱检测器联用在二氢吡啶类药物杂质检测分析中的应用。
2.2.1 紫外检测器(UV)二氢吡啶类药物有关物质多具有吡啶环、苯环取代基、共轭双键等生色团,在一定波长下具有较高的吸收强度[36],故可采用紫外检测。HPLC-UV法是目前各国药典中对二氢吡啶类药物有关物质检查应用最多的方法,2015年版《中国药典》中收载的8种二氢吡啶类药物,除苯磺酸氨氯地平的有关物质Ⅰ法为TLC法外,其余均为HPLC-UV法。Liu等[37]采用反相HPLC-DAD法对丁酸氯维地平的10个工艺杂质进行了分离和定量分析。Vojta等[38]以磷酸二氢铵-乙腈为流动相梯度洗脱方式,采用UPLC-DAD分离分析了苯磺酸氨氯地平及其7种有关物质。
笔者参照2015年版《中国药典》,采用HPLC-DAD对强氧化破坏的苯磺酸氨氯地平进行了分析,结果如图 2。氨氯地平保留时间约17 min,氧化产生的杂质保留时间基本在15 min内。除相对保留时间为0.5处的主要氧化产物外,在7.5 min内含量相对较高的杂质未达基线分离。由于降解产物在反相ODS柱上的保留比主成分弱,说明其相对于氨氯地平极性增大;另外,保留时间为4.86、5.58、6.48 min的3个杂质在主成分检测波长237 nm处吸收较弱。所以,当采用不加校正因子的主成分自身对照法对杂质进行限定时,杂质与主成分的响应因子存在差异,可能引入较大误差。据此,在实际进行杂质研究时,可考虑采用梯度洗脱方式,以增强杂质保留,提高分离度,并采用DAD等多波长模式同时对杂质进行分析。

|
图 2 苯磺酸氨氯地平氧化破坏后样品在237 nm波长下的HPLC色谱图 Figure 2 HPLC chromatogram of oxidative destruction amlodipine besylate detected at 237 nm |
紫外检测器由于成本低廉,操作简便,响应稳定,高通量等特点,且与各种流动相条件都兼容,在杂质检测中应用广泛。但由于其检测灵敏度低,对含量低且需严格限制的基因毒性杂质很难进行有效检测[39]。另外,紫外检测器难以提供充分的定性信息,故其应用于杂质研究时也存在一定的局限性。
2.2.2 质谱检测器(MS)质谱检测器灵敏度高,且可实现多种物质的同时检测。与HPLC联用后,不仅可检出含量较低的杂质,还可根据质谱扫描离子推测杂质结构,因此HPLC-MS联用技术近年来越来越广泛地应用于药物有关物质的定性和定量研究。Zhou等[40]采用反相HPLC-MS/MS对丁酸氯维地平的11个潜在杂质进行了结构鉴定,联合核磁共振(NMR)技术确定了其中3种未见报道的杂质结构。Reddy等[41]利用HPLC-MS以及NMR、IR谱确定了马来酸氨氯地平在40 ℃/ 75%RH加速试验条件下出现的新杂质结构。
质谱检测器能够提供丰富的结构信息,弥补了紫外检测器在结构鉴定方面的不足,为推测杂质来源提供有力支撑,同时也更适合于痕量基因毒性杂质的监测。表 2总结了二氢吡啶类药物基因毒性杂质磺酸酯类质谱特征碎片的质荷比[27, 42-43]。目前仅通过质谱信息对未知杂质进行结构确认还存在困难,可考虑采用多级质谱技术以获得更丰富的杂质碎片信息,借助分析软件或数据库如ChemSpider、eMolucules等,解析杂质结构。
|
|
表 2 磺酸酯类基因毒性杂质的质谱特征碎片 Table 2 Characteristic MS fragmentions of sulfonate esters in dihydropyridines |
HPLC及其各种联用技术集分离、分析于一体,可实现多种杂质的同时定性与定量,在药物杂质研究中占主导地位,无论是在药物研发还是仿制药质量疗效一致性评价中,均是不可或缺的手段。
2.3 气相色谱法(GC)GC具有分离快速、高效的特点,与质谱联用后可用于物质的结构鉴定。Mielcarek等[44]利用GC-MS对二氢吡啶类似结构的六氢喹啉衍生物的4种光解产物进行了结构鉴定。罗功才[45]应用GC法对尼索地平稳定性试验样品中主成分及杂质含量进行分析,发现其对光不稳定,对温度和湿度相对稳定。GC法通常仅适用于挥发性、热稳定物质或衍生化后挥发性物质的分析,故其是药物中残留溶剂分析的有效手段,可与HPLC技术联用以弥补其对不易挥发物质检测的缺点。
2.4 毛细管电泳法(CE)CE是在高压直流电场驱动下使物质在液相毛细管中实现分离的技术,具有灵敏度高,分辨率好,分离速度快,进样量小,成本低等特点[46-47],对强碱性和强酸性物质均适用,且可在流动相中使用各种添加剂,提高可分析物质的广泛性。相比于常规液相色谱,CE可增加样品检测峰并能减少化学噪音进入质谱,进而减少离子抑制。孔德志[48]建立了快速、简便、灵敏的毛细管胶束电动色谱法用以同时分析尼索地平及5种有关物质。CE在药物杂质研究中有很大应用潜力,可为杂质研究提供新的技术手段。
2.5 超临界流体色谱法(SFC)SFC是自20世纪80年代逐渐发展起来的分离分析技术。SFC的流动相以超临界CO2为主,并含有少量的有机溶剂[49],在兼具气相和液相色谱特点的同时,其分析物质的范围更广,包括不适用于采用气相色谱分析的低挥发性、热不稳定物质,且分离分析速度和效率高于液相色谱[50]。在杂质研究中,SFC可用于理化性质差异大的多种杂质分离[51],如Gyllenhaal等[52]应用以甲醇为改性剂的SFC,实现了对氯维地平及5种有关物质的快速分析。
2.6 其他杂质检测技术在杂质分析研究中,除集分离、分析于一体的色谱技术为不可或缺的手段外,一些常用光谱/波谱法如IR、NMR等也在杂质定性研究中起到了举足轻重的作用。这些光谱/波谱分析结果通常与液相色谱质谱分析的数据相结合以确定杂质结构,为推测杂质来源提供支持。如宋志勇[15]采用IR、NMR和ESI-MS分别鉴定了丁酸氯维地平的9种杂质,并进一步明确了副产物的产生机理。
合适的检测方法是能够科学、准确地进行杂质研究的前提条件。杂质检测方法的建立,应在参考药物质量标准以及文献的基础上,结合药物的主成分结构、生产工艺条件及可能存在的杂质情况,选择适宜的检测技术和测定条件进行。这对仿制药的杂质分析同样适用,而不应一味套用现有的标准方法。
3 杂质限度杂质限度的确定需考虑杂质的活性或毒性、生产的可行性、批内和批间药品质量的均一性及每日给药剂量,并兼顾药品的稳定性和分析方法的准确度、精密度[9, 53-55],符合相关技术指导原则如ICH Q3的质控限度要求。
在确定仿制药的杂质限度时,可参考各国药典或相关质量标准中的规定,从已知杂质、未知杂质、总杂质角度进行控制,保证与原研药共有的降解杂质,如二氢吡啶类的氧化产物,不高于原研制剂,共有的中间产物、副产物,含量不大于原研制剂或不超过相关质量标准的限度;仿制药中的特有杂质,如与工艺相关杂质,应明确来源和质量/安全风险,并严格控制其不超过检查限度,杂质总量应符合已有质量标准[56]。在同一检测方法下,相比于参比制剂,在仿制药及其稳定性试验中出现的超过鉴定限度的新杂质,或含量明显高于参比制剂的杂质,则应考虑优化处方与制备工艺,降低杂质含量。如无法降到规定限度,则应对超过限度的杂质做相应的安全性研究[9]。对于经结构确证的基因毒性杂质,应参照ICH M7要求摄入量限度值TTC(threshold of toxicological concern)进行严格控制[28]。
4 结语杂质研究与控制是一项系统工程,应基于质量源于设计的理念,以安全为核心,研究建立科学、合理、专属的分析控制方法。由于仿制药与原研药在原料药的合成工艺、制剂的处方工艺、辅料来源等方面常存在差异,因此在杂质含量及种类、检测方法和限度等方面,不能简单套用已有质量标准进行评价,应根据处方、辅料、生产工艺的不同以及由此带来的可能杂质差异,有针对性地建立合适的分析控制方法。同时也应注意,在不影响药品质量和安全性的前提下,应综合考虑效益/成本以及技术壁垒等因素,对杂质的控制不“过度”。
| [1] |
中华人民共和国药典2015年版.四部[S].2015: 377 ChP 2015.VolⅣ[S].2015: 377 |
| [2] |
戚立凯, 狄斌. 药物杂质研究方法最新进展[J]. 中国药科大学学报, 2015, 46(3): 257. QI LK, DI B. Advances in research on pharmaceutical impurities[J]. J China Pharm Univ, 2015, 46(3): 257. |
| [3] |
高丽, 沈丽萍, 李艳翠. 仿制制剂杂质研究及控制方法[J]. 黑龙江医药科学, 2011, 34(3): 34. GAO L, SHEN LP, LI YC. Impurity research and control method of generic preparation[J]. Heilongjiang Med Pharm, 2011, 34(3): 34. DOI:10.3969/j.issn.1008-0104.2011.03.020 |
| [4] |
张明媛.三种化学药物中有关物质的分析方法研究[D].上海: 第二军医大学, 2013 ZHANG MY.Studies on Analytical Methods of Related Substances in 3 Chemical Drugs[D].Shanghai: The Second Military Medical University, 2013 http://cdmd.cnki.com.cn/Article/CDMD-90030-1013233232.htm |
| [5] |
陈震. 仿制药有关物质检查研究的常见问题分析[J]. 中国医药工业杂志, 2010, 41(4): 305. CHEN Z. Analysis of common issues in related substances study of generic drug[J]. Chin J Pharm, 2010, 41(4): 305. DOI:10.3969/j.issn.1001-8255.2010.04.020 |
| [6] |
杨燕, 吴文辉, 汤庆伟, 等. 基于药品采购数据库的上海市各级医疗机构降压药物利用情况分析[J]. 中国卫生经济, 2016, 35(9): 77. YANG Y, WU WH, TANG QW, et al. Analysis on the antihypertensive drug utilization in medical institutions of Shanghai based on drug bidding database[J]. Chin Health Econ, 2016, 35(9): 77. |
| [7] |
周斌, 吴晓明. 心血管系统用药市场现状与发展趋势[J]. 中国医药工业杂志, 2014, 45(3): S20. ZHOU B, WU XM. Marketing and development trend of cardiovascular system drugs[J]. Chin J Pharm, 2014, 45(3): S20. |
| [8] |
蔡鹏俊, 李悦. 几种沙坦类药物的杂质谱研究现状[J]. 药物分析杂志, 2016, 36(3): 377. CAI PJ, LI Y. Research progress of sartans' impurity profile[J]. Chin J Pharm Anal, 2016, 36(3): 377. |
| [9] |
[H]GPH3-1化学药物杂质研究的技术指导原则[S].2005 [H]GPH3-1 Technical Guidelines for the Study of Chemical Impurities[S].2005 |
| [10] |
刘艳.二氢吡啶类药物尼索地平与非洛地平有关物质的研究[D].咸阳: 陕西中医学院, 2010 LIU Y.The Relevant Material Research of Dihydropyridine Drugs Nisoldipine and Felodipine[D].Xianyang: Shaanxi University of Chinese Medicine, 2010 |
| [11] |
郭栋, 宋嘉熙, 李丹, 等. 手性尼莫地平绝对构型的确定和关联[J]. 物理化学学报, 2016, 32(9): 2241. GUO D, SONG JX, LI D, et al. Determination and correlation of the absolute configurations of chiral nimodipine[J]. Acta Phys Chim Sin, 2016, 32(9): 2241. |
| [12] |
MARCINIEC B, KOZAK M, OGRODOWCZYK M. DSC study of radiostability of 1, 4-dihydropyridine derivatives[J]. J Therm Anal Calorim, 2004, 77(2): 581. DOI:10.1023/B:JTAN.0000038996.14324.34 |
| [13] |
张博.尼莫地平欧洲药典杂质合成与生产过程杂质控制[D].济南: 山东大学, 2012 ZHANG B.The Synthesis of Nimodipine Impurity in EP and the Process Control of Impurity[D].Jinan: Shangdong University, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10422-1013140304.htm |
| [14] |
张亚鲁, 张毅, 陈建超, 等. 苯磺酸氨氯地平有关物质的合成与结构确证[J]. 沈阳药科大学学报, 2015, 32(3): 188. ZHANG YL, ZHANG Y, CHEN JC, et al. Synthesis and structural identification of impurities from amlodipine besylate[J]. J Shenyang Pharm Univ, 2015, 32(3): 188. |
| [15] |
宋志勇.抗高血压药丁酸氯维地平及其杂质标准品合成工艺研究[D].太原: 太原理工大学, 2015 SONG ZY.Study on the Synthetic Pricess of Antipertensive Drug Clevidipine Butyrate and Impurity Standards[D].Taiyuan: Taiyuan University of Technology, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10112-1015602243.htm |
| [16] |
褚小琴, 闫少杰, 李树军, 等. 丁酸氯维地平降解杂质的合成[J]. 合成化学, 2017(1): 80. CHU XQ, YAN SJ, LI SJ, et al. Synthesis of the degradation impurities of clevidipine butyrate[J]. Chin J Synth Chem, 2017(1): 80. |
| [17] |
JAIN D, BASNIWAL PK. Forced degradation and impurity profiling:Recent trends in analytical perspectives[J]. J Pharm Biomed Anal, 2013, 86: 11. DOI:10.1016/j.jpba.2013.07.013 |
| [18] |
[H]GPH4-1化学药物制剂研究基本技术指导原则[S].2005 [H]GPH4-1 Basic Technical Guideline for the Study of Chemical Preparations[S].2005 |
| [19] |
RAIJADA D, CORNETT C, RANTANEN J. A high throughput platform for understanding the influence of excipients on physical and chemical stability[J]. Int J Pharm, 2013, 453(1): 285. DOI:10.1016/j.ijpharm.2012.08.025 |
| [20] |
吴暎, 刘伟, 林萍. HPLC法检测苯磺酸氨氯地平片剂中的乳糖相关杂质[J]. 药学进展, 2013, 37(2): 78. WU Y, LIU W, LIN P. Determination of the lactose-related impurities in amlodipine besylate tablets by HPLC method[J]. Prog Pharm Sci, 2013, 37(2): 78. DOI:10.3969/j.issn.1001-5094.2013.02.005 |
| [21] |
王淼, 陈海珍. 焦糖中相关杂质的测定研究[J]. 中国药品标准, 2014, 15(4): 292. WANG M, CHEN HZ. Study on the determination of impurities in caramel[J]. Drug Stand China, 2014, 15(4): 292. |
| [22] |
李闻新.新型药用辅料磺丁基醚-β-环糊精的质量控制方法研究[D].石家庄: 河北医科大学, 2013 LI WX.Studies on Quality Control Methods of a New Excipient Betadex Sulfobutyl Ether Sodium[D].Shijiazhuang: Hebei Medical University, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10089-1013283636.htm |
| [23] |
LAPANJA N, ZUPANCIC B, CASAR RT, et al. A generic industry approach to demonstrate efficient purification of potential mutagenic impurities in the synthesis of drug substances[J]. Organ Process Res Dev, 2015, 19(11): 1524. DOI:10.1021/acs.oprd.5b00061 |
| [24] |
MULLER L, MAUTHE RJ, RILEY CM, et al. A rationale for determining, testing, and controlling specific impurities in pharmaceuticals that possess potential for genotoxicity[J]. Regul Toxicol Pharmacol, 2006, 44(3): 198. DOI:10.1016/j.yrtph.2005.12.001 |
| [25] |
RAMAN NVVSS, REDDY KR, PRASAD AVSS, et al. Development and validation of RP-HPLC method for the determination of genotoxic alkyl benzenesulfonates in amlodipine besylate[J]. J Pharm Biomed Anal, 2008, 48(1): 227. DOI:10.1016/j.jpba.2008.05.021 |
| [26] |
龚心实, 张斐, 董静, 等. LC-MS/MS法检测盐酸鲁拉西酮中磺酸酯基因毒杂质[J]. 药学与临床研究, 2013, 21(3): 235. GONG XS, ZHANG F, DONG J, et al. Limit test of trace amount of genotoxic substance-sulfonic acid ester in lurasidone hydrochloride by liquid chromatography tandem mass spectrometry[J]. Pharm Clin Res, 2013, 21(3): 235. DOI:10.3969/j.issn.1673-7806.2013.03.010 |
| [27] |
徐丽, 陆晨光. GC-MS法同时检测甲磺酸拉非酰胺中2个磺酸酯基因毒杂质[J]. 山东化工, 2016, 45(6): 46. XU L, LU CG. Determination of potential carcinogenic and genotoxic sulfonate impurities in ralfinamide mesilate by gas chromatography-mass spectrometer[J]. Shandong Chem Ind, 2016, 45(6): 46. DOI:10.3969/j.issn.1008-021X.2016.06.016 |
| [28] |
International Conference on Harmonisation (ICH) M7 Tripartite Guideline.Assessment and Control of DNA Reactive (Mutagenic) Impurities in Pharmaceuticals to Limit Potential Carcinogenic Risk, Current Step 4 version, 23 June[EB/OL].2014[2017-05-01]. http://www.ich.org/products/guidelines/multidisciplinary/article/multidisciplinary-guidelines.html
|
| [29] |
HOLM R, ELDER DP. Analytical advances in pharmaceutical impurity profiling[J]. Eur J Pharm Sci, 2016, 87: 118. DOI:10.1016/j.ejps.2015.12.007 |
| [30] |
刘雁鸣, 龙海燕, 彭琳, 等. HPLC-DAD法对注射用头孢地嗪钠杂质谱的一致性分析研究[J]. 中国药品标准, 2013, 14(3): 170. LIU YM, LONG HY, PENG L, et al. Analysis study on consistency of the impurity profiles of cefodizime sodium for injection by HPLC-DAD[J]. Drug Stand China, 2013, 14(3): 170. DOI:10.3969/j.issn.1009-3656.2013.03.003 |
| [31] |
张明媛, 张军东, 陆峰.基于杂质谱的仿制药质量一致性评价流程研究[C]//2013中国药学大会暨第十三届中国药师周论文集.2013 ZHANG MY, ZHANG JD, LU F.Evaluation procedure for quality consistency of generic drugs based on the impurity profile[C]//The Collection of the China Pharmaceutical Conference and the 13th Chinese Pharmacist Week.2013 |
| [32] |
冯雪松, 董鸿晔. 中药指纹图谱中的数据挖掘技术[J]. 药学进展, 2002, 26(4): 198. FENG XS, DONG HY. Data mining in establishing fingerprint spectrum of Chinese traditional medicines[J]. Prog Pharm Sci, 2002, 26(4): 198. DOI:10.3969/j.issn.1001-5094.2002.04.002 |
| [33] |
吴玲芳, 林琛, 崔雅萍, 等. 基于聚类分析和主成分分析的叶下珠多酚部位HPLC指纹图谱研究[J]. 世界科学技术:中医药现代化, 2015(11): 2285. WU LF, LIN C, CUI YP, et al. HPLC fingerprint of total phenol in Phyllanthus urinaria L.from different habitats based on cluster analysis coupled with principle component analysis[J]. World Sci Technol mod Tradit Chin Med Mater Med, 2015(11): 2285. |
| [34] |
中华人民共和国药典2015年版.二部[S].2015: 623 ChP 2015.VolⅡ[S].2015: 623 |
| [35] |
谢沐风. 如何建立TLC测定药物有关物质的方法[J]. 中国医药工业杂志, 2003, 34(11): 580. XIE MF. How to establish a TLC method for determination of related substances in drugs[J]. Chin J Pharm, 2003, 34(11): 580. DOI:10.3969/j.issn.1001-8255.2003.11.023 |
| [36] |
陈波.尼伐地平原料药的质量控制研究[D].长沙: 中南大学, 2013 CHEN B.Studies on the Quality Control of Nilvadipine[D].Changsha: Central South University, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10533-1014401693.htm |
| [37] |
刘艳华, 吕狄亚, 宋志勇, 等. 反向高效液相色谱法同时测定丁酸氯维地平中10种相关杂质[J]. 分析化学, 2015, 43(2): 257. LIU YH, LU DY, SONG ZY, et al. Development and validation of a high performance liquid chromatographic method for simultaneous determination of ten process-related impurities of clevidipine butyrate[J]. Chin J Anal Chem, 2015, 43(2): 257. |
| [38] |
VOJTA J, JEDLICKA A, COUFAL P, et al. A new, rapid, stability-indicating UPLC method for separation and determination of impurities in amlodipine besylate, valsartan and hydrochlorothiazide in their combined tablet dosage form[J]. J Pharm Biomed Anal, 2015, 109: 36. DOI:10.1016/j.jpba.2015.01.059 |
| [39] |
LIU DQ, SUN M, WU L. Eliminating pharmaceutical impurities:recent advances in detection techniques[J]. Curr Opin Drug Disc Develt, 2010, 13(6): 748. |
| [40] |
ZHOU YX, FAN Z, FEI Y, et al. Structural analysis and quantitative determination of clevidipine butyrate impurities using an advanced RP-HPLC method[J]. J Chromatogr Sci, 2015, 54(3): 3. |
| [41] |
REDDY GVR, KUMAR AP, REDDY BV, et al. Separation, identification and structural elucidation of a new impurity in the drug substance of amlodipine maleate using LC-MS/MS, NMR and IR[J]. Croat Chem Acta, 2010, 83(4): 443. |
| [42] |
TAYLOR GE, GOSLING M, PEARCE A. Low level determination of p-toluenesulfonate and benzenesulfonate esters in drug substance by high performance liquid chromatography/mass spectrometry[J]. J Chromatogr A, 2006, 1119(1-2): 231. DOI:10.1016/j.chroma.2005.11.088 |
| [43] |
KAKADIYA PR, REDDY BP, SINGH V, et al. Low level determinations of methyl methanesulfonate and ethyl methanesulfonate impurities in lopinavir and ritonavir active pharmaceutical ingredients by LC/MS/MS using electrospray ionization[J]. J Pharm Biomed Anal, 2011, 55(2): 379. DOI:10.1016/j.jpba.2011.01.039 |
| [44] |
MIELCAREK J, MATLOKA A. Gas chromatography-mass spectrometry identification of photoproducts of hexahydroquinoline derivatives:potential calcium channel antagonists[J]. J Chromatogr B, 2005, 819(1): 17. DOI:10.1016/j.jchromb.2005.01.014 |
| [45] |
罗功才. 气相色谱法分析尼索地平及其片剂稳定性[J]. 中国药学杂志, 2008, 43(21): 1671. LUO GC. Gas chromatographic analysis of nisoldipine and the stability of its tablets[J]. Chin Pharm J, 2008, 43(21): 1671. DOI:10.3321/j.issn:1001-2494.2008.21.020 |
| [46] |
李月秋. 毛细管电泳在医药学中的应用[J]. 黑龙江医药, 2008, 21(3): 31. LI YQ. Applications of capillary electrophoresis in medicine[J]. Heilongjiang Med J, 2008, 21(3): 31. |
| [47] |
高峰, 周亭亭, 苑广信. 毛细管分析技术的应用与展望[J]. 中国医药科学, 2012, 2(2): 45. GAO F, ZHOU TT, YUAN GX. Application and prospect of capillary electrophoresis analysis technology[J]. China Med Pharm, 2012, 2(23): 45. |
| [48] |
孔德志.间尼索地平质量控制与药代动力学研究[D].石家庄: 河北医科大学, 2010 KONG DZ.Studies on Quality Control and Pharmacokinetics of m-Nisoldipine[D].Shijiazhuang: Hebei Medical University, 2010 http://cdmd.cnki.com.cn/Article/CDMD-11919-2010248252.htm |
| [49] |
张晶, 陈晓东, 李丽群, 等. 超临界流体色谱与高效液相色谱分离手性化合物的比较[J]. 色谱, 2016, 34(3): 321. ZHANG J, CHEN XD, LI LQ, et al. Comparative separation of chiral compounds by supercritical fluid chromatography and high performance liquid chromatography[J]. Chin J Chromatogr, 2016, 34(3): 321. |
| [50] |
张怡评, 洪专, 方华, 等. 超临界流体色谱分离技术应用研究进展[J]. 中医药导报, 2012, 18(7): 89. ZHANG YP, HONG Z, FANG H, et al. Research progress of supercritical fluid chromatography separation technology[J]. Guid J Tradit Chin Med Pharm, 2012, 18(7): 89. DOI:10.3969/j.issn.1672-951X.2012.07.043 |
| [51] |
SAMOKHIN AS, REVELSKY IA, CHEPELYANSKY DA, et al. Supercritical fluid chromatography and its application to analysis and preparation of high-purity compounds[J]. Russ J Phys Chem B, 2012, 6(7): 769. DOI:10.1134/S1990793111080100 |
| [52] |
GYLLENHAAL O, KARLSSON A, VESSMAN J. Packed-column supercritical fluid chromatography for the purity analysis of clevidipine, a new dihydropyridine drug[J]. J Chromatogr A, 1999, 862(1): 95. |
| [53] |
张哲峰, 魏农农, 鲁爽. 浅谈杂质限度制定的一般原则[J]. 中国新药杂志, 2008, 17(16): 1457. ZHANG ZF, WEI NN, LU S. Common principle in establishing the limitation[J]. Chin J New Drugs, 2008, 17(16): 1457. DOI:10.3321/j.issn:1003-3734.2008.16.023 |
| [54] |
陈震. 有关物质的研究与新药注册[J]. 中国医药工业杂志, 2010, 41(11): 872. CHEN Z. Study on related substances and new drug application[J]. Chin J Pharm, 2010, 41(11): 872. DOI:10.3969/j.issn.1001-8255.2010.11.020 |
| [55] |
何伍, 王海学. 浅谈药物杂质限度的制订方法[J]. 中国医药工业杂志, 2009, 40(10): 787. HE W, WANG HX. General consideration for validation of impurity limitation in drug development[J]. Chin J Pharm, 2009, 40(10): 787. |
| [56] |
谢沐风. 再谈仿制药研发中杂质研究思路之我见[J]. 中国医药工业杂志, 2015, 46(5): 538. XIE MF. Re-discussion on the studies of related substances in generic drugs[J]. Chin J Pharm, 2015, 46(5): 538. |
 2018, Vol. 38
2018, Vol. 38 












