2. 天津市现代中药质量检验中心, 天津 300381;
3. 天津市农业质量标准与检测技术研究所, 天津 300381
2. Tianjin Center for Quality Testing of TCM, Tianjin 300381, China;
3. Tianjin Institute of Agricultural Quality Standard and Testing Technology, Tianjin 300381, China
知母(Anemarrhena asphodeloides Bge.)为百合科植物知母干燥的根茎,在我国许多地区都有种植,具有清热泻火、滋阴润燥等功效,主治高热烦渴、肺热燥渴、骨蒸潮热、内热消渴、肠燥便秘[1-3]。知母经酒制后可改变其药物的药性,引药上行,加强清上焦热、止咳等作用;酒制知母在炮制过程中带入乙醇,乙醇对脂溶性成份具有增溶作用,从而加强知母的镇静作用[4-6]。知母皂苷BⅡ是知母中的主要甾体皂苷 ,具有抗肿瘤,降血糖,改善记忆力,降内热等药理作用;芒果苷是知母中主要的双苯吡酮类成分,具有清热,抗炎,抗病毒,免疫调节等作用[7-10]。现今国内外对知母的研究主要分为功能性成分、药理性质以及炮制方法等方面,在知母多种炮制方法中盐制知母报道文献较多,酒制知母成分研究报道较少。传统炮制方法是将知母用黄酒拌匀,焖润至吸尽,置于锅内,用文火炒制微黄,取出,放凉,即可[6];由于没有具体工艺参数和质量标准,可操作性差,缺乏炮制工艺统一性。本文以知母皂苷BⅡ与芒果苷为参考指标,利用正交试验优化的炮制工艺,为酒知母的质量控制提供依据。
1 材料与仪器 1.1 材料知母:安国市惠农中药材良种繁育有限公司提供;对照品芒果苷(批号111607-201402)、知母皂苷BII(批号111839-201102)均购自中国食品药品检定研究院;乙醇和丙酮为分析纯,均购自天津市风船化学试剂科技有限公司;乙腈(HPLC级)购自Merck公司;冰乙酸(HPLC级)购自天津光复精细化工研究所;超纯水,高纯氮。
1.2 仪器Waters公司2695高效液相色谱仪,2996紫外检测器,2424蒸发光检测器,AS系列超声波清洗器(天津Autoscience仪器有限公司);METTLER AB54,METTLER XS 205电子分析天平。
2 方法 2.1 色谱条件 2.1.1 知母皂苷BⅡ色谱柱:CAPCELL PAK C18(5 μm,4.6 mm×250 mm);流动相:乙腈-水(25:75);流速:1.0 mL·min-1;柱温:30 ℃;进样体积:10 μL。色谱图见图 1。
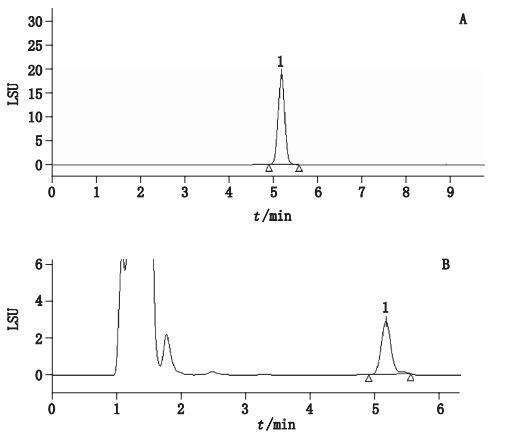
|
1.知母皂苷BⅡ(timosaponin BⅡ) 图 1 对照品(A)及样品(B)HPLC色谱图 Figure 1 HPLC chromatograms of reference substance(A)and sample(B) |
色谱柱:Waters Symmetry C18(5 μm,4.6 mm×150 mm);流动相:乙腈-0.2%乙酸溶液(15:85);流速:1.0 mL·min-1,柱温:30 ℃;检测波长:258 nm;进样量:10 μL。色谱图见图 2。
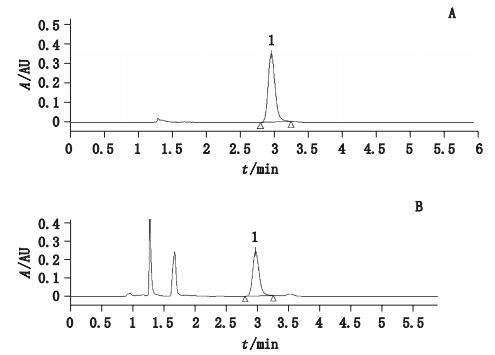
|
1.芒果苷(mangiferin) 图 2 对照品(A)及样品(B)HPLC色谱图 Figure 2 HPLC chromatograms of reference substance(A)and sample(B) |
精密称取知母皂苷BⅡ对照品,加30%丙酮水溶液制成0.349 mg·mL-1的溶液;另取芒果苷对照品,精密称定,加50%乙醇水溶液制成53.3 μg·mL-1的溶液。
2.3 供试品溶液制备 2.3.1 知母皂苷BⅡ取本品粉末(过3号筛)0.15 g,精密称定,置具塞锥形瓶中,精密加入30%丙酮水溶液25 mL,称量,超声(50 W,40 kHz)处理30 min,取出,放冷,再称量,用30%丙酮补足减失的量,摇匀,滤过,取续滤液用于知母皂苷BⅡ的测定。
2.3.2 芒果苷取本品粉末(过3号筛)0.10 g,精密称定,置具塞锥形瓶中,精密加入50%乙醇水溶液25 mL,称量,超声(50 W,40 kHz)处理30 min,放冷,再称量,用50%乙醇补足减失的量,摇匀,滤过,取续滤液用于芒果苷含量测定。
2.4 线性关系考察分别精密吸取知母皂苷BⅡ对照品溶液和芒果苷对照品溶液各1、5、10、15、20、25 μL进样测定,以对照品峰面积的对数与对照品进样质量对数绘制标准曲线,知母皂苷BⅡ与芒果苷的回归方程分别为:
Y=0.684 2X+0.393 3 r=1.000
Y=35 814X-22 040 r=0.999 6
知母皂苷BⅡ质量浓度在34.9~872.5 μg·mL-1,芒果苷质量浓度在5.33~133.3 μg·mL-1范围内线性关系良好。
2.5 精密度试验精密吸取同一知母皂苷BⅡ对照品溶液与芒果苷对照品溶液连续进样6次,测得知母皂苷BⅡ峰面积的RSD为0.73%,芒果苷峰面积的RSD为0.11%,结果可知,相同条件下知母皂苷BⅡ与芒果苷精密度良好。
2.6 重复性试验取同一样品,分别称取6份,同“2.3”项下供试品溶液的步骤提取,进样,测定知母皂苷BⅡ含量的RSD为1.7%,芒果苷含量的RSD为1.2%。结果表明,知母中知母皂苷BⅡ与芒果苷重复性良好。
2.7 回收率试验取同一样品称取6份,每份0.10 g,各加入0.349 mg·mL-1知母皂苷BⅡ对照品溶液0.5 mL,同“2.3.1”项下知母皂苷BⅡ供试品溶液的制备步骤操作,进样测定;另取同一样品6份,每份0.10 g,加入53.3 μg·mL-1芒果苷对照品溶液各1.0 mL,同“2.3.2”项下芒果苷供试品溶液的制备步骤操作,进样测定。结果知母皂苷BⅡ平均回收率为94.1%,RSD为2.1%;芒果苷平均回收率为98.7%,RSD为1.3%。
3 实验结果与讨论 3.1 单因素试验 3.1.1 酒用量的选择取黄酒5、10、15、20、25 g,分别加水至25 mL,将其均匀地分别喷洒在100 g知母药材饮片上,焖至60 min后,置锅内,用130 ℃火炒制15 min,取出,晾干,筛去灰屑得酒知母饮片,粉碎过3号筛,即得样品粉末。按“2.3”项下方法制备供试品溶液,进样测得知母皂苷BⅡ的含量分别为4.03%、4.16%、4.17%、4.34%、4.57%,芒果苷的含量分别为1.24%、1.35%、1.42%、1.47%、1.52%。由结果可知,知母皂苷BⅡ和芒果苷的含量随酒浓度的增大而增高,故选择15、20、25 g为正交试验优化的3个水平因素。
3.1.2 焖制时间的选择取黄酒15 g,加水至25 mL,将其均匀喷洒在100 g知母药材饮片上,焖至30、60、90、120、150 min后,置锅内,用130 ℃火炒制15 min,取出,晾干,筛去灰屑得酒知母饮片,粉碎过3号筛,即得样品粉末。按“2.3”项下方法制备供试品溶液,进样测得知母皂苷BⅡ的含量分别为4.01%、4.86%、5.09%、4.91%、4.56%,芒果苷的含量分别为1.23%、1.36%、1.42%、1.47%、1.45%。由结果可知,随着焖制时间的延长,知母皂苷BⅡ和芒果苷的含量有着不同的变化,为了使2个成分含量可以统一优化,选择60、90、120 min为正交试验优化的3个水平因素。
3.1.3 炒制温度的选择取黄酒15 g,加水至25 mL,将其均匀喷洒在100 g知母药材饮片上,焖至60 min后,置锅内,在100、130、160、190、220 ℃文火炒制10 min取出,晾干,筛去灰屑得酒知母饮片,粉碎过3号筛,即得样品粉末。按“2.3”项下方法制备供试品溶液,进样测得知母皂苷BⅡ的含量分别为3.72%、3.79%、4.31%、4.32%、4.65%,芒果苷的含量分别为1.33%、1.45%、1.49%、1.41%、1.40%。由结果可知,知母皂苷BⅡ的含量随炒制温度增加而升高,芒果苷的含量在炒制温度为100~160 ℃时随温度的升高而增加,但当达到一定温度时其含量逐渐降低,考虑炒制温度对芒果苷含量的影响,选择130、160、190 ℃为正交试验优化的3个水平因素。
3.1.4 炒制时间的选择取黄酒15 g,加水至25 mL,将其均匀喷洒在100 g知母药材饮片上,焖至60 min后,置锅内,在130 ℃火分别炒制5、10、15、20、25 min,取出,晾干,筛去灰屑得酒知母饮片,粉碎过3号筛,即得样品粉末。按“2.3”项下方法制备供试品溶液,进样测得知母皂苷BⅡ的含量分别为3.92%、4.29%、4.21%、4.52%、4.55%,芒果苷的含量分别为1.13%、1.20%、1.34%、1.41%、1.49%。由结果可知,知母皂苷BⅡ和芒果苷的含量随着炒制时间的延长而提高,故选择15、20、25 min为正交试验优化的3个水平因素。
3.2 正交试验与结果在前期单因素试验的基础上,选用L9(34)正交表(见表 1),以知母皂苷BⅡ和芒果苷为指标,选择黄酒用量(A)、焖制时间(B)、炒制温度(C)和炒制时间(D)4个因素进行比较。按照“2.3”项下方法制备供试品溶液,精密取10 μL进样,依据“2.1”项下色谱条件测定,得到各正交试验结果见表 2,方差分析结果见表 3。
|
|
表 1 L9(34)因素水平表 Table 1 L9(34)factor level table |
|
|
表 2 L9(34)正交试验设计与结果 Table 2 Design and results of L9(34)orthogonal test |
|
|
表 3 方差分析 Table 3 Analysis of variance |
根据表 3结果可以看出,因素影响主次顺序为D > B > C > A,因素D(炒制时间)对试验结果有显著的影响,而因素A(酒用量)、B(焖制时间)、C(炒制温度)对试验结果虽有一定的影响,但未有显著差异。按表 2中各因素最高值,选出最佳炮制工艺为A1B2C3D3,从而得到本实验酒制知母正交试验最佳炮制方案为:取黄酒15 g,加水至25 mL,将其均匀喷洒在100 g知母药材饮片上,焖至90 min后,置锅内,用190℃火分别炒制25 min,取出,晾干,筛去灰屑得酒知母饮片,粉碎过3号筛,即得样品粉末。
验证试验:取知母3份各100 g,分别按最佳炮制方案制备酒知母,以“2.3”项下方法制备供试品溶液进样,测得知母皂苷BⅡ含量分别为6.32%、6.15%、6.27%,芒果苷含量分别为1.51%、1.47%、1.49%,其综合评分分别为7.74%、7.62%、7.76%,其RSD为1.4%,通过验证试验结果可以看出,优选的酒制知母的炮制工艺较稳定。
知母有炒炙、酒炙、盐炙、麸炙等炮制方法。有文献报道,知母酒炙后知母皂苷BⅡ的含量有所下降,这是因为黄酒的加入对其溶出起到了一定程度的抑制作用,知母经酒制后知母皂苷AⅠ和知母皂苷AⅢ的含量显著升高,有可能是醇的加入使知母皂苷BⅡ在炒制加热的过程中发生反应,这一可能性有待考察[11];芒果苷含量有所升高,是因为炮制过程中醇的引入与加热使药材质地变得疏松,有利于芒果苷的溶出,另一种可能是炮制过程中新芒果苷转化为芒果苷,导致芒果苷的含量在炮制过程中含量上升[12-13],这种现象还需经过试验验证。本研究为酒炙知母的炮制条件提供了技术参考,酒炙知母的炮制方法还需考虑其他因素,并结合更多指标进行深入的研究。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 212 ChP 2015.Vol Ⅰ[S].2015: 212 |
| [2] |
孙兴华, 张宇伟, 陈芳芳, 等. 知母中化学成分的研究[J]. 海峡药学, 2015, 27(8): 40. SUN XH, ZHANG YW, CHEN FF, et al. Constituents from Anemarrhena asphodeloides Bge.[J]. Strait Pharm J, 2015, 27(8): 40. DOI:10.3969/j.issn.1006-3765.2015.08.015 |
| [3] |
李国龙, 杨洁, 段金廒, 等. 不同产地知母药材质量分析评价[J]. 中药材, 2015, 38(6): 1148. LI GL, YANG J, DUAN JA, et al. Quality analysis and evaluation of Anemarrhena asphodeloides rhizome from different habitats[J]. J Chin Med Mater, 2015, 38(6): 1148. |
| [4] |
赵阳, 康利平, 余河水, 等. 利用UHPLC/Q-TOF MS技术进行7个甾体皂苷含量测定[J]. 中国药学, 2013, 22(3): 226. ZHAO Y, KANG LP, YU HS, et al. Simultaneous determination of steroidal saponins in Anemarrhena asphodeloides Bge.by ultra high-performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. J Chin Pharm Sci, 2013, 22(3): 226. |
| [5] |
崔玲玲, 季德, 袁永亮, 等. 知母酒炙前后指纹图谱的比较及对α-葡萄糖苷酶抑制作用的比较研究[J]. 海峡药学, 2016, 28(4): 43. CUI LL, JI D, YUAN YL, et al. Comparison of fingerprints and inhibitory activities on α-glucosidase of crude and processed Rhizoma comparison on fingerprint and inhibitory activities on α-glucosidase of crude and processed Rhizoma Anemarrhena[J]. Strait Pharm J, 2016, 28(4): 43. DOI:10.3969/j.issn.1006-3765.2016.04.014 |
| [6] |
李习平, 杨梓, 石继连, 等. 不同炮制方法对知母中芒果苷含量的影响[J]. 时珍国医国药, 2011, 22(10): 2502. LI XP, YANG Z, SHI JL, et al. Effect of different processing methods on mangiferin content in Rhizoma Anemarrhenae[J]. Lishizhen Med Mater Med Res, 2011, 22(10): 2502. DOI:10.3969/j.issn.1008-0805.2011.10.084 |
| [7] |
冯倩茹, 高妮. 知母常用炮制工艺的比较研究[J]. 临床医学工程, 2012, 19(5): 815. FENG QR, GAO N. A comparative study on processing technology of Anemarrhenae Rhizoma[J]. Clin Med Eng, 2012, 19(5): 815. DOI:10.3969/j.issn.1674-4659.2012.05.0815 |
| [8] |
马河, 刘园华, 张金杰. 知母水溶性小分子提取物对胰岛素抵抗HepG2细胞体外糖代谢的影响[J]. 食品与药品, 2013, 15(1): 26. MA H, LIU YH, ZHANG JJ. Effect of water-soluble small molecule extract in Anemarrhenae Rhizoma on glucose metabolism in insulin-resistant HepG2 cells[J]. Food Drug, 2013, 15(1): 26. DOI:10.3969/j.issn.1672-979X.2013.01.009 |
| [9] |
路明珠, 张治强, 伊佳, 等. 知母皂苷B-Ⅱ抗抑郁作用及其机制研究[J]. 药学实践杂志, 2010, 28(4): 283. LU MZ, ZHANG ZQ, YI J, et al. Study on the effect and mechanisms of timosaponin B-Ⅱ on antidepressant[J]. J Pharm Pract, 2010, 28(4): 283. DOI:10.3969/j.issn.1006-0111.2010.04.014 |
| [10] |
张志斐, 肖蓉, 袁志芳, 等. 河北道地药材知母HPLC-ELSD指纹图谱研究[J]. 药物分析杂志, 2006, 26(11): 1569. ZHANG ZF, XIAO R, YUAN ZF, et al. Studies on HPLC-ELSD fingerprints of crude Rhizoma Anemarrhenae from Hebei Province[J]. Chin J Pharm Anal, 2006, 26(11): 1569. |
| [11] |
赵璐璐, 刘菲菲, 彭缨, 等. 高效液相色谱法考察不同炮制方法对知母中5种主要化学成分的影响[J]. 色谱, 2012, 12(30): 1271. ZHAO LL, LIU FF, PENG Y, et al. Effects of different processing methods on five main chemical constituents of Anemarrhena asphodeloides Bge.studied by high performance liquid chromatography[J]. Chin J Chromatogr, 2012, 12(30): 1271. |
| [12] |
魏静娜, 刘正辉, 赵琳琳, 等. 知母的盐制工艺优化[J]. 辽宁中医杂志, 2015, 42(6): 1294. WEI JN, LIU ZH, ZHAO LL, et al. Optimization of salted processing for Anemarrhena[J]. Liaoning J Tradit Chin Med, 2015, 42(6): 1294. |
| [13] |
宋泽璧, 吴莹, 高慧. HPLC法测定盐炙前后知母中新芒果苷、芒果苷和异芒果苷[J]. 现代药物与临床, 2015, 30(2): 145. SONG ZB, WU Y, GAO H. Determination of neomangiferin, mangiferin, and isomangiferin in Anemarrhenae Rhizoma before and after stir-frying with salt-water by HPLC[J]. Drugs Clin, 2015, 30(2): 145. |
 2018, Vol. 38
2018, Vol. 38 
