2. 江苏省常州市药品检验所, 常州 213002
2. Changzhou Institute for Drug Control, Changzhou 213002, China
盐酸溴己新较早收载于《中华人民共和国药典》(以下简称《中国药典》)1977年版,名称为盐酸溴己胺,《中国药典》1985年版更名为盐酸溴己新。盐酸溴己新注射剂可以直接作用于支气管腺体使痰中的黏多糖纤维裂解,痰液变薄,同时抑制黏液腺和杯状细胞中酸性糖蛋白合成,使痰液中酸性黏多糖成分含量降低,从而使痰黏度降低,还可促进呼吸道黏膜的纤毛运动,常用于呼吸道疾病中黏痰不易咳出的患者[1-2]。目前,国内生产的盐酸溴己新注射剂包括注射用盐酸溴己新(4 mg,粉针)、盐酸溴己新葡萄糖注射液(4 mg:100 mL,输液)和盐酸溴己新注射液(4 mg:2 mL,水针)共3种类型。国家食品药品监督管理总局(CFDA)网站公布的生产企业中,粉针生产企业13家,输液生产企业2家,注射液生产企业3家。
2017年盐酸溴己新注射剂的国家药品评价抽验工作,基本覆盖了全国范围本药品近几年在生产、销售及应用等各个流通环节的有效期药品252批次,涵盖粉针药品企业9家,输液药品企业2家和注射液药品企业3家。本文着重介绍了这次工作中有关盐酸溴己新注射剂的质量标准研究情况,为该药品质量控制提供较全面的科学依据,以保证其有效性、安全性和稳定性。
1 仪器与试药 1.1 仪器Mettler-Toledo XP205电子天平,Shimadzu UV-2600分光光度计,Shimadzu LC-10AT高效液相色谱,Mermert UNB-200烘箱,Mettler-Toledo DL-31水分仪。
1.2 试药盐酸溴己新对照品(中国食品药品检定研究院,含量99.9%,批号100427-201102)。注射用盐酸溴己新(规格:4 mg),盐酸溴己新葡萄糖注射液(4 mg:100 mL),盐酸溴己新注射液(4 mg:2 mL)。
2 方法与结果 2.1 注射用盐酸溴己新(粉针)注射用盐酸溴己新的统一标准WS1-XG-022-2016已经颁布,并于本次国抽的开始阶段(2017年4月1日)正式施行,此次国家药品抽样的最后阶段(2017年7~8月)也抽到了执行粉针剂统一标准的晋城海斯制药有限公司、广州一品红制药有限公司和江苏九旭药业有限公司这3个药品企业的样本,因此围绕新旧执行标准开展了9家粉针制剂厂家(表 1)药品的对比研究[3-20],探讨注射用盐酸溴己新统一标准WS1-XG-022-2016[20]的合理性和科学可靠性。
|
|
表 1 注射用盐酸溴己新制剂生产企业的样品情况 Table 1 Sample information of Bromhexine Hydrochloride for Injection from various pharmaceutical enterprises |
新近生效的粉针统一标准WS1-XG-022-2016主要对水分(或者干燥失重)检查、有关物质检查和含量测定等项目进行了标准统一,因此本次注射用盐酸溴己新的标准研究着重对标准的上述3个方面进行了研究。通过对9家药品企业的样本进行相关项目的标准检查结果比对研究,正式施行的统一标准WS1-XG-022-2016可以有效地监控本制剂质量。
2.1.1 水分/干燥失重检查9家药品企业样本的主要成分均为盐酸溴己新和甘露醇,其中甘露醇熔点约166 ℃,沸点为290~295 ℃;盐酸溴己新熔点约239 ℃,熔融同时分解,105 ℃或者50 ℃真空干燥的条件都能较好地检测样品中的挥发性物质。研究结果(详见表 2)显示无论是干燥失重还是水分的检测值均不大于0.6%,远低于2.0%~6.0%的标准限度;水分和干燥失重2种检查方法的研究结果无明显差异,反映出各粉针制剂药品企业的冻干工艺控制较好,水分外未检出其他易挥发性物质,标准中的水分检查可以替代干燥失重项目监控制剂的关键质量参数,统一标准WS1-XG-022 -2016在本项目选择水分检查的设置是稳妥可靠的。
|
|
表 2 各家粉针药品企业样本的水分和干燥失重检查情况(%) Table 2 Water and loss on drying of samples from various pharmaceutical enterprises |
较全面地比较研究了标准统一前后9家药品企业样本的各检测方法对有关物质的检测能力,对各检测方法单个最大杂质和总杂质的含量检查结果进行了对比,研究结果详见表 3。
|
|
表 3 各家粉针药品企业样本的有关物质检查情况(%) Table 3 Related substances of samples from various pharmaceutical enterprises |
研究显示,标准统一前后9家药品企业样本有关物质检查的结果不论是杂质数目还是杂质含量的检测情况(包括单个最大杂质含量和总杂质含量)均无明显差异,各药品企业样本在统一标准WS1-XG-022-2016的色谱条件下,保留时间2.5 min到8 min之间(主峰保留时间约8.5 min)呈现3~5个较小杂质峰,杂质含量一般小于0.08%,总杂质含量均控制在0.2%的较低水平之下;证实统一标准WS1-XG-022-2016的有关物质检查方法可以有效地监控各粉针制剂厂家的杂质情况,本药品整体质量较好。
2.1.3 含量测定含量测定方面,统一标准WS1-XG-022-2016采用了现在标准通用的专属性较好的HPLC法对粉针制剂进行质量控制,鉴于标准统一前部分企业的执行标准是采用测定UV法含量,本次粉针制剂标准研究考察了UV对照品法和HPLC对照品法的含量测定情况(详见表 4),研究显示2种质控方法并无明显差异。
|
|
表 4 各家粉针药品企业样本的含量测定情况 Table 4 Assay of samples from various pharmaceutical enterprises |
盐酸溴己新葡萄糖注射液的标准统一工作也基本完成,尚未正式颁布执行,标准中有关5-羟甲基糠醛检查可能存有争议,本次输液标准研究着重对UV法和HPLC法2种检查5-羟甲基糠醛的方法进行了对比研究。两者都可以准确测定5-羟甲基糠醛的含量,重现性好,线性好,差异较小,均可作为5-羟甲基糠醛的质量控制方法;但简单、方便、快速且仪器配置更为普遍的UV法,检测灵敏度完全可以达到制剂中5-羟甲基糠醛限度控制(0.02%)的要求,而且UV法限度检查完全不需要使用5-羟甲基糠醛对照品,依然是基层药品检验单位较为理想的盐酸溴己新葡萄糖注射液5-羟甲基糠醛检查方法。因此,建议即将颁布的输液制剂统一标准不采用HPLC法替代现行标准[21-24]中的UV法检查5-羟甲基糠醛。
2.3 盐酸溴己新注射液(水针)盐酸溴己新注射液是本品的原研剂型,国内3家水针制剂药品企业均执行国家标准WS-10001-(HD-0565)-2002[25],该标准在本品众多标准中年代最为久远,更新最为缓慢,标准甚至没有细菌内毒素和有关物质检查项目的设置;显然,2002年的国家标准在有关物质检查等关键质控项目方面的缺失已经无法满足现在药品质量监控的需求,但新统一的质量标准还未正式颁布。上海旭东海普药业有限公司向国家药典委员会申报标准更新,并于2017年1月正式获批新标准YBH00102017[26],已经新增订了相关标准检验项目,只是因为原料药的因素该企业自此尚未有制剂生产;鉴于有关物质检查在制剂质量控制中的重要作用,特别是注射剂剂型在本项目限度要求上尤为严格,针对该制剂标准的研究侧重于3家水针药品企业样本的有关物质情况,研究结果见表 5。
|
|
表 5 盐酸溴己新注射液有关物质检查情况(%) Table 5 Related substances of Bromhexine Hydrochloride Injection from various pharmaceutical enterprises |
HPLC分析图谱(图 1)显示,3家水针药品企业样本的杂质出峰和含量大小基本一致,结果见表 5,可见本制剂的有关物质控制得较好;标准规定单个最大杂质和总杂质的含量限度分别为0.2%和0.5%,结果显示所有药品企业样本的总杂质含量均未超过0.2%,特别关注上海旭东海普药业有限公司临近效期的2批抽检样品(批号AN140601和AN140602)杂质含量仍然保持在0.1%以下,有关物质考察的整体情况比较满意。
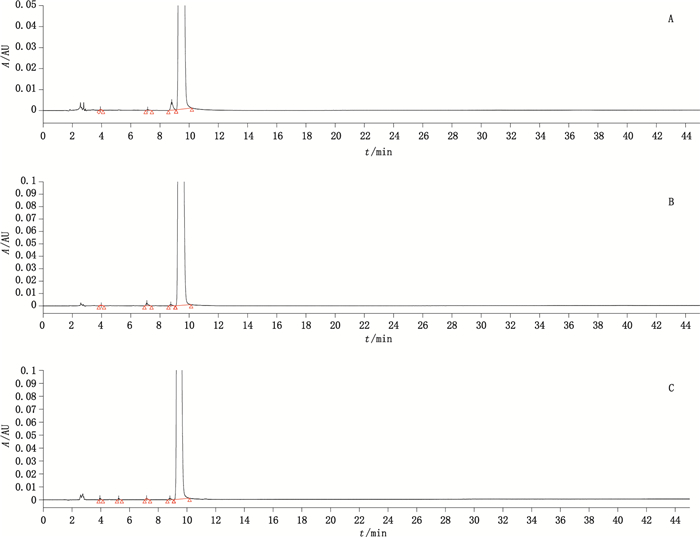
|
A.上海旭东海普药业有限公司(Shanghai Xudong Haipu Pharmaceutical Co.,Ltd.)B.华润双鹤药业股份有限公司(CR Double-Crane Pharmaceutical Co.,Ltd.)C.山东圣鲁制药有限公司(Shandong Sheng’lu Pharmaceutical Co.,Ltd.) 图 1 盐酸溴己新注射液典型色谱图 Figure 1 Typical chromatograms of bromhexine hydrochloride injection |
目前盐酸溴己新注射剂(包括注射用盐酸溴己新、盐酸溴己新葡萄糖注射液和盐酸溴己新注射液共计3种注射剂类型)的法定检验标准多达28个,国家药典委员会已经基本完成了本药品3类制剂的标准统一工作。2017年正式施行的注射用盐酸溴己新的统一标准WS1-XG-022-2016可以有效地监控本制剂质量;现行的盐酸溴己新葡萄糖注射液标准良好,现行标准中的5-羟甲基糠醛检查(UV法)灵敏度完全可以达到制剂中5-羟甲基糠醛限度控制要求,若标准进一步明确总杂质检查不再包含独立的5-羟甲基糠醛检查将更为妥帖;目前仍在执行的盐酸溴己新注射液国家标准WS-10001-(HD-0565)-2002缺失内毒素和有关物质检查项目,已经不能较全面地监控该剂型药品的质量情况,个别企业有意识地申报更新并于2017年获批的标准YBH00102017有着更合理的项目设置,也建议尽快颁布本品种水针制剂的更新统一标准,以便更科学、合法地监控该剂型的质量情况。
| [1] |
李桂芳. 盐酸溴己新葡萄糖注射液治疗小儿肺炎的疗效分析[J]. 临床医学研究与实践, 2017, 2(19): 75. LI GF. Therapeutic effect of bromhexine hydrochloride dextrose injection on infantile pneumonia[J]. Clin Res Pract, 2017, 2(19): 75. |
| [2] |
张丹. 大剂量盐酸溴己新对ARDS患者脱机时间的影响[J]. 中南医学科学杂志, 2017, 45(6): 555. ZHANG D. Effect of high dose hydrochloride bromhexine on offline time of ARDS patients[J]. Med Sci J Cent South China, 2017, 45(6): 555. |
| [3] |
YBH10962005注射用盐酸溴己新[S].2005 YBH10962005 Bromhexine Hydrochloride for Injection [S].2005 |
| [4] |
YBH10962005-2015Z注射用盐酸溴己新[S].2015 YBH10962005-2015Z Bromhexine Hydrochloride for Injection [S].2015 |
| [5] |
YBH20512005注射用盐酸溴己新[S].2005 YBH20512005 Bromhexine Hydrochloride for Injection [S].2005 |
| [6] |
YBH20512005-2015Z注射用盐酸溴己新[S].2015 YBH20512005-2015Z Bromhexine Hydrochloride for Injection [S].2015 |
| [7] |
YBH11082005注射用盐酸溴己新[S].2005 YBH11082005 Bromhexine Hydrochloride for Injection [S].2005 |
| [8] |
YBH11082005-2015Z注射用盐酸溴己新[S].2015 YBH11082005-2015Z Bromhexine Hydrochloride for Injection [S].2015 |
| [9] |
YBH21902005注射用盐酸溴己新[S].2005 YBH21902005 Bromhexine Hydrochloride for Injection [S].2005 |
| [10] |
YBH21902005-2015Z注射用盐酸溴己新[S].2015 YBH21902005-2015Z Bromhexine Hydrochloride for Injection [S].2015 |
| [11] |
YBH05932005注射用盐酸溴己新[S].2005 YBH05932005 Bromhexine Hydrochloride for Injection [S].2005 |
| [12] |
YBH05932005-2015Z注射用盐酸溴己新[S].2015 YBH05932005-2015Z Bromhexine Hydrochloride for Injection [S].2015 |
| [13] |
YBH01902007注射用盐酸溴己新[S].2007 YBH01902007 Bromhexine Hydrochloride for Injection [S].2007 |
| [14] |
YBH18132005注射用盐酸溴己新[S].2005 YBH18132005 Bromhexine Hydrochloride for Injection [S].2005 |
| [15] |
YBH18132005-2015Z注射用盐酸溴己新[S].2015 YBH18132005-2015Z Bromhexine Hydrochloride for Injection [S].2015 |
| [16] |
YBH19442005注射用盐酸溴己新[S].2005 YBH19442005 Bromhexine Hydrochloride for Injection [S].2005 |
| [17] |
YBH19442005-2015Z注射用盐酸溴己新[S].2015 YBH19442005-2015Z Bromhexine Hydrochloride for Injection [S].2015 |
| [18] |
YBH40522005注射用盐酸溴己新[S].2005 YBH40522005 Bromhexine Hydrochloride for Injection [S].2005 |
| [19] |
YBH40522005-2015Z注射用盐酸溴己新[S].2015 YBH40522005-2015Z Bromhexine Hydrochloride for Injection [S].2015 |
| [20] |
WS1-XG-022-2016注射用盐酸溴己新[S].2016 WS1-XG-022-2016 Bromhexine Hydrochloride for Injection [S].2016 |
| [21] |
YBH04412004盐酸溴己新葡萄糖注射液[S].2004 YBH04412004 Bromhexine Hydrochloride and Glucose Injection [S].2004 |
| [22] |
YBH04412004-2016Z盐酸溴己新葡萄糖注射液[S].2016 YBH04412004-2016Z Bromhexine Hydrochloride and Glucose Injection [S].2016 |
| [23] |
YBH10902004盐酸溴己新葡萄糖注射液[S].2004 YBH10902004 Bromhexine Hydrochloride and Glucose Injection [S].2004 |
| [24] |
YBH10902004-2016Z盐酸溴己新葡萄糖注射液[S].2016 YBH10902004-2016Z Bromhexine Hydrochloride and Glucose Injection [S].2016 |
| [25] |
国家药品标准: 化学药品地方标准上升国家标准.第6册[S].2002: 207 National Drug Standards: National Standards for Chemicals Promoted from Local Standards.Vol 6[S].2002: 207 |
| [26] |
YBH00102017盐酸溴己新注射液[S].2017 YBH00102017 Bromhexine Hydrochloride Injection [S].2017 |
 2018, Vol. 38
2018, Vol. 38 
