2. 中国食品药品检定研究院 国家药物安全评价监测中心, 北京 100176;
3. 中国医学科学院 药物研究所, 北京 100050;
4. 军科正源(北京)药物研究有限责任公司, 北京 102206;
5. 东莞凡恩世生物医药有限公司, 东莞 523808
2. National Center for Safety Evaluation of Drugs, National Institutes for Food and Drug Control, Beijing 100176, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China;
4. United-Power Pharma Tech Co., Ltd., Beijing 102206, China;
5. Phanes Therapeutics Co., Ltd., Dongguan 523808, China
溶血是指血液中的红细胞发生破裂,导致红细胞中的相关成分进入血浆/血清中,使得血浆/血清样本出现红色增加的现象[1]。造成临床血液样本溶血的原因一般可以分为体外溶血和体内溶血[2]:体外溶血主要是由于血浆/血清处理不当,注射器和容器不干燥、不清洁等原因而发生;体内溶血则主要是由于药物有毒性或者被采血者本身有疾病等原因而发生[3-4]。临床血浆/血清样本在发生溶血后,其物理、化学性质会发生不同程度的改变,对溶血样本中的目标化合物进行测定时,可能会因为这些改变造成浓度测定的不准确[5]。
进行药物的生物分析时,临床样本中经常发生溶血现象,对溶血样品基质效应进行正确的评估具有重要的意义。为了解我国生物分析实验室关于溶血样本基质考察的现状,中国生物分析论坛(China Bioanalysis Forum,CBF)开展了一项对北京、天津、南京等地区共32家生物分析实验室的问卷调查研究。该问卷针对各实验室进行溶血基质效应考察时的基质来源、溶血基质数目、浓度设置、模拟溶血基质时添加红细胞的比例以及是否要对溶血样本进行生物样品再分析(incurred sample reanalysis,ISR)研究等关键因素进行了调查,结果如图 1所示。
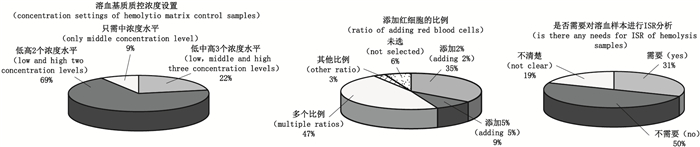
|
图 1 北京、天津、南京等地共32个生物分析实验室关于溶血基质效应考察的问卷调查结果 Figure 1 Results of the research of hemolysis matrix effect, based on a questionnaire survey of 32 bioanalysis laboratories in Beijing, Tianjin, Nanjing etc |
调查问卷结果显示,对溶血基质效应的考察已经引起了各生物分析实验室足够的重视。在2015年版《中华人民共和国药典》[6]中,也提到要关注溶血样本的基质效应,但并没有给出明确的考察方案,而业内关于溶血样本基质效应的考察方法也尚未达成共识。可见,对于“何时”以及“如何”进行溶血基质效应考察,业内还存在着一定的争议[7-10]。本文将从以下几个方面,介绍使用LC-MS/MS方法分析生物样本时对溶血样本的处理策略。
1 生物分析临床样本中溶血样本所占比例问卷调查对溶血样本在临床样本中所占比例进行了调查,结果如图 2所示。19份问卷反馈溶血样本占该实验室生物分析总样本的1%~5%,占总问卷反馈的59%;4家实验室中溶血样本比例小于1%,1家实验室的溶血样本比例达6%~10%。可见,各实验室接收样本的溶血样本比例存在显著的差别,可能与生物分析实验室中进行分析项目的类型和临床样本来源有关。
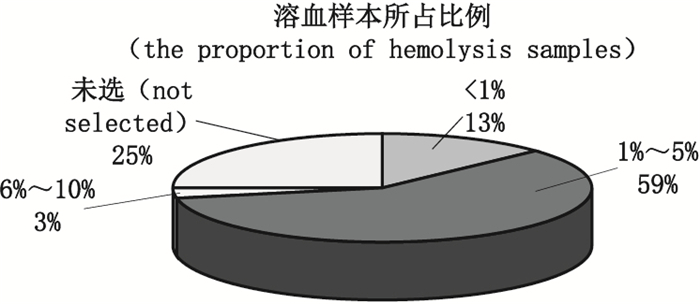
|
图 2 溶血样本占实验室生物分析总样本比例(北京、天津、南京等地共32个生物分析实验室的问卷调查结果) Figure 2 Proportion of hemolyzed samples in total bioanalysis samples(results of a questionnaire survey of 32 bioanalysis laboratories in Beijing, Tianjin, Nanjing and other places) |
基于问卷调查,对不同类型临床试验所产生的临床样本的溶血样本比例也进行了相关文献调研。Tang等[11]对18个生物等效(bioequivalence,BE)试验中10 000余个临床样本进行了统计,其中溶血样本比例平均约为2%(表 1)。由于BE试验通常在单中心、健康受试者中进行,临床采血过程能够得到良好的控制,故溶血样本比例较低,通常能够控制在3%以下,甚至可达1%以下。
|
|
表 1 18个生物等效(BE)试验临床样本中溶血样本比例[11] Table 1 Summary of hemolysis in 18 clinical bioequivalent studies |
近年来,我国创新药物研发比例加大,在生物样本分析中临床药代动力学试验的样本比例也大大增加。与BE试验不同,一些特殊药物,如抗肿瘤药物等创新药物,其临床药代动力学试验是在患者人群中进行的。由于更容易受到受试人群的疾病状态、临床操作等因素的影响,这些临床试验中的临床样本溶血样本比例可能会明显增高。对北京某Ⅰ期临床实验室目前已经完成的6个项目中的溶血样本比例进行统计,其中4个试验是在患者人群中进行的,结果如表 2所示。
|
|
表 2 某Ⅰ期临床实验室药代动力学试验临床样本中溶血样本比例 Table 2 Hemolysis sample proportion of pharmacokinetic clinical trial in a phase Ⅰ unit |
综上可知,有一定比例临床样本会发生溶血,一般约为1%~5%。而在患者中进行的临床试验,样本溶血比例明显增高。因此,评价溶血基质效应对于生物分析,尤其是对于创新药物生物分析的影响具有重要意义。
2 溶血对目标化合物浓度测定的影响一般来说,溶血对目标化合物浓度测定的影响可以归纳为4类[11]:(1)对全血和血浆分配比的影响。有些药物更倾向分配于红细胞中,在这种情况下,溶血血浆中的浓度就会与正常血浆中的浓度有所不同,并且由红细胞进入到血浆的药物无法准确定量。(2)对色谱分离的影响。溶血样本在萃取后可能会有一些特有的与待测物质共流出的内源性干扰。使用基于非溶血基质开发的色谱分离方法,可能无法将这些干扰与待测化合物分离。(3)对基质效应的影响。溶血的发生会产生溶血基质特有的基质效应,可能引起离子抑制或增强,进而影响试验的总体精密度和准确度[12]。(4)对化合物稳定性的影响。溶血的发生会导致红细胞中的一些物质(如酶)释放到血清/血浆中[13]。这些物质可能会造成目标化合物在血清/血浆基质中稳定性的改变[14-15]。
因此,对于更倾向于分配于红细胞中的化合物,尤其是全血-血浆分配比非恒定的化合物,一旦临床样本发生溶血,分配于红细胞中的目标化合物就会大量进入到血浆/血清中,使得血浆/血清浓度显著增高且不能正确反映原血浆浓度,这种情况无法通过生物分析方法的优化而改善。所以,在进行生物分析之前,应谨慎确认目标分析物是否存在全血-血浆分配比问题。
对于那些会被溶血基质中特殊物质影响稳定性的化合物,也需要在生物分析前充分评估,如果存在该问题,也需要谨慎地报告溶血样本的测定浓度。
3 法规中对于溶血基质考察的规定国际和国内药政管理部门关于生物分析方法学验证的相关指导原则中均有对溶血样本基质考察的内容。
2011年EMA发布的指导原则(EMA《Guideline on bioanalytical method validation》2011)[16]则明确了对溶血、高脂血以及特殊人群基质的基质效应考察。该指导原则指出,使用质谱方法时,应使用至少6批包括溶血、高脂血症和特殊人群(如肾脏或肝脏受损人群)的样品基质进行基质效应研究。我国2015年版《中华人民共和国药典》 [6]也提出“除正常基质外,还应关注其他样品的基质效应,例如溶血的或高血脂的样品等。”2018年美国FDA最新发布的指导原则《Guidance for Industry Bioanalytical Method Validation》中[17]也明确提到“根据测定的预期用途,可将溶血样品、高脂血样品或来自特殊人群的样品的影响包括在选择性评估中。使用液相色谱-质谱(LC-MS)方法时,应确定基质对离子抑制、离子增强或提取效率的影响。””
然而,以上指导原则虽然均提及了应对溶血样本的基质效应进行考察,但对于“应在何时”和“以何种方法”进行溶血基质效应考察的问题却均没有提出具体的要求与方案。这也是目前在行业中对溶血样本基质效应考察关注度较高且争议问题较多的根本原因。
4 溶血样本基质效应考察的科学思考对于溶血基质效应考察的策略的探讨不应仅从法规的角度上,更应该从科学的角度上进行思考。
生物分析的目的是在基质中获得尽可能接近“实际”浓度的可靠药物浓度。在方法验证中,使用标准曲线(standard curve,STD)样本和质控(quality control,QC)样品来模拟实际研究样本。而STD/QC样本与研究样本之间总会存在一定的差异,基质效应使得溶血样本与STD/QC样本的差异更加明显。因此,考察溶血样本的基质效应在方法学验证中是非常必要的。
在实践过程中,进行溶血样品基质效应考察之前,有几个关键的问题需要明确。
第一,什么是“标准化”溶血QC样本。即,首先需要明确判断1个临床样本的溶血程度的方法。目前对于临床样本溶血程度的判断,欧洲生物分析论坛(European Bioanalysis Forum,EBF)曾经进行过1项调查,在调查的生物分析实验室中,有74%的实验室通过视觉判断,20%的实验室使用比色卡,另有7%的实验室使用临床分析仪来判断样本的溶血或高脂的状态。使用临床分析仪的情况一般发生在测定中已发现问题或者已知患者的临床疾病状态可能导致样本异常的特殊研究中[18]。由此可见,目前业界对临床样本溶血程度的判断,还是普遍使用目测法和比色卡[19],比色卡如图 3所示。这2个方法的缺点在于判断结果较为主观,从这个角度来看临床样本的准确溶血程度一般是不容易获得的。在判断临床样品的溶血程度后,还需要明确如何制备最大程度模拟临床溶血样本的QC样本,以及在方法学验证阶段能证明该方法对溶血基质不敏感所需要考察的溶血QC样本数目。对于后2个问题,目前尚无法从科学性上给出较为统一的答案。
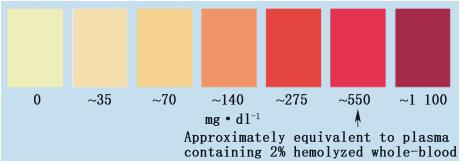
|
图 3 使用比色卡来判断样本溶血程度 Figure 3 Color chart for the determination of hemolysis level for a sample |
第二,如何评估溶血基质效应的考察结果。首先要明确溶血基质效应考察的接受标准,而在科学性上目前同样难以给出较为统一的答案。明确了接受标准之后,即使对于通过了溶血基质效应考察的实验,也应进一步分析所开发的生物分析测定法是否适合溶血样本分析。
综上可知,目前无论采用何种方法均无法制备出能够完全模拟临床溶血样本的QC样本。因此,对于生物分析方法学验证中对于溶血样本基质的评估,是不能够机械地得出结论的,最终是否能够有信心报告溶血样本的浓度,还需要进行多方面的科学考虑,如使用ISR等方法对溶血样本浓度测定的确定性进行进一步确认。
5 溶血样本生物分析策略目前可以对溶血样本基质效应进行评估,并参照逐步评估的结果对溶血样品的生物分析进行决策,可以在生物分析方法开发、方法验证以及在生物样本分析过程中形成一套策略来应对溶血样本的分析。
在生物分析方法开发阶段,首先需要确定待测化合物是否存在全血/血浆比(B/P ratio)的问题。
同时,应考虑目标化合物在溶血基质中是否能够满足稳定性的要求。如果溶血基质中的某些特殊的酶等物质能够造成目标待测物的不稳定,则应事先考察是否能够通过加入定量的酶抑制剂和稳定剂来解决,相应在生物分析方法中加入该前处理步骤。应该注意,如前所述由于QC样本无法完全模拟临床溶血样本,即使证明了添加稳定剂可以改善QC样本中目标分析物的稳定性,在报告临床实际溶血样本的测定浓度值时也需谨慎,必要时还需要ISR等步骤进行确认。而如果加入稳定剂等方法也不能改善目标分析物在溶血基质中的稳定性,则应考虑不报告生物分析中溶血的临床样本的结果。
其次,应该力争开发1个“对溶血基质不敏感”的生物分析方法。一方面,在测定方法上对色谱方法进行优化,使其能够分离溶血基质中对目标化合物产生干扰的内源性物质。使用稳定同位素标记的内标,可以降低溶血基质对分析的影响[20]。另一方面,应使用更好的制备方法,如固相萃取法(solid-phase extraction,SPE)和液-液萃取法(liquid-liquid extraction,LLE),而在使用蛋白沉淀(protein precipitation,PP)的制备方法时则应考虑增加基质的稀释倍数[21]。
如果在方法学开发阶段已经证明该方法是对溶血基质干扰不敏感的方法,则应该在方法学验证阶段采用合适的验证程序验证并记录结果。验证的方法和程序可以由实验室根据自身情况制定,一般使用在正常血浆中添加2%~5%的红细胞模拟溶血QC样本,或者使用“Man-made”的溶血血浆配制溶血QC样本[18]进行基质效应的考察。QC样本推荐至少包括在方法定量范围内的低和高浓度。
在生物样本分析阶段,如使用经验证的对溶血基质干扰不敏感的方法,则可以对溶血样本与正常样本进行相同的处理,不用做出特殊标示。而如果方法学验证证明该方法不能准确测定溶血基质中的目标化合物浓度,溶血样本的药物浓度则考虑不予报告。如方法学验证中证明溶血样本在使用正常空白基质稀释一定倍数后,能够满足准确测定的要求,则在生物分析中,使用此稀释倍数稀释后浓度仍可高于最低定量限(the lower limit of quantification,LLOQ)的溶血样本浓度可以正常报告。但稀释后浓度低于LLOQ的溶血样本则考虑不予报告。在生物样本分析期间,若使用了稳定同位素内标,则应对内标的响应进行密切的关注。当溶血样本的内标响应异常时,可能提示溶血样本的基质效应会影响待测化合物的分析。这时需要对内标响应异常的样本进行稀释或者标准加入来再次确认浓度测定是否准确。
最后值得注意的是,在生物样本分析阶段还应通过ISR分析对目标化合物在溶血基质中的稳定性进行考察。首先需要评价溶血样本的内标响应是否在接受范围内,如果符合接受标准,则需要对溶血样本进行一定比例的ISR分析。当ISR重复性达到平均值的±20%接受标准时,原始数据是可以接受的。若未达到接受标准,数据不可报告,或需要进一步的调查。
如果溶血样本的内标响应不符合接受标准,则应该对这些样本全部进行ISR分析和样品稀释或标准添加处理。如果ISR能够达到接受标准,而样品稀释或标准添加的结果未能满足±15%接受标准,则应该报告样品稀释或标准添加后的测定结果。而如果ISR和稀释(或标准添加)均通过接受标准,则报告原始数据。如果ISR无法满足接受标准,则数据不可报告。
综上所述,本文结合目前已发表文献资料与业界讨论结果,推荐溶血样品生物分析的决策树,如图 4所示。
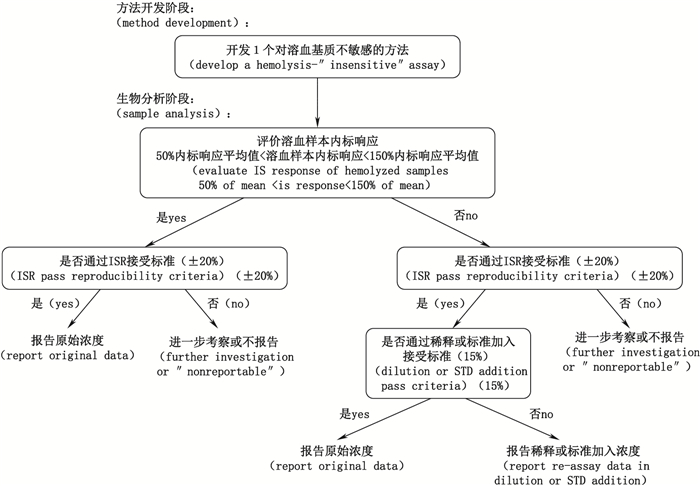
|
图 4 溶血样本生物分析的决策树 Figure 4 Decision Tree for the bioanalysis of hemolyzed samples |
综上所述,溶血样本与正常血浆/血清的生物基质组成不同,可能会因此而造成浓度测定的不准确。故在生物分析中,对溶血基质效应的评估是十分重要的。强烈推荐在生物分析方法开发阶段就要进行溶血基质的相关测试。建议通过稳定同位素标记内标的使用、色谱分离条件的优化和清洁能力更强的预处理方法等一系列手段,开发1个“对溶血基质不敏感”的生物分析方法。如果开发的方法是一个“对溶血基质不敏感”的生物分析方法并且目标分析物不具有全血与血浆分配问题,则溶血样本的浓度则可以用正常血浆/血清配制的标准曲线来标定。在样本分析期间,应当仔细监测稳定的标记内标物在溶血样本中的响应。当内标响应异常时,使用稀释或标准加入来确认数据的准确性。最后,建议将溶血样本纳入到ISR分析中,以确保数据的重现性。
| [1] |
TAN A, GAGNÉ S, LÉVESQUE IA, et al. Impact of hemolysis during sample collection: how different is drug concentration in hemolyzed plasma from that of normal plasma?[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2012, 901(2): 79. |
| [2] |
LIPPI G, PLEBANI M, SOMMA SD, et al. Hemolyzed specimens: a major challenge for emergency departments and clinical laboratories[J]. Crit Rev Clin Lab Sci, 2011, 48(3): 143. DOI:10.3109/10408363.2011.600228 |
| [3] |
陈姚, 马继红, 曾蓉君. 真空静脉采血标本溶血原因分析及对策[J]. 护理管理杂志, 2010, 10(9): 677. CHEN Y, MA JH, ZENG RJ. Cause analysis and countermeasures of hemolysis of vacuum venous blood specimens[J]. J Nurs Adm, 2010, 10(9): 677. DOI:10.3969/j.issn.1671-315X.2010.09.037 |
| [4] |
刘海燕. 溶血现象对临床生化检验项目影响的观察及预防对策[J]. 当代医学, 2011, 17(27): 33. LIU HY. Strategies for observation and precaution of influence of sample hemolysis on biochemical detection outcomes and its treatment countermeasures[J]. Contemp Med, 2011, 17(27): 33. DOI:10.3969/j.issn.1009-4393.2011.27.021 |
| [5] |
张勇军, 郭越文. 标本溶血对常规生化检验结果的影响[J]. 检验医学与临床, 2013, 10(10): 1239. ZHANG YJ, GUO YW. Influence of hemolysis on biochemical detection[J]. Lab Med Clin, 2013, 10(10): 1239. DOI:10.3969/j.issn.1672-9455.2013.10.019 |
| [6] |
中华人民共和国药典2015年版.四部[S].2015: 363《9012生物样品定量分析方法验证指导原则》 ChP 2015.VolⅣ[S].2015: 363《Guidance on Bioanalytical Method Validation》 |
| [7] |
SAVOIE N, GAROFOLO F, Van AMSTERDAM P, et al. 2010 white paper on recent issues in regulated bioanalysis & global harmonization of bioanalytical guidance[J]. Bioanalysis, 2010, 2(12): 1945. DOI:10.4155/bio.10.164 |
| [8] |
GAROFOLO F, ROCCI ML, DUMONT I, et al. 2011 White Paper on recent issues in bioanalysis and regulatory findings from audits and inspections[J]. Bioanalysis, 2011, 3(18): 2081. DOI:10.4155/bio.11.192 |
| [9] |
DESILVA B, GAROFOLO F, ROCCI M, et al. 2012 White Paper on recent issues in bioanalysis and alignment of multiple guidelines[J]. Bioanalysis, 2012, 4(18): 2213. DOI:10.4155/bio.12.205 |
| [10] |
AMARAVADI L, SONG A, MYLER H, et al. 2015 White Paper on recent issues in bioanalysis: focus on new technologies and biomarkers(Part 3-LBA, biomarkers and immunogenicity)[J]. Bioanalysis, 2015, 7(24): 3107. DOI:10.4155/bio.15.226 |
| [11] |
TANG D, THOMAS E. Strategies for dealing with hemolyzed samples in regulated LC-MS/MS bioanalysis[J]. Bioanalysis, 2012, 4(22): 2715. DOI:10.4155/bio.12.229 |
| [12] |
LIU G, JI QC, ARNOLD ME, et al. Identifying, evaluating, and controlling bioanalytical risks resulting from nonuniform matrix ion suppression/enhancement and nonlinear liquid chromatography-mass spectrometry assay response[J]. Anal Chem, 2010, 82(82): 9671. |
| [13] |
龙跃兵, 朱伟斌, 章美燕. 溶血对生化检验结果准确性的影响及校正方法的探讨[J]. 广东医学, 2011, 32(12): 1562. LONG YB, ZHU WB, ZHANG MY. Investigation of influence by sample hemolysis on biochemical detection outcomes and its calibration methods[J]. Guangdong Med J, 2011, 32(12): 1562. DOI:10.3969/j.issn.1001-9448.2011.12.024 |
| [14] |
BÉRUBÉ ER, TAILLON MP, FURTADO M, et al. Impact of sample hemolysis on drug stability in regulated bioanalysis[J]. Bioanalysis, 2011, 3(18): 2097. DOI:10.4155/bio.11.190 |
| [15] |
BÉRUBÉ ER, LACASSE MC, FURTADO M, et al. Severe impact of hemolysis on stability of phenolic compounds[J]. Bioanalysis, 2013, 5(12): 1491. DOI:10.4155/bio.13.109 |
| [16] |
European Medicines Agency(EMA).Guideline of Bioanalytical Method Validation[S/OL].(2012)[2012-02-01].http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2011/08/WC500109686.pdf
|
| [17] |
Food and Drug Administration(FDA).Guidance for Industry: Bioanalytical Method Validation[S/OL].(2013)[2013-09].Available at: http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM368107.pdf
|
| [18] |
INGELSE B, BARROSO B, GRAY N, et al. European bioanalysis forum: recommendation on dealing with hemolyzed and hyperlipidemic matrices[J]. Bioanalysis, 2014, 6(23): 3113. DOI:10.4155/bio.14.252 |
| [19] |
HUGHES NC, BAJAJ N, FAN J, et al. Assessing the matrix effects of hemolyzed samples in bioanalysis[J]. Bioanalysis, 2009, 1(6): 1057. DOI:10.4155/bio.09.91 |
| [20] |
FUNG EN, AUBRY AF, ALLENTOFF A, et al. Utilizing internal standard responses to assess risks on reporting bioanalytical results from hemolyzed samples[J]. AAPS J, 2015, 17(5): 1168. DOI:10.1208/s12248-015-9783-z |
| [21] |
CHAMBERS E, WAGROWSKIDIEHL DM, LU Z, et al. Systematic and comprehensive strategy for reducing matrix effects on LC/MS/MS analysis[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2007, 852(1-2): 22. DOI:10.1016/j.jchromb.2006.12.030 |
| [22] |
刘小娟, 杜晓琳, 黄娟, 等. 生物分析中溶血对检测的影响及其对策[J]. 中国新药与临床杂志, 2017, 36(4): 181. LIU XJ, DU XL, HUANG J, et al. Impact of hemolysis on detection in bioanalysis and its countermeasures[J]. Chin J New Drugs Clin Rem, 2017, 36(4): 181. |
| [23] |
杨永怀. 标本溶血对生化检验结果的影响及处理对策探析[J]. 中国现代药物应用, 2017, 11(13): 42. YANG YH. Investigation of influence by sample hemolysis on biochemical detection outcomes and its treatment countermeasures[J]. Chin J Mod Drug Appl, 2017, 11(13): 42. |
| [24] |
刘婧, 冯立民, 龚人杰. 标本溶血的患者因素分析及对策探讨[J]. 实验与检验医学, 2017, 35(1): 117. LIU J, FENG LM, GONG RJ. Investigation of patients factors of hemolysis and its countermeasures[J]. Exp Mol Lab Med, 2017, 35(1): 117. DOI:10.3969/j.issn.1674-1129.2017.01.040 |
| [25] |
钟大放, 李高, 刘昌孝. 生物样品定量分析方法指导原则:草案[J]. 药物评价研究, 2011, 34(6): 409. ZHONG DF, LI G, LIU CX, et al. Guidance on bioanalysis: method validation and analysis of study samples(draft)[J]. Drug Eval Res, 2011, 34(6): 409. |
| [26] |
冯晓杰, 杜丽英, 冯章英, 等. LC-MS/MS法测定人血药浓度的基质效应研究进展[J]. 中国新药杂志, 2015, 24(13): 1488. FENG XJ, DU LY, FENG ZY, et al. Research progress of matrix effect on determining blood concentration by LC-MS/MS[J]. Chin J New Drugs, 2015, 24(13): 1488. |
| [27] |
姚梦侃, 马秉亮, 马越鸣. 生物样品液质联用分析中的基质效应研究概况[J]. 药物分析杂志, 2010, 30(12): 2436. YAO MK, MA BL, MA YM. Overview of the matrix effect on quantitative liquid chrimatography/mass spectrometry analyses of biological samples[J]. Chin J Pharm Anal, 2010, 30(12): 2436. |
| [28] |
张人杰, 柴逸峰, 朱臻宇, 等. LC-MS/MS生物分析中试验样品再分析失败后的调查和解决方案[J]. 药物分析杂志, 2016, 36(4): 559. ZHANG RJ, CHAI YF, ZHU ZY, et al. Investigation and resolution of incurred sample reanalysis failures in LC-MS/MS bioanalysis[J]. Chin J Pharm Anal, 2016, 36(4): 559. |
 2018, Vol. 38
2018, Vol. 38 
