2. Waters科技(上海)有限公司, 上海 201206
2. Waters Technologies(Shanghai) Limited, Shanghai 201206, China
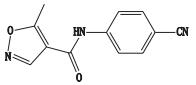
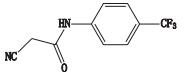
来氟米特是一个具有抗增殖活性的异
2016年山东省食品药品检验研究院承担了来氟米特片的国家计划抽验任务,共抽到来氟米特片100批次,涉及批准文号7个,占总批准文号的87.5%;涉及生产企业5家,占总生产企业的83.3%;按现行标准对各生产企业产品的有关物质进行考察,发现各企业产品杂质谱差异较大;且在制剂过程中有新杂质产生,制剂的稳定性差于原料;与参比Sanofi产品相比,国内产品杂质谱更复杂。国内外文献报道多为临床应用、药代动力学研究及联合用药等方面,国内仅有1篇文献就来氟米特有关物质测定方法进行了研究;国内来氟米特片杂质谱及各企业产品杂质差异尚未见报道。为有效控制来氟米特片的质量,降低用药风险,本文采用Waters 2D UPLC-QTof二维液质联用系统,对来氟米特片的杂质谱进行深入研究,一维使用《中华人民共和国药典》(以下简称《中国药典》)2015年版二部来氟米特有关物质项下的色谱条件分离,二维使用与质谱兼容的色谱条件与QTof质谱相连,将样品中的杂质切入二维进质谱仪检测,进而进行结构解析,并采用国际公认的3款软件Gastroplus 9.0ADMET predictor 8.0与Derek Nexus 5.0.1(基于知识规则的)、Sarah Nexus 2.0.1(基于统计学的)进行毒性与遗传毒性(基因毒性)的评价。
1 仪器与试药Waters Acquity 2D UPLC-Xevo G2-XS QTof二维液质联用仪,Gastroplus 9.0,ADMET predictor 8.0毒性预测软件(美国Simulations plus公司),Derek Nexus 5.0.1和Sarah Nexus 2.0.1遗传毒性预测软件(英国Lhasa有限公司)。
来氟米特对照品(批号100571-200601,含量99.7%)、来氟米特杂质Ⅰ(批号101164-201602,含量99.9%)、来氟米特杂质Ⅱ(批号101165-201001)、杂质Ⅲ(批号100738-201001)均购自中国食品药品检定研究院,乙腈(色谱纯)、磷酸二氢钾(分析纯)、磷酸(化学纯)、甲酸(色谱纯)、超纯水。
2 方法与结果 2.1 色谱-质谱条件一维色谱条件:采用Inertsil ODS-3(250mm× 4.6 mm,5μm)色谱柱,流动相为0.025 mol·L-1磷酸二氢钾(用磷酸调节pH至3.0)-乙腈(57:43),流速0.6 mL·min-1,进样量10μL,检测波长210 nm,柱温50 ℃。二维色谱条件:采用Waters BEH C18(50 mm×2.1 mm,1.7μm)色谱柱,柱温50 ℃,流动相A为0.1%甲酸溶液,流动相B为0.1%甲酸乙腈溶液,切峰后流动相比例变化见表 1。
|
|
表 1 梯度洗脱程序 Table 1 Gradient elution procedure |
质谱条件:离子化模式为ESI-,毛细管电压2 kV,源温度120 ℃,雾化气温度500 ℃,雾化气流速900 L·h-1,采集模式为MSE,软件为MassLynx 4.1/MassFragment。
2.2 样品溶液制备取供试品适量,加流动相溶解并稀释制成每1 mL中约含1.0 mg的溶液,摇匀,滤过,取续滤液,即得。
2.3 杂质谱差异与目标杂质选择比较国内企业产品与参比制剂Sanofi产品的杂质谱,详见图 1,各企业产品杂质谱差异较大,且杂质较原研产品多且复杂。选取B、D两企业产品作为代表,进行质谱结构分析。
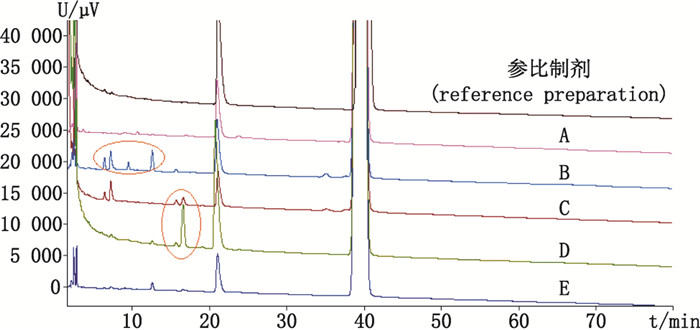
|
A~E.国内企业产品(domestic products) 图 1 各企业产品杂质比较 Figure 1 The impurity comparison from different enterprise products |
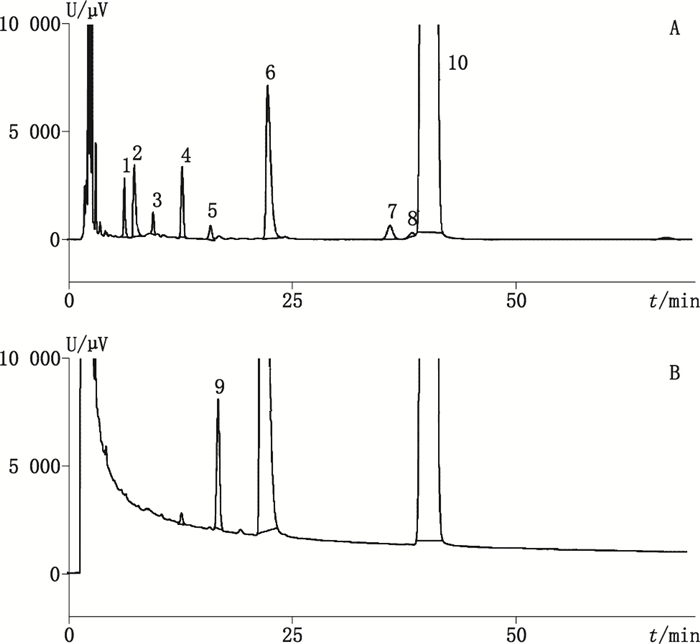
采用Waters 2D UPLC-QTof二维液质联用系统,一维采用“2.1”项下一维色谱条件进行,将一维色谱图中目标杂质切入二维色谱柱,二维使用“2.1”项下二维色谱条件进行分析,洗脱液进Q-Tof质谱检测器,进行目标化合物的一级、二级质谱数据采集,见色谱图 2。
|
1~9.目标杂质(target impurities)10.来氟米特(leflunomide) A. MS B. MS2 图 2 来氟米特一维HPLC色谱图(检测波长210 nm) Figure 2 1D HPLC chromatograms of leflunomide(detection wavelength 210 nm) |
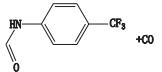
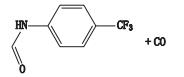
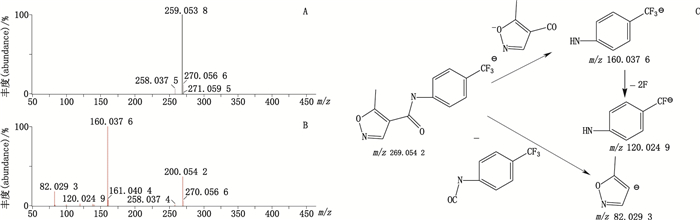
首先对来氟米特的一、二级质谱图进行分析,确定加合物及二级碎片裂解规律。所得分子离子峰m/z 269.054 2为[M-H]-峰,主要碎片离子为m/z 160.037 6、120.024 9、82.029 3,推测其可能的裂解规律主要问题是酰胺C-N键断裂,得到碎片m/z 160.037 6,进一步失去CF3上的F,得到碎片m/z 120.024 9,;另一裂解途径为五元环与羰基C-C键断裂,得到碎片m/z、82.029 3,碎片解析见图 3。
|
A. MS B. MS2 C.裂解途径(fragmentation pathway) 图 3 来氟米特质谱图及裂解途径 Figure 3 Mass spectrum and fragmentation pathway of leflunomide |
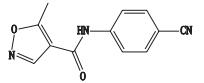
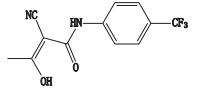
根据来氟米特的裂解规律,对杂质的裂解途径进行推测,初步鉴定了4个杂质的可能结构,杂质1与5为同分异构体,且杂质1、2、5仅根据一级、二级质谱,推导出其结构片段,未能完全解析,杂质8与来氟米特为同分异构体,杂质3通过碎片不能建立其与主峰的联系,未解析,可能为辅料。详细信息见表 2。
|
|
表 2 来氟米特杂质质谱分析及可能结构 Table 2 Mass analysis and possible structures of leflunomide impurities |
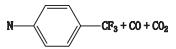
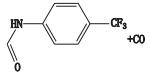
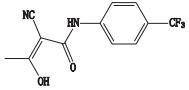
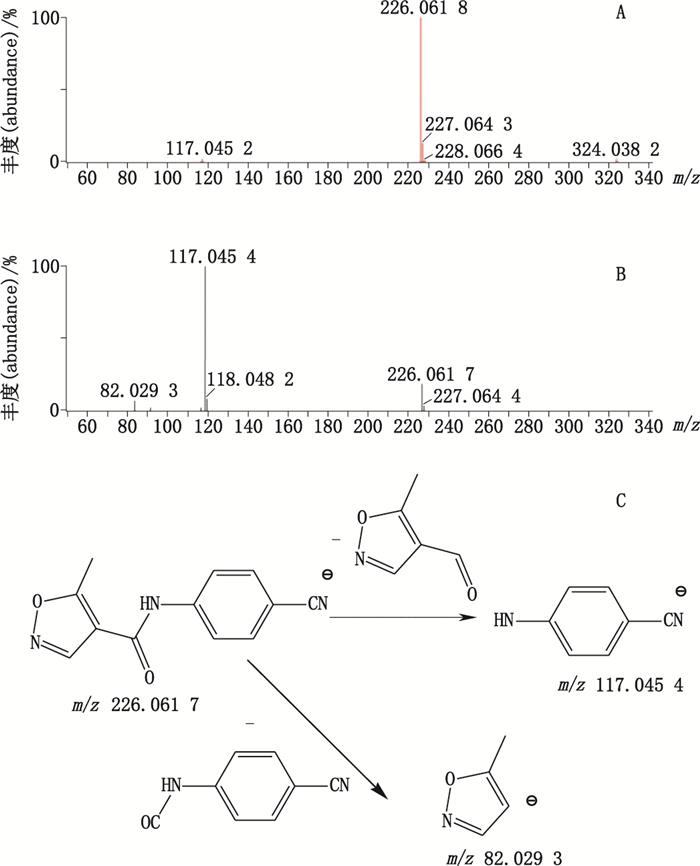
杂质4的准分子离子峰为m/z 226.061 8,为其[M-H]-峰,拟合元素组成为C12H9N3O2,二级质谱显示m/z 117.045 4、82.029 3的碎片离子,推测其结构为来氟米特苯环上三氟甲基被氰基取代产生。杂质4的质谱裂解方式见图 4。
|
A. MS B. MS2 C.裂解途径(fragmentation pathway) 图 4 杂质4质谱图及裂解途径 Figure 4 Mass spectra and fragmentation pathway of impurity 4 |
杂质6的准分子离子峰为m/z 269.054 0,为来氟米特同分异构体,二级碎片与主峰一致,仅峰强度不太一致,经液相色谱定位,为《中国药典》标准中来氟米特杂质Ⅱ。
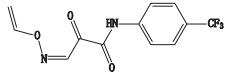
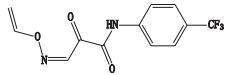
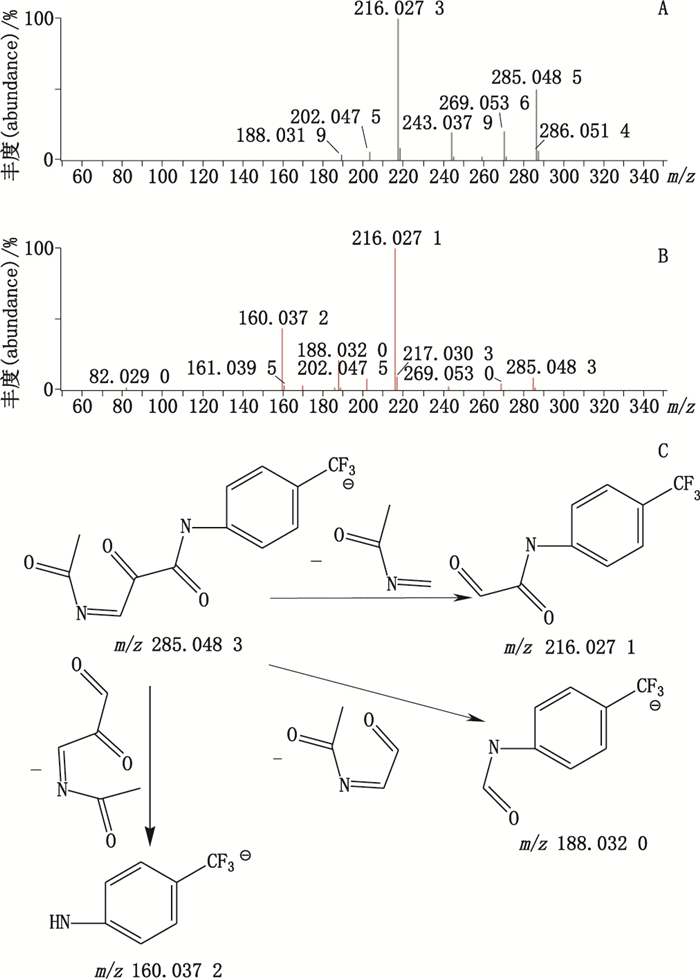
杂质7的准分子离子峰为m/z 285.048 5,为其[M-H]-峰,拟合元素组成为C12H9N2O3F3,为主峰+O结构,二级质谱显示m/z 216.027 1、188.032 0、160.037 2的碎片离子,推测其结构为来氟米特五元环上C=C被氧化,后发生分子重排,生成CO双键。杂质7的质谱裂解方式见图 5。
|
A. MS B. MS2 C.裂解途径(fragmentation pathway) 图 5 杂质7质谱图及裂解途径 Figure 5 Mass spectra and fragmentation pathway of impurity 7 |
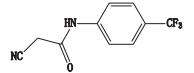
杂质9的准分子离子峰为m/z 227.043 2,为其[M-H]-峰,拟合元素组成为C10H7N2OF3,为主峰-C2H2O结构,二级质谱显示m/z 186.016 3、160.037 1、99.925 1的碎片离子,杂质9的质谱裂解方式见图 6。
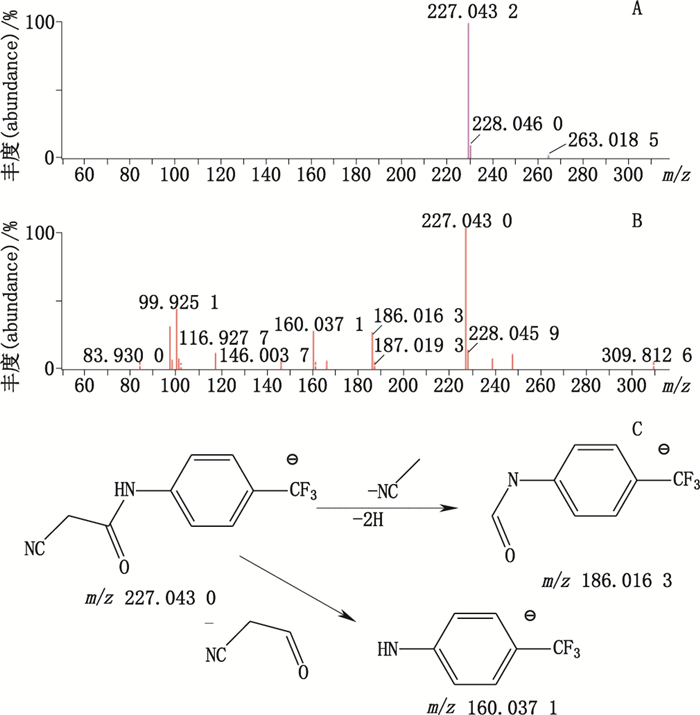
|
A. MS B. MS2 C.裂解途径(fragmentation pathway) 图 6 杂质9质谱图及裂解途径 Figure 6 Mass spectra and fragmentation pathway of impurity 9 |
采用Gastrolplus 9.0 ADMET Predictor 8.0软件对推测出的杂质进行毒性预测,采用Derek Nexus 5.0.1(基于知识规则的)和Sarah Nexus 2.0.1(基于统计学的)进行遗传毒性预测,并根据ICH M7指导原则对其毒性分级,详细结果见表 3。结果表明,5种杂质均属遗传毒性5级,没有警示结构。而毒性预测发现7号杂质TOX_Risk为4,属于高毒性风险物质,根据软件说明,TOX_Risk大于3.3即为高毒性风险物质,应严格控制。
|
|
表 3 杂质毒性预测 Table 3 The toxicity prediction of impurity |
采用二维液质联用,一维采用常规液相色谱条件,二维采用与质谱兼容的液相色谱条件与QTof质谱相连,在不改变原方法的基础上,进行质谱检测,快速实现化合物质谱定性,节省摸索质谱条件的时间;同时结合仪器所带软件MassLynx 4.1/MassFragment,根据一、二级质谱数据,结合裂解规律快速解谱。
3.2 杂质谱的研究根据质谱推测所得结构,《中国药典》2015年版二部仅控制了6号杂质(即杂质Ⅱ),9号杂质为USP 40来氟米特原料中2-氰基-乙酸-(4'-三氟甲基)苯胺,USP 40控制来氟米特原料中含此杂质不得过0.1%,来氟米特片项下并未规定限度;4号、7号杂质均未见文献报道。
与参比制剂Sanofi产品比较,国内产品杂质复杂,且存在高毒性风险化合物杂质7;标准检验也发现制剂的稳定性差于原料,且制剂中杂质种类多于原料,即表明在制剂过程中有新杂质生成,为保证药品的安全有效性,建议生产企业优化处方、生产工艺,查找引起药物不稳定原因,保证药品的质量稳定性,同时加强药品在有效期内的质量监管。
| [1] |
中华人民共和国药典2015年版.二部[S].2015: 462 ChP 2015.Vol Ⅱ[S].2015: 462 |
| [2] |
DUYGU Y, DILEK DA, MUZAFFER T. Determination of leflunomide in tablets by high performance liquid chromatography[J]. J Pharm Biomed Anal, 2006, 40: 197. DOI:10.1016/j.jpba.2005.06.030 |
| [3] |
POOMINA S, DEBRAJ G, PHOOL C, et al. Detection of in vitro metabolite formation of leflunomide: a fluorescence dynamics and electronic structure study[J]. J Med Chem, 2016, 59: 3418. DOI:10.1021/acs.jmedchem.6b00088 |
| [4] |
MANFRED S. The use of leflunomide in the treatment of rheumatoid arthritis: an experimental and clinical review[J]. Immunopharmacoloy, 2000, 47: 291. DOI:10.1016/S0162-3109(00)00194-6 |
| [5] |
余彬, 罗晶. 来氟米特不良反应并文献分析[J]. 临床合理用药, 2010, 3(20): 8. YU B, LUO J. Document analysis of adverse reactions of leflunomide[J]. Chin J Clin Rational Drug Use, 2010, 3(20): 8. DOI:10.3969/j.issn.1674-3296.2010.20.005 |
| [6] |
余志勇.来氟米特合成工艺优化及质量控制研究[D].大连: 大连理工大学, 2012 YU ZY.Research on Synthetic Process Optimization and Quality Control of Leflunomide[D].Dalian: Dalian University of Technology, 2012 |
| [7] |
谢思骏, 汪航. 高效液相色谱-线性离子阱质谱鉴定瑞舒伐他汀中间体中相关杂质[J]. 药物分析杂志, 2017, 37(2): 243. XIE SJ, WANG H. Identification of impurities in rosuvastatin intermediate by high performance liquid chromatography coupled with linear ion trap mass spectrometry[J]. Chin J Pharm Anal, 2017, 37(2): 243. |
| [8] |
马晓宁, 梁晟, 蒋涛, 等. 酒石酸唑吡坦片中杂质的色谱-质谱结构鉴定[J]. 药物分析杂志, 2017, 37(6): 1087. MA XN, LIANG S, JIANG T, et al. Separation and identification of unknown impurities in zolpidem tartrate tablets by LC-MS method[J]. Chin J Pharm Anal, 2017, 37(6): 1087. |
| [9] |
徐明明, 郑璐侠, 邵泓, 等. 二维液相色谱法检测注射用核糖核酸Ⅰ/Ⅱ/Ⅲ中苯酚残留量[J]. 药物分析杂志, 2017, 37(3): 502. XU MM, ZHENG LX, SHAO H, et al. Determination of residual phenol content in ribonucleic acid Ⅰ/Ⅱ/Ⅲ for injection by two-dimensional liquid chromatography[J]. Chin J Pharm Anal, 2017, 37(3): 502. |
| [10] |
荀琰, 耿昭, 张燕飞, 等. 液质联用法快速筛查中药材及饮片中常见染色掺假物质的方法研究及数据库建立[J]. 药物分析杂志, 2017, 37(3): 461. XUN Y, GENG Z, ZHANG YF, et al. Rapid screening method based on LC-MS for common dyeing adulterated material in traditional Chinese medical materials and decoction pieces[J]. Chin J Pharm Anal, 2017, 37(3): 461. |
| [11] |
张丽敏, 王嘉仡, 孟宪生, 等. 基于UPLC-Q-TOF-MS法对中药山绿茶化学成分分析[J]. 药学研究, 2017, 36(5): 266. ZHANG LM, WANG JY, MENG XS, et al. Study on chemical constituents in Ilex hainanensis Merr.by UPLC-Q-TOF-MS[J]. J Pharm Res, 2017, 36(5): 266. |
| [12] |
VIVIEN CH, BRUCE GC, SUSAN ET. Rapid determination of the active leflunomide metabolism A771726 in human plasma by high performance liquid chromatography[J]. J Chromatogr B, 2004, 803: 331. DOI:10.1016/j.jchromb.2004.01.016 |
| [13] |
HAIIMA R, TOMAS R, ASHLEY H, et al. Quantitation of total and free teriflunomide(A771726)in human plasma by LC-MS/MS[J]. J Pharm Biomed Anal, 2011, 55: 325. |
| [14] |
LIM YJ, KIM HS, SHON M, et al. Pharmacokinetics and bioequivalence evaluation of leflunomide tablets in Korean healthy volunteers[J]. Drug Res, 2013, 63: 633. DOI:10.1055/s-00023610 |
| [15] |
PARK JY, KIM KA, LEE YH, et al. Pharmacokinetic comparison and bioequivalence of two leflunomide formulations in humans: a single dose, randomized, open-label, two-way crossover study[J]. Int J Clin Pharmacol Ther, 2010, 48(4): 291. DOI:10.5414/CPP48291 |
| [16] |
施务务, 吴欢. 来氟米特片中来氟米特及有关物质的测定[J]. 淮海医药, 2012, 30(6): 545. SHI WW, WU H. The determination of leflunomide and related substance in leflunomide tablets[J]. J Huaihai Med, 2012, 30(6): 545. DOI:10.3969/j.issn.1008-7044.2012.06.051 |
 2018, Vol. 38
2018, Vol. 38