苍术为菊科植物茅苍术Atractylodes lancea(Thunb.)DC.或北苍术Atractylodes chinensis(DC.)Koidz.的干燥根茎,始载于《神农本草经》中,位列上品,具有燥湿健脾,祛风散寒,明目之功效,临床主要用于脘腹胀满,泄泻,水肿,脚气痿躄,风湿痹痛,风寒感冒,夜盲等症[1]。《名医别录》中记载其能“主头痛,消痰水,暖胃消谷嗜食”;现代药理研究表明,苍术具有抗炎、抗菌抗病毒、抗肿瘤、降糖、保肝以及抗心律失常等药理作用[2-7]。现行《中华人民共和国药典》(简称《中国药典》)中收录的苍术饮片有2种,分别为生苍术与麸炒苍术。传统中医药理论认为,苍术麸炒后健脾作用增强且燥性缓和。目前对于苍术麸炒机理的研究主要集中在化学成分、药理药效以及药代动力学等方面[8-14],有关苍术炮制前后主要成分排泄动力学的研究未见报道。苍术苷A是苍术中的主要成分,为愈创木烷型倍半萜苷类化合物,于艳等[15]曾对苍术麸炒后其含量变化进行考察。本实验采用UPLC-MS/MS多反应离子对监测(MRM)法对苍术炮制前后苍术苷A的排泄动力学规律进行研究,明确苍术苷A在两者中的排泄差异,为苍术的炮制机理研究以及临床安全用药提供依据。
1 实验材料 1.1 实验动物SPF级健康SD雄性大鼠12只,体质量(200±20)g,购于辽宁长生生物技术有限公司,动物许可证编号[SYXK(辽)2013-0009],适应性饲养1周后(湿度50%~60%,温度20~23 ℃,通风良好,光照适宜),进入实验状态。
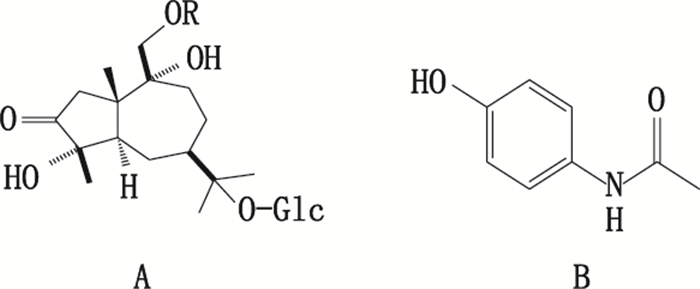
1.2 样品与试剂苍术药材购自北京同仁堂大药房大连分店,经辽宁中医药大学鉴定教研室李峰教授鉴定为Atractylodes lancea(Thunb.)DC.,麸炒方法参考2015年版《中国药典》麸炒法附录ⅡD。药用乙醇(南京化学试剂股份有限公司)。苍术苷A、对乙酰氨基酚对照品(购于江苏永健医药科技有限公司,批号分别为YJ-1019PS0025、20160522,纯度均大于98%),结构式见图 1。色谱纯乙腈、色谱纯甲醇、色谱纯甲酸(购于美国TEDIA公司)。纯净水(杭州娃哈哈集团有限公司)。
|
图 1 苍术苷A(A)和对乙酰氨基酚(B)的结构式 Figure 1 Chemical structures of atractyloside A(A)and acetaminophen(B) |
Waters ACQUITY UPLC超高效液相色谱仪;Waters Xevo TQ-S三重四极杆质谱仪(美国Waters公司);Fresco台式冷冻离心机(德国Heraeus公司);XH-C涡旋混合器(金坛市白塔新宝仪器厂);氮吹仪(郑州宝晶电子科技有限公司);Sartorius CP225D型电子天平(十万分之一,德国Sartorius公司);旋转蒸发仪RE-52C(巩义市予华仪器有限责任公司)。
2 方法与结果 2.1 药材提取物的制备取同一批次生苍术和麸炒苍术药材饮片,粉碎成粗粉。分别称取粉末适量,加等倍量药用乙醇浸泡24 h,渗漉,收集10倍量渗漉液,减压浓缩,给药前加水适量分散均匀,备用。折合生药量均为2.5 g·mL-1,其中苍术苷A含量分别为2.08、1.82 mg·mL-1。
2.2 对照品溶液及内标溶液的制备 2.2.1 对照品溶液精密称取苍术苷A对照品适量,置50 mL量瓶中,甲醇溶解,定容至刻度,配成质量浓度为250μg·mL-1的对照品储备液,备用。临用前,用甲醇将对照品储备液稀释成高、中、低浓度分别为12.50、2.50、0.50μg·mL-1的对照品溶液。
2.2.2 内标溶液精密称取对乙酰氨基酚对照品适量,置100 mL量瓶中,甲醇溶解,定容至刻度,配成质量浓度为132μg·mL-1的内标物储备液。临用前,用甲醇稀释成0.07μg·mL-1的内标溶液。
2.3 色谱与质谱条件 2.3.1 色谱条件色谱柱:Waters ACQUITY UPLC BEH C18柱(1.7μm,2.1 mm×100 mm);流动相:0.1%甲酸水(A)-乙腈(B),梯度洗脱(0~1.5 min,5%B→10%B;1.5~3 min,10%B→25%B;3~6 min,25%B→80%B;6~8 min,80%B);流速:0.3 mL·min-1;柱温:40 ℃;样品室温度:10 ℃;进样量:2μL。
2.3.2 质谱条件电喷雾离子源(ESI源),正离子模式,采用多反应监测模式(MRM)。电离电压:3.00 kV;去溶剂气温度:400 ℃;去溶剂气流速:800 L·h-1;核心气体流速:150 L·h-1;雾化气体压力:7 Pa。苍术苷A的MRM方法参数:离子对m/z 471.3 → 203.2,锥孔电压48 V,碰撞能量26 V,对乙酰氨基酚的MRM方法参数:离子对m/z 151.9 →110.16,锥孔电压42 V,碰撞能量14 V。质谱图如图 2所示。

|
图 2 苍术苷A(A)和对乙酰氨基酚(B)的质谱图 Figure 2 Mass spectra of atractyloside A(A)and acetaminophen(B) |
将SD大鼠随机分为2组,每组6只,分别为生苍术组和麸炒苍术组。禁食(不禁水)12 h后,置于代谢笼中,收集空白尿液。分别按15 mL·kg-1灌胃给予生、麸炒苍术提取液,给药后按0~3、3~6、6~9、9~12、12~24、24~36、36~48、48~60、60~72 h收集尿液,准确记录尿液体积。将收集到的尿液于4 ℃、1 000 r·min-1离心10 min,取上清液作为尿液样品,-80 ℃保存。
2.4.2 样品的处理将尿液样品于室温下解冻,取解冻后尿液200μL,分别加入内标溶液100μL,甲醇900μL,涡旋混匀2 min,于4 ℃、1 000 r·min-1离心5 min,上清液氮气流下吹干,100μL甲醇复溶,涡旋2 min,4 ℃、1 200 r·min-1离心15 min,取上清液作为供试液。
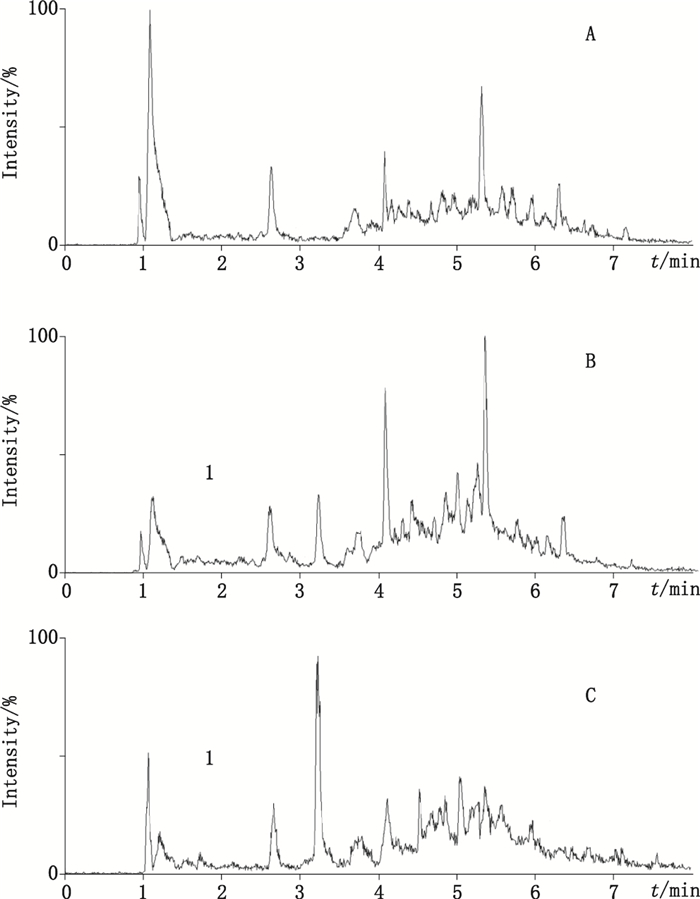
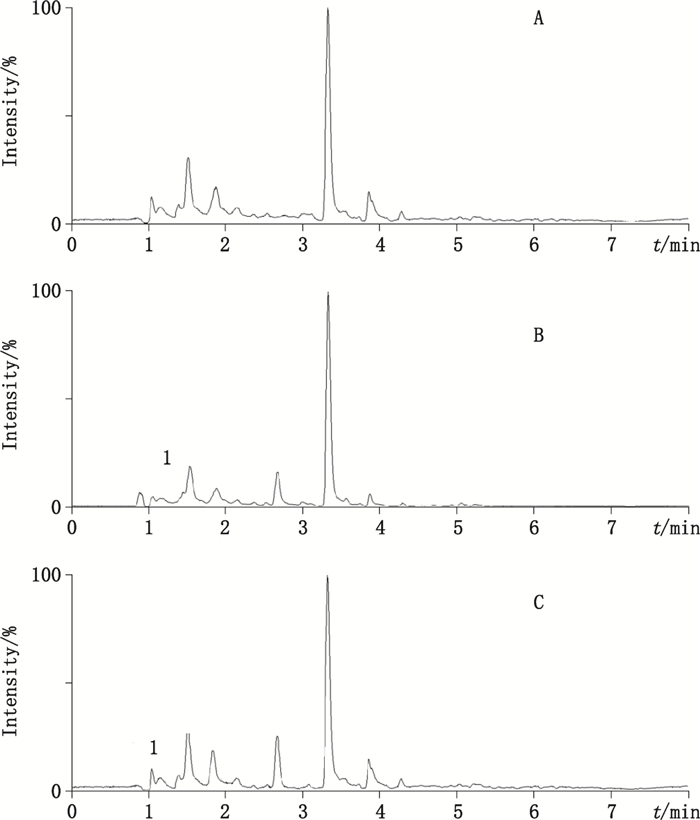
2.5 方法学考察 2.5.1 方法专属性考察取大鼠空白尿液200μL,除不加内标溶液外,其余按“2.4.2”项下方法操作,得空白尿液供试液;另取大鼠空白尿液200μL,加入对照品溶液和内标溶液适量,其余按“2.4.2”项下方法操作,得含有对照品与内标物的尿液供试液;取灌胃给予苍术药材提取液后大鼠尿液200μL,按“2.4.2”项下方法操作,得给药后尿液供试液。将各组供试液按“2.3”项下条件进样分析,得色谱图。MRM图见图 3和图 4。
|
1.苍术苷A(atractyloside A) A.空白尿液(blank urine)B.空白尿液+苍术苷A(blank urine + actractyloside A)C.给予苍术提取液后尿液(urine after administration of Atractylodes lancea extract) 图 3 苍术苷A的MRM模式通道图 Figure 3 Extracted ion chromatograms of atractyloside A under the model of MRM |
|
1.对乙酰氨基酚(acetaminophen) A.空白尿液(blank urine)B.空白尿液+对乙酰氨基酚(blank urine + acetaminophen)C.给予苍术提取液后尿液(urine after administration of Atractylodes lancea extract) 图 4 对乙酰氨基酚的MRM模式通道图 Figure 4 Extracted ion chromatograms of acetaminophen under the model of MRM |
精密吸取对照品储备液适量,用甲醇稀释成含苍术苷A分别为25.00、12.50、5.00、2.50、1.00、0.50、0.20 μg·mL-1的系列对照品溶液。精密吸取上述对照品溶液各100μL,挥干溶剂后加入大鼠空白尿液200μL,按“2.4.2”项下方法操作,在“2.3”项下条件进样分析,每浓度三样本。以对照品与内标物峰面积的比值为纵坐标,对照品浓度为横坐标,以加权(1·C-2)最小二乘法进行回归计算,回归方程:
Y=0.271 93X+0.001 12 r=0.999
线性范围为0.20~25.00 μg·mL-1。检测下限为0.02 μg·mL-1,其RSD为6.4%。
2.5.3 基质效应和回收率考察取大鼠空白尿液200μL,加入甲醇1 000μL,涡旋2 min,4 ℃、1 000r·min-1离心5 min,上清液氮气流下吹干,残渣用100μL对照品溶液复溶,涡旋2 min,4 ℃、1 200 r·min-1离心15 min,取上清液,按“2.3”项下条件进样分析,高、中、低3种浓度各五样本,记录峰面积为A;精密吸取高、中、低3种浓度的对照品溶液100μL,每种浓度5份,挥干溶剂后加入大鼠空白尿液200μL,按“2.4.2”项下方法操作,“2.3”项下条件进样分析,记录峰面积为B;分别取相应的高、中、低3种浓度的对照品溶液,按“2.3”项下条件直接进样分析,每种浓度五样本,记录峰面积为C。A与C的比值为基质效应,B与A的比值为提取回收率,将B代入标准曲线回归方程,所得值与理论值的比值为方法回收率。内标溶液同法操作,即得内标物的基质效应和提取回收率,内标物只考察1个浓度即0.07 μg·mL-1。结果见表 1。由结果可知,待测物和内标物的基质效应均在92.2%~111.1%之间,提取回收率均大于81.4%,待测物方法回收率在97.9%~104.4%之间,符合生物样品定量分析方法的规定。
|
|
表 1 基质效应和回收率试验结果(mean±SD,n=5) Table 1 Results of matrix effect and recovery |
精密吸取高、中、低3种浓度的对照品溶液100μL,每种浓度5份,挥干溶剂后加入大鼠空白尿液200μL,按“2.4.2”项下方法操作,在“2.3”项条件下进样分析。将待测物与内标物峰面积的比值代入随行标曲得实测浓度,由实测浓度计算得日内精密度,实测浓度与理论浓度的相对偏差即为准确度。连续测定3 d,得日间精密度与准确度。结果见表 2。由结果可知,苍术苷A的日内及日间精密度、准确度均符合生物样品定量分析方法的规定。
|
|
表 2 精密度和准确度试验结果(mean±SD,n=5) Table 2 Results of precision and accuracy |
精密吸取高、中、低3种浓度的对照品溶液100μL,每种浓度5份,挥干溶剂后加入大鼠空白尿液200μL,按“2.4.2”项下方法操作,在“2.3”项条件下进样分析,分别考察室温放置6 h和-80 ℃反复冻融3次后的稳定性。结果见表 3。由结果可知,各组中苍术苷A实测值的RSD均在1.8%~4.6%之间,符合生物样品定量分析方法的规定。
|
|
表 3 稳定性试验结果(mean±SD,n=5) Table 3 Results of stability |
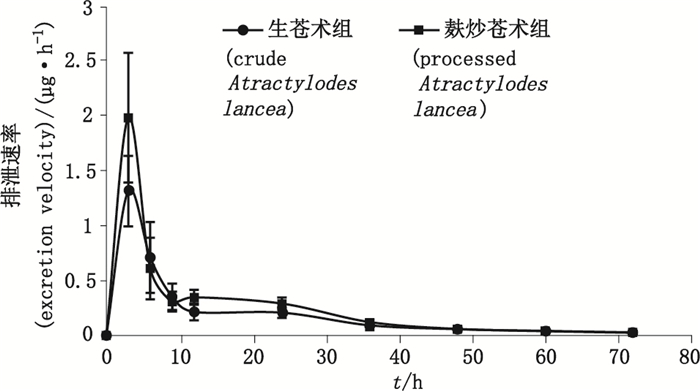
将处理后的尿液样品按“2.3”项下条件进样分析,采用DAS 3.2.8软件非静脉注射给药方式的尿药分析模式计算尿排泄动力学参数,采用Spss 17.0软件进行单因素方差分析,数据结果见表 4和表 5。排泄速率-时间曲线和累计排泄量-时间曲线见图 5和图 6。
|
|
表 4 生、麸炒苍术中苍术苷A的排泄结果(mean±SD,n=6) Table 4 Excretion results of atractyloside A in crude and processed Atractylodes lancea |
|
|
表 5 生、麸炒苍术中苍术苷A的尿排泄动力学参数(mean±SD,n=6) Table 5 Excretion parameters of atractyloside Ain crude and processed Atractylodes lancea |
|
图 5 排泄速率-时间曲线 Figure 5 Curves of excretion velocity-time |
|
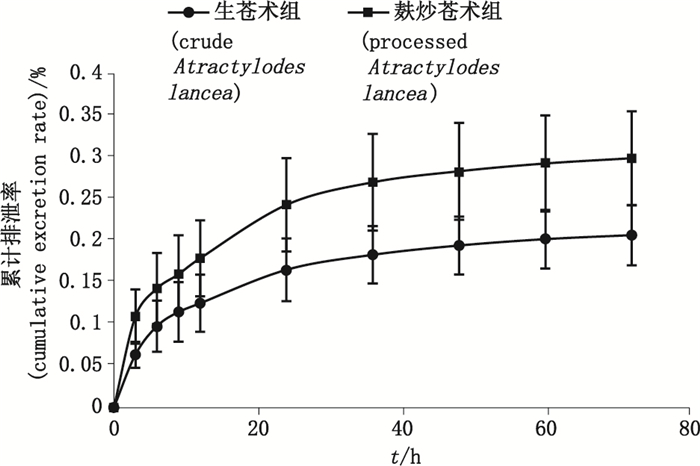
图 6 累积排泄率-时间曲线 Figure 6 Curves of cumulative excretion rate-time |
由表 5可知,生、麸炒苍术中苍术苷A的排泄动力学参数t1/2和ke均无统计学差异,表明麸炒对苍术苷A的尿排泄动力学规律无明显影响。但对比尿排总量和总尿排率可知,麸炒后苍术苷A 72 h的总排泄量和总排泄率均明显大于生品,结果具统计学意义(P < 0.05,P < 0.01)。由排泄速率-时间曲线可知,大鼠灌胃给予生、麸炒苍术提取物后其主要成分苍术苷A的尿排泄速率均可在3 h达到最大值,且麸炒后明显大于生品,此后排泄速率逐渐下降。由累计排泄率-时间曲线可知,给药后的24 h内苍术苷A的累计排泄率均上升较快,且于36 h时基本可达平台期,生苍术和麸炒苍术灌胃后苍术苷A 36 h累积排泄量即可达到总排泄量的88.55%和90.34%。
3 讨论采用UPLC-MS/MS多反应监测模式,建立了生、麸炒苍术给药后大鼠尿液中苍术苷A的浓度测定方法,该方法稳定性好,重复性高,符合生物样品定量分析的规定,可用于苍术苷A的排泄动力学研究。
课题组早期曾对苍术炮制前后主要成分苍术素和(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯的药代动力学以及组织分布规律进行研究[16-18],结果初步显示苍术炮制后体内吸收有所增加。本实验中,生、麸炒苍术提取物均按折合后相同的生药量灌胃给药,其中生、麸炒苍术提取物中苍术苷A的浓度分别为2.08、1.82 mg·mL-1(麸炒后浓度略有降低),但麸炒后苍术苷A的尿总排泄量却明显大于生品。结合苍术苷A前期的药代动力学结果,麸炒后血药浓度有所升高,推测该变化亦有可能与麸炒后苍术苷A的体内吸收增加有关。
生、麸炒苍术给药后72 h大鼠尿液中苍术苷A的累积排泄量分别为给药量的0.21%和0.26%,说明苍术苷A仅有小部分以原形形式通过尿液排泄,进而表明苍术苷A在体内可能存在吸收和转化,以代谢物或其他形式排出体外。
对比苍术麸炒前后苍术苷A的排泄动力学差异,可为苍术的炮制机理研究以及临床安全用药提供一定依据。由于机体的代谢过程复杂,且苍术中化学成分种类繁多,对单一成分的研究很难阐述整体的排泄规律,为进一步阐明炮制机理,还需对苍术中其他成分的排泄规律进行深入的研究。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 161 ChP 2015.VolⅠ[S].2015: 161 |
| [2] |
李宇馨, 李瑞海. 苍术挥发油抗炎活性研究[J]. 辽宁中医药大学学报, 2013, 15(2): 71. LI YX, LI RH. Anti-inflammatory activity of volatile oil extracted from Atractylodes lancea[J]. J Liaoning Univ TCM, 2013, 15(2): 71. |
| [3] |
尹秀芝, 浦卓, 王冰梅, 等. 中药苍术抗真菌作用的研究及临床观察[J]. 北华大学学报(自然科学版), 2000, 1(6): 492. YIN XZ, PU Z, WANG BM, et al. A preliminary study of Rhizoma Atractylodis in its antimycotic effect[J]. J Beihua Univ(Nat Sci), 2000, 1(6): 492. |
| [4] |
牛月华. 茅苍术多糖对Ⅱ型糖尿病大鼠的治疗作用及机制研究[J]. 北华大学学报, 2014, 15(4): 476. NIU YH. Therapeutic effect of Atractylodes lancea polysaccharides on type 2 diabetes mellitus rats and its mechanisms[J]. J Beihua Univ, 2014, 15(4): 476. |
| [5] |
何卓阳, 张齐, 王桃云, 等. 茅苍术醇提取物在子宫颈癌SKOV-3细胞的抗肿瘤作用[J]. 中药药理与临床, 2013, 29(2): 88. HE ZY, ZHANG Q, WANG TY, et al. The anti-timour effect of ethanol extract of Rhizoma Atractylodis on SKOV-3 cells[J]. Pharmacol Clin Chin Mater Med, 2013, 29(2): 88. |
| [6] |
塔西斯, 张洁, 杭永付, 等. 北苍术炮制前后水提取液和多糖部位保肝作用比较研究[J]. 现代中药研究与实践, 2011, 25(3): 45. BIWOELE T, ZHANG J, HANG YF, et al. Hepatoprotective activity of Atractylodes chinensis(DC.)Koidz. water extract and polysaccharides against CCl4-induced acute liver injury in mice[J]. Chin Med J Res Pract, 2011, 25(3): 45. |
| [7] |
吴祯久, 张红英, 朴惠善, 等. 关苍术正丁醇提取物的抗心律失常作用研究[J]. 中药药理与临床, 1996(5): 26. WU ZJ, ZHANG HY, PIAO HS, et al. Protective effects of n-butylethyl extract of Atractylodes japoniea Koidz.ex Kitam on experimental ventrieular arrhythmias[J]. Pharmacol Clin Chin Mater Med, 1996(5): 26. |
| [8] |
常晓文, 刘玉强, 才谦. 麸炒前后苍术HPLC指纹图谱[J]. 中国实验方剂学杂志, 2015, 21(4): 40. CHANG XW, LIU YQ, CAI Q. Fingerprints of raw and processed Atractylodis Rhizoma by HPLC[J]. Chin J Exp Tradit Med Form, 2015, 21(4): 40. |
| [9] |
赵晋, 邓金宝, 黎雄, 等. 苍术聚炔类化学成分研究[J]. 中药新药与临床药理, 2015, 26(4): 525. ZHAO J, DENG JB, LI X, et al. Analysis of polyacetylenes from Rhizoma Atractylodis[J]. Tradit Chin Drug Res Clin Pharmacol, 2015, 26(4): 525. |
| [10] |
张虎, 夏新中, 向丽娟, 等. 3种炮制方法对湖北茅苍术挥发油的化学成分的影响[J]. 中国实验方剂学杂志, 2015, 21(5): 83. ZHANG H, XIA XZ, XIANG LJ, et al. Chemical constituents of volatile oil from Hubei Atractylodes lancea by three processing methods[J]. Chin J Exp Tradit Med Form, 2015, 21(5): 83. |
| [11] |
王丹凤, 刘玉强, 才谦. 苍术麸炒前后健脾作用研究[J]. 时珍国医国药, 2013, 24(1): 155. WANG DF, LIU YQ, CAI Q. Study on the tonifying spleen effect of Atractylodes lancea before and after stir-baking with bran[J]. Lishizhen Med Mater Med Res, 2013, 24(1): 155. DOI:10.3969/j.issn.1008-0805.2013.01.068 |
| [12] |
庞雪, 刘玉强, 刘小丹, 等. 苍术麸炒前后活性部位药效比较研究[J]. 中国药房, 2016, 27(10): 1308. PANG X, LIU YQ, LIU XD, et al. Study on the pharmacodynamic comparison of active part in crude Atractylodes lancea and Atractylodes lancea fried with bran[J]. China Pharm, 2016, 27(10): 1308. DOI:10.6039/j.issn.1001-0408.2016.10.04 |
| [13] |
陶野, 张贝贝, 付梅红, 等. 基于色谱指纹图谱的苍术挥发油多成分体内药代动力学研究[J]. 中国实验方剂学杂志, 2013, 19(11): 156. TAO Y, ZHANG BB, FU MH, et al. Studies on pharmacokinetics of multi-constituents of atractylis oil based on chromatographic fingerprint[J]. Chin J Exp Tradit Med Form, 2013, 19(11): 156. |
| [14] |
蒋美玲, 张天柱, 樊湘泽. 苍术水提液与苍术素大鼠体内药代动力学比较[J]. 中药药理与临床, 2015, 31(2): 25. JIANG ML, ZHANG TZ, FAN XZ. Comparative pharmacokinetics of atractylodin between pure atractylodin and Atractylodes lancea(Thunb.)DC[J]. Pharmacol Clin Chin Mater Med, 2015, 31(2): 25. |
| [15] |
于艳, 才谦, 贾天柱. HPLC-ELSD法测定茅苍术生品及麸炒品中苍术苷A的含量[J]. 药物分析杂志, 2014, 34(9): 1601. YU Y, CAI Q, JIA TZ. Determination of atractyloside A in raw and bran fried rhizome of Atractylodes lancea by HPLC-ELSD[J]. Chin J Pharm Anal, 2014, 34(9): 1601. |
| [16] |
CHANG XW, XU CX, LIU YQ, et al. Determination and pharmacokinetic comparisons of atractylodin after oral administration of crude and processed Atractylodis Rhizoma[J]. Pharmacogn Mag, 2016, 12(45): 80. DOI:10.4103/0973-1296.176062 |
| [17] |
HUO Y, LIU YQ, BAI ZX, et al. Determination of(4E, 6E, 12E)-tetradecatriene-8, 10-diyne-1, 3-diyl diacetate in rat plasma and tissues by HPLC-UV method and their application to a pharmacokinetic and tissue distribution study[J]. J Anal Methods Chem, 2014, 2014(11): 249061. |
| [18] |
LIU YZ, LIU YQ, JIA R, et al. Determination and tissue distribution comparisons of atractylodin after oral administration of crude and processed Atractylodis Rhizoma[J]. Pharmacogn Mag, 2017, 13(51): 413. DOI:10.4103/pm.pm_394_16 |
 2018, Vol. 38
2018, Vol. 38 
