复方罗布麻片Ⅰ是由罗布麻叶、野菊花、防己、硫酸双肼屈嗪、氢氯噻嗪、盐酸异丙嗪、维生素B1、维生素B6和泛酸钙组成的中西药复方制剂,临床用于治疗高血压病。现行国家标准仅对其中的氢氯噻嗪进行含量测定,对盐酸异丙嗪和防己进行定性鉴别[1],而对处方中罗布麻叶和野菊花这2味具有降压作用的主药中的活性成分没有进行定量,显然不能有效控制该药品的质量。
罗布麻叶中的主要药效成分是黄酮类,金丝桃苷是含量较高的黄酮类成分之一,具有保护心脑血管和神经系统、保肝、抗炎、抗氧化等药理作用[2-4]。绿原酸和蒙花苷为野菊花的活性成分[5],具有抗炎、抗高血压等药理活性[6-7]。防己中的主要活性成分是粉防己碱和防己诺林碱,具有抗高血压、抗心肌损伤、抗心律失常、抗肿瘤、抗菌等药理活性[8-9]。《中华人民共和国药典》(2015年版)规定罗布麻叶、野菊花的指标性成分分别为金丝桃苷和蒙花苷,防己的指标性成分为粉防己碱和防己诺林碱[10]。由此可见,复方罗布麻片Ⅰ中这3味中药的主要活性成分均具有抗高血压作用,对其进行定量分析,对于控制该药品的质量十分重要。文献关于复方罗布麻片Ⅰ的含量测定,为测定其中的1~4个成分,大多数对其中1~2个成分进行定量[11-16],而同时测定该药品中的中药活性成分和西药成分的研究报道极为有限。
复方罗布麻片Ⅰ的化学成分较为复杂,本实验室前期已建立了以HPLC法同时测定该药品中硫酸双肼屈嗪、维生素B1、维生素B6和泛酸钙4个高极性西药成分的含量。本研究在实验条件探索过程中发现,各成分之间的极性、理化性质和色谱行为差异较大,采用同一种提取方法无法从样品中将西药和中药活性成分提取完全,难以同时进行定量分析,故需建立一种能同时对复方罗布麻片Ⅰ中另外2个西药成分以及中药活性成分进行含量测定的方法。
本研究建立了HPLC法同时测定复方罗布麻片Ⅰ中绿原酸、氢氯噻嗪、金丝桃苷、防己诺林碱、粉防己碱、蒙花苷和盐酸异丙嗪7个成分的含量,该方法准确、简便,专属性强,可为该药品的质量控制提供科学依据。
1 仪器与试药 1.1 仪器Agilent 1260液相系统:配有G1311C四元梯度泵,G1329B自动进样器,G1316A柱温箱,G4212B DAD检测器(Agilent Technologies,美国);Mettler XP-205电子天平(瑞士,梅特勒公司);KQ-800KDE型超声仪(昆山市超声仪器有限公司);Milli-Q超纯水处理系统(Millipore,美国)。
1.2 试药乙腈(色谱纯,美国Fisher公司,批号165747);磷酸(色谱纯,美国Fisher公司,批号154772);甲醇(分析纯,国药集团化学试剂有限公司,批号20161025);实验用水为超纯水。对照品绿原酸(批号110753-200413,纯度100%)、氢氯噻嗪(批号100309-201103,纯度99.8%)、金丝桃苷(批号111521-201708,纯度95.1%)、防己诺林碱(批号110793-201606,纯度98.8%)、粉防己碱(批号110711-200507,纯度100%)、蒙花苷(批号111528-201710,纯度96.6%)、盐酸异丙嗪(批号100422-201002,纯度99.4%)均购自中国食品药品检定研究院。复方罗布麻片Ⅰ(每片含氢氯噻嗪1.6 mg,盐酸异丙嗪1.05 mg;批号:F160805、D161206、D160510、D160904、D160604,生产厂家为山西云鹏制药有限公司;批号:160631、160128、150504,生产厂家为亚宝药业集团股份有限公司)。
2 方法与结果 2.1 色谱条件色谱柱:Waters XBridge C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.2%磷酸水溶液(B),梯度洗脱(0~15 min,15%A→20%A;15~25 min,20%A→25%A;25~35 min,25%A→30%A;35~45 min,30%A→35%A;45~55 min,35%A→65%A;55~65 min,65%A);流速:0.5 mL·min-1;检测波长:210 nm(检测防己诺林碱、粉防己碱),256 nm(检测氢氯噻嗪、金丝桃苷、盐酸异丙嗪),325 nm(检测绿原酸、蒙花苷);柱温:30 ℃;进样体积:10 μL。
2.2 混合对照品溶液的制备分别精密称取绿原酸、氢氯噻嗪、金丝桃苷、防己诺林碱、粉防己碱、蒙花苷、盐酸异丙嗪的对照品适量,用50%甲醇水溶液溶解,配制成质量浓度分别为90.72、2 432、206.9、166.9、334.0、35.52、156.4 μg·mL-1的混合对照品储备液。精密量取混合对照品储备液1、2.5、4、5、6、12.5、25 mL于50 mL量瓶中,加50%甲醇水溶液稀释至刻度,摇匀,获得一系列不同质量浓度的混合对照品溶液。
2.3 供试品溶液的制备取复方罗布麻片Ⅰ 20片,精密称定,研细,精密称取粉末约0.6 g,置于25 mL量瓶中,加入50%甲醇水溶液15 mL,振荡2 min,超声(800 W,40 kHz)60 min,加50%甲醇水溶液稀释至刻度,摇匀,经0.22 μm微孔滤膜滤过,取续滤液作为供试品溶液。
2.4 阴性溶液的制备依据复方罗布麻片Ⅰ说明书提供的配方,分别制备不含罗布麻叶、不含野菊花、不含防己、不含氢氯噻嗪、不含盐酸异丙嗪的阴性样品。制备工艺为:取罗布麻叶、野菊花,加水煎煮3次,每次1 h;另取防己加水煎煮3次,每次2 h,合并煎液,滤过,滤液浓缩至清膏,干燥,制成干浸膏。取干浸膏、三硅酸镁、硫酸双肼屈嗪、氢氯噻嗪、盐酸异丙嗪、维生素B1、维生素B6、泛酸钙分别粉碎或研细,过100目筛,加适量辅料,混匀,制成颗粒,干燥,整粒,压片。之后按“2.3”项下方法操作,制备阴性对照溶液。
2.5 专属性试验分别对阴性对照溶液、混合对照品溶液和供试品溶液进样分析,考察样品中其他成分和辅料对待测成分色谱峰的干扰。阴性对照溶液、混合对照品溶液和供试品溶液的色谱图(图 1)显示:样品中的其他成分及辅料不干扰绿原酸、氢氯噻嗪、金丝桃苷、防己诺林碱、粉防己碱、蒙花苷和盐酸异丙嗪的测定。
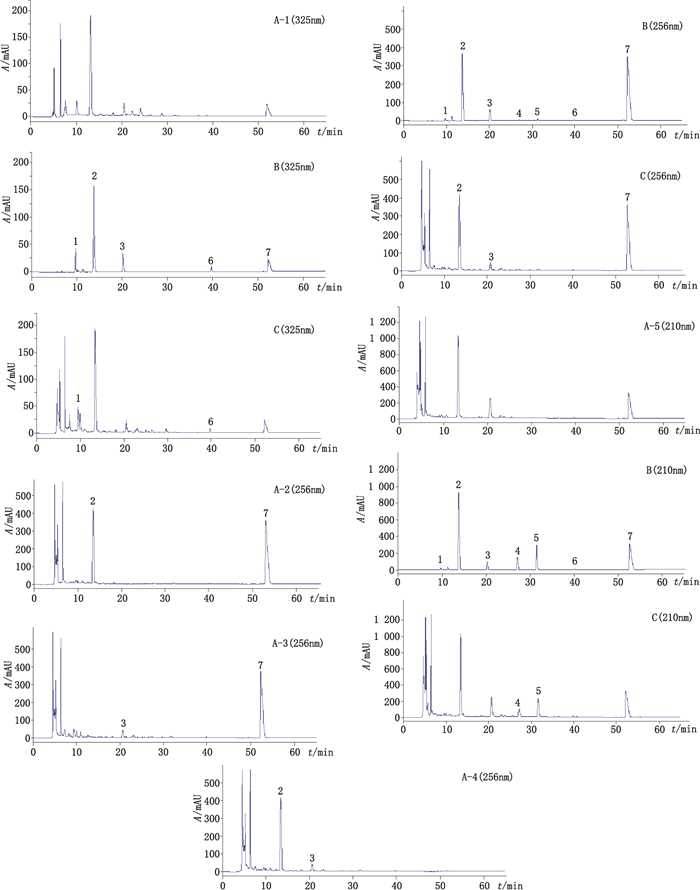
|
1.绿原酸(chlorogenic acid)2.氢氯噻嗪(hydrochlorothiazide)3.金丝桃苷(hyperoside)4.防己诺林碱(fangchinoline)5.粉防己碱(tetrandrine)6.蒙花苷(buddleoside)7.盐酸异丙嗪(promethazine hydrochloride) A-1.缺野菊花阴性样品(negative sample without Chrysanthemi Indici Flos)A-2.缺罗布麻叶阴性样品(negative sample without Apocyni Veneti Folium)A-3.缺氢氯噻嗪阴性样品(negative sample without hydrochlorothiazide)A-4.缺盐酸异丙嗪阴性样品(negative sample without promethazine hydrochloride)A-5.缺防己阴性样品(negative sample without Stephaniae Tetrandrae Radix) 图 1 阴性溶液(A)、混合对照品溶液(B)和供试品溶液(C)的HPLC图谱 Figure 1 HPLC chromatograms of negative sample solution(A), mixed reference solution(B), and analytical sample solution(C) |
在“2.1”项色谱条件下,7个待测成分的理论塔板数均大于15 000,样品中7个待测成分色谱峰与相邻峰的分离度R大于1.5。分别精密吸取“2.2”项下各浓度混合对照品溶液10 μL,注入液相色谱仪,按上述色谱条件测定,以峰面积为纵坐标,浓度(μg·mL-1)为横坐标作标准曲线,得到回归方程和线性相关系数(r)。将对照品溶液逐级稀释后,以信噪比(S/N)约为3.0时的浓度为各成分的检测下限(LOD),S/N约为10.0时的浓度为各成分的定量下限(LOQ)。结果见表 1。
|
|
表 1 回归方程、线性范围、检测下限及定量下限 Table 1 The regression equations, linear ranges, LODs and LOQs |
精密吸取同一供试品(批号F160805)溶液,按“2.1”项下色谱条件,连续进样6次,记录峰面积,计算RSD。结果绿原酸、氢氯噻嗪、金丝桃苷、防己诺林碱、粉防己碱、蒙花苷和盐酸异丙嗪色谱峰峰面积的RSD(n=6)分别为0.89%、0.20%、0.54%、0.34%、0.16%、0.23%和0.11%,表明仪器的精密度良好。
2.8 重复性试验取同一批号(批号F160805)样品6份,按“2.3”项下的方法制备供试品溶液,分别进样分析,计算得到绿原酸、氢氯噻嗪、金丝桃苷、防己诺林碱、粉防己碱、蒙花苷、盐酸异丙嗪的含量平均值分别为0.057 09、1.599 0、0.127 1、0.105 2、0.207 0、0.021 69、1.037 4 mg·片-1,RSD(n=6)分别为0.59%、0.93%、1.5%、1.5%、1.1%、1.8%,说明方法的重复性良好。
2.9 稳定性试验取同一供试品(批号F160805)溶液,分别于配制后的0、2、4、8、12、24 h进样分析,记录峰面积,计算得到24 h内绿原酸、氢氯噻嗪、金丝桃苷、防己诺林碱、粉防己碱、蒙花苷和盐酸异丙嗪色谱峰峰面积的RSD(n=6)分别为0.73%、0.24%、0.31%、0.37%、0.29%、0.42%和0.28%,表明供试品溶液在24 h内稳定性良好。
2.10 加样回收率试验取已测知含量的同一批次(批号F160805)复方罗布麻片Ⅰ,研细,精密称取9份,分成3组,每组3份,各组分别加入对照品溶液适量(分别相当于样品中各被测成分含量的80%、100%、120%),照供试品溶液的制备方法制得各加样供试品溶液,进样测定,计算各被测成分的回收率和RSD,结果见表 2,表明该方法的回收率良好。
|
|
表 2 加样回收率试验结果 Table 2 Results of recovery test |
按“2.3”项下方法,取8批复方罗布麻片Ⅰ分别制备供试品溶液,精密称取各供试品溶液适量,按“2.1”项色谱条件注入高效液相色谱仪进行测定,每个样品测定2份,计算7个成分的含量。结果见表 3。
|
|
表 3 样品中含量测定结果(mg·片-1,n=2) Table 3 Determination results of samples(mg per tablet, n=2) |
根据各成分在流动相中的紫外吸收谱图来确定检测波长。绿原酸、氢氯噻嗪、金丝桃苷、蒙花苷、盐酸异丙嗪分别在326、272、256、334、252 nm处有最大吸收,防己诺林碱和粉防己碱在206 nm有最大吸收,兼顾7个成分在样品色谱图中的响应值,综合考虑,最终选择210 nm作为防己诺林碱和粉防己碱的检测波长,256 nm作为氢氯噻嗪、金丝桃苷和盐酸异丙嗪的检测波长,325 nm作为绿原酸和蒙花苷的检测波长。
3.2 色谱条件的优化本研究考察了采用乙腈-水、甲醇-水、乙腈-0.1%磷酸、乙腈-0.2%磷酸、乙腈-0.5%磷酸溶液作为流动相对7个待测成分的影响,结果显示,用乙腈-0.2%和0.5%磷酸水时的效果较好且基本一致,故选择乙腈-0.2%磷酸水溶液为流动相。考察了不同梯度洗脱程序,并比较了不同流速(0.5、0.8、1.0 mL·min-1)、不同进样体积(5、10、20 μL)、不同柱温(25、30、35 ℃)对色谱分离效果的影响,结果显示在最终确定的色谱条件下,7个待测成分的理论塔板数均大于15 000,待测成分间以及与样品中其他成分、辅料之间的分离度良好。
3.3 提取方法的选择本研究比较了分别采用乙腈-0.2%磷酸水溶液(1:4)、甲醇-0.2%磷酸水溶液(1:4)、50%甲醇水溶液作为提取溶剂对7个成分的影响,结果显示用50%甲醇水提取时可以将7个待测成分提取完全,尤其是对金丝桃苷、氢氯噻嗪和盐酸异丙嗪的提取率影响较为明显,故选为最终的提取溶剂。比较了不同超声提取时间(25、40、60 min),结果显示超声时间为60 min时对各成分的提取率最高,确定为提取时间。比较了加提取溶剂稀释至不同体积(25、50 mL)的影响,结果显示稀释至25 mL时各成分的响应值合适。
3.4 样品含量测定结果分析氢氯噻嗪的标示量为1.6 mg·片-1,现行标准规定,含量应为标示量的85%~115%(即1.36~1.84 mg·片-1);本研究测定的8批样品中氢氯噻嗪含量为标示量的90.41%~ 98.89%,均符合规定。盐酸异丙嗪的含量为标示量的87.24%~99.17%,但是标准中未对其含量作规定。各批次样品中的中药活性成分含量有一定差异,其中绿原酸和蒙花苷的差异较大,含量范围分别为0.056 88~0.237 5和0.013 74~0.045 01 mg·片-1,相差4.2倍和3.3倍。建议在今后标准修订时,增加对盐酸异丙嗪以及中药指标性成分的含量规定,从而更有利于该药品的质量评价。
3.5 方法学验证本研究的方法学验证参照国际通行的ICH方法学验证原则[17-18]进行,内容包括系统适应性、线性、检测下限、定量下限、专属性、精密度、重复性、稳定性、准确度,结果表明建立的分析方法准确、可靠,专属性强,适合于复方罗布麻片Ⅰ中绿原酸、氢氯噻嗪、金丝桃苷、防己诺林碱、粉防己碱、蒙花苷和盐酸异丙嗪的准确测定,可为复方罗布麻片Ⅰ的质量控制提供参考。
| [1] |
国家药品标准: 化学药品地方标准上升国家标准[S].WS-10001-(HD-1089)-2002 National Drug Standards: National Standards for Chemicals Promoted form Local Standards in national standards[S].WS-10001-(HD-1089)-2002 |
| [2] |
侯晋军, 韩利文, 杨官娥, 等. 罗布麻叶化学成分和药理活性研究进展[J]. 中草药, 2006, 37(10): s7. HOU JJ, HAN LW, YANG GE, et al. Advances in chemical constituents and pharmacological activities of Apocynum venetum L.[J]. Chin Tradit Herb Drugs, 2006, 37(10): s7. |
| [3] |
林萍, 易宏伟, 张斐. 金丝桃苷药理作用研究进展[J]. 中国现代中药, 2012, 14(10): 23. LIN P, YI HW, ZHANG F. Advances in pharmacological effects of hyperin[J]. Mod Chin Med, 2012, 14(10): 23. DOI:10.3969/j.issn.1673-4890.2012.10.006 |
| [4] |
李锦松, 陈剑鸿, 孟民杰. 金丝桃苷药理作用及其作用机制的研究进展[J]. 广东药学院学报, 2015, 31(2): 269. LI JS, CHEN JH, MENG MJ. Progress in the pharmacological effects and mechanism of hyperoside[J]. J Guangdong Pharm Univ, 2015, 31(2): 269. |
| [5] |
陈立柱, 刘辉, 潘鹏飞. HPLC法同时测定野菊花中绿原酸和蒙花苷的含量[J]. 中国药师, 2011, 14(12): 1753. CHEN LZ, LIU H, PAN PF. Simultaneous determination of chlorogenic acid and buddleoside in Flos Chrysanthemi Indici by HPLC[J]. China Pharm, 2011, 14(12): 1753. DOI:10.3969/j.issn.1008-049X.2011.12.017 |
| [6] |
魏明, 杨晓梅, 刘佳红, 等. 绿原酸的药理作用研究进展[J]. 陕西中医, 2016, 37(4): 511. WEI M, YANG XM, LIU JH, et al. Advances in pharmacological effects of chlorogenic acid[J]. Shaanxi J Tradit Chin Med, 2016, 37(4): 511. DOI:10.3969/j.issn.1000-7369.2016.04.063 |
| [7] |
张燕坪, 陈素红, 吕圭源, 等. 野菊花有效组分对高血压大鼠血液流变学的影响[J]. 浙江中医药大学学报, 2013, 37(4): 370. ZHANG YP, CHEN SH, LÜ GY, et al. Effective composition of Flos Chrysanthemi on blood hemorheology effect in spontaneously hypertensive rats[J]. J Zhejiang Chin Med Univ, 2013, 37(4): 370. DOI:10.3969/j.issn.1005-5509.2013.04.003 |
| [8] |
王蓉, 马腾茂, 刘飞, 等. 防己的药理作用及临床应用研究进展[J]. 中国中药杂志, 2017, 42(4): 634. WANG R, MA TM, LIU F, et al. Research progress in pharmacological action and clinical application of Stephania Tetrandrae Radix[J]. China J Chin Mater Med, 2017, 42(4): 634. |
| [9] |
邢志博, 王凤梅, 王翠平, 等. 粉防己有效成分的药理活性研究进展[J]. 中国实验方剂学杂志, 2014, 20(9): 241. XING ZB, WANG FM, WANG CP, et al. Advances on pharmacological effects of active constituents in Stephania tetrandra[J]. Chin J Exp Tradit Med Form, 2014, 20(9): 241. |
| [10] |
中华人民共和国药典2015年版.二部[S].2015: 211, 314, 148 ChP.2015.Vol Ⅱ[S].2015: 211, 314, 148 |
| [11] |
杨玲霞, 朱旭江, 叶艳芬. HPLC法测定复方罗布麻片Ⅰ中金丝桃苷的含量[J]. 中国民族民间医药, 2015, 6: 14. YANG LX, ZHU XJ, YE YF. Determination of hyperoside in Compound Kendir Leaves tablets Ⅰ by HPLC[J]. Chin J Ethnomed Ethnopharm, 2015, 6: 14. |
| [12] |
钱忠义. HPLC法测定复方罗布麻片Ⅰ中3组分的含量[J]. 中国药师, 2009, 12(9): 1265. QIAN ZY. Determination of contents of three components in Compound Kendir Leaves tablets Ⅰ by HPLC[J]. China Pharm, 2009, 12(9): 1265. DOI:10.3969/j.issn.1008-049X.2009.09.042 |
| [13] |
邬伟魁, 严倩茹, 郭振宇, 等. HPLC-DAD法同时测定复方罗布麻片Ⅰ中4种成分[J]. 中成药, 2017, 39(8): 1625. WU WK, YAN QR, GUO ZY, et al. Simultaneous determination of four constituents in Compound Kendir Leaves tablets Ⅰ by HPLC-DAD[J]. Chin Tradit Pat Med, 2017, 39(8): 1625. DOI:10.3969/j.issn.1001-1528.2017.08.017 |
| [14] |
王玲娜, 张晓璐, 丁建. HPLC法对复方罗布麻片Ⅰ中主要化学成分的检测[J]. 齐鲁药事, 2011, 30(2): 83. WANG LN, ZHANG XL, DING J. Determination of main chemical constituents in Compound Kendir Leaves tablets Ⅰ by HPLC[J]. Qilu Pharm Aff, 2011, 30(2): 83. |
| [15] |
卢晓梅. HPLC法同时测定复方罗布麻片Ⅰ中氢氯噻嗪和盐酸异丙嗪的含量及含量均匀度[J]. 中国药师, 2017, 17(11): 1891. LU XM. Simultaneous determination of content and uniformity of hydrochlorothiazide and promethazine hydrochloride in Compound Kendir Leaves tablets Ⅰ by HPLC[J]. China Pharm, 2017, 17(11): 1891. |
| [16] |
孙鲁江, 王乃东. 复方罗布麻片(Ⅰ)中氢氯噻嗪的含量测定研究[J]. 中国实用医药, 2012, 7(31): 246. SUN LJ, WANG ND. Determination of hydrochlorothiazide in Compound Kendir Leaves tabletsⅠ[J]. Chin Prac Med, 2012, 7(31): 246. DOI:10.3969/j.issn.1673-7555.2012.31.202 |
| [17] |
ICH-Q2A.Text on Validation of Analytical Procedures[S].1995
|
| [18] |
ICH-Q2B.Validation of Analytical Procedures: Methodology[S].1996
|
 2018, Vol. 38
2018, Vol. 38 
