2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
小儿豉翘清热颗粒由连翘、炒栀子、黄芩、赤芍等14味中药组成,具有疏风解表、清热导滞的功效,用于小儿风热感冒夹滞证[1],临床上主要用于治疗小儿手足口病、疱疹性咽炎、急性扁桃体炎、发热、急性上呼吸道感染[2]。处方中(炒)栀子、黄芩、连翘、厚朴、甘草、赤芍、大黄的主要活性成分为栀子苷、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素、连翘苷、连翘酯苷A、千层纸素A-7-O-β-D-葡萄糖醛酸苷、甘草酸、甘草苷、芍药苷、类化合物。小儿豉翘清热颗粒的相关文献研究主要集中在HPLC、UPLC对1种或多种成分的含量测定,未见一测多评法(quantitative analysis of multi-components by single-marker,QAMS)对小儿豉翘清热颗粒的质量控制相关文献[3-5]。
QAMS是采用药材(或成药)中的某一有效成分作为内参物,建立内参物与其他待测成分间的相对校正因子(f),利用f测定其他成分含量的方法,该方法适用于对照品难得或制备成本高等情况下多成分的同时测定[5-8],应用于中药材、中药饮片、中成药等同类型或不同类型多种成分指标的测定,为中药的质量提供保障[9-20]。
本研究以黄芩苷为内参物,建立黄芩苷与其他8个成分的f,利用f计算小儿豉翘清热颗粒中各成分的含量,并与外标法(external standard method,EMS)进行比较,验证QAMS法的准确性与可行性。
1 仪器与材料超高效液相色谱仪Acquity H-class(四元超高压溶剂系统、自动进样器样品管理器、二极管阵列检测器(PDA)、Empower 3色谱工作站,美国Waters科技有限公司);Thermo Scientific Vanquish超高效液相色谱仪(配置DAD检测器)、Chromeleon 7色谱工作站,赛默飞世尔科技有限公司;色谱柱:Acquity UPLC BEH C18(2.1 mm×100 mm,1.7 μm)、Acquity UPLC HSS T3 C18(2.1 mm×100 mm,1.8 μm)、Agilent ZORBAX Extend C18(2.1 mm×100 mm,1.8 μm);METTLER XP6型百万分之一电子分析天平、XSE205DU型十万分之一电子分析天平(瑞士梅特勒-托利多仪器有限公司);KQ-500B超声仪(江苏昆山市超声仪器有限公司)。
对照品栀子苷(批号110749-201617,纯度98.4%)、黄芩苷(批号110715-201619,纯度93.5%)、连翘苷(批号110821-201514,纯度93.5%)、连翘酯苷A(批号111810-201103,纯度92.9%)、汉黄芩苷(批号112002-201702,纯度98.5%)、黄芩素(批号111595-200905,纯度98.5%)、汉黄芩素(批号111514-201605,纯度100%)、芍药苷(批号110736-201640,纯度95.2%)均购于中国食品药品检定研究院,千层纸素A-7-O-β-D-葡萄糖醛酸苷(批号16080301,纯度98%)购于成都普菲德生物技术有限公司;小儿豉翘清热颗粒(规格:每袋2g,济川药业集团有限公司生产,批号:1801134、1801094、1801104、1801044、1706144、1708054、1708134、1801084、1711014、1801054、170302);乙腈为色谱纯,水为超纯水,磷酸为分析纯。
2 方法与结果 2.1 溶液的制备 2.1.1 混合对照品溶液分别精密称取栀子苷、芍药苷、连翘酯苷A、黄芩苷、连翘苷、千层纸素A-7-O-β-D-葡萄糖醛酸苷、汉黄芩苷、黄芩素和汉黄芩素的对照品适量,加甲醇溶解,制得质量浓度分别为199.1、119.9、87.80、196.4、36.04、28.17、51.02、2.804、7.225 μg·mL-1的混合对照品储备液。分别精密吸取混合对照品储备液适量,加初始流动相配制成一系列浓度的混合对照品溶液,备用。
2.1.2 供试品溶液取小儿豉翘清热颗粒约2 g,精密称定,置具塞锥形瓶中,精密加入甲醇20 mL,称量,超声处理(功率200 W,频率40 kHz)40 min,再称量,用甲醇补足减失的量,滤过。取续滤液5 mL,置10 mL量瓶中,用初始流动相稀释并定容至刻度,过0.22 μm微孔滤膜,备用。
2.1.3 阴性样品溶液按照小儿豉翘清热颗粒工艺方法,制备缺(炒)栀子、赤芍、黄芩、连翘4味药材的阴性样品,按照“2.1.2”项下方法处理并制备溶液,即得。
2.2 色谱条件以Acquity UPLC BEH C18(2.1 mm×100 mm,1.7 μm)为色谱柱;乙腈为流动相A,0.2%磷酸水溶液为流动相B,梯度洗脱(0~9.5 min,10%A→ 16.95%A;9.5~10.5 min,16.95%A→19%A;10.5~ 13.5 min,19%A→20%A;13.5~22 min,20%A→ 35%A;22~27 min,35%A→45%A;27~31 min,45%A→ 80%A;31~35 min,80%A);流速:0.25 mL·min-1,检测波长220 nm,柱温25 ℃。在上述色谱条件下,9个成分分离度均大于1.5,色谱图见图 1。
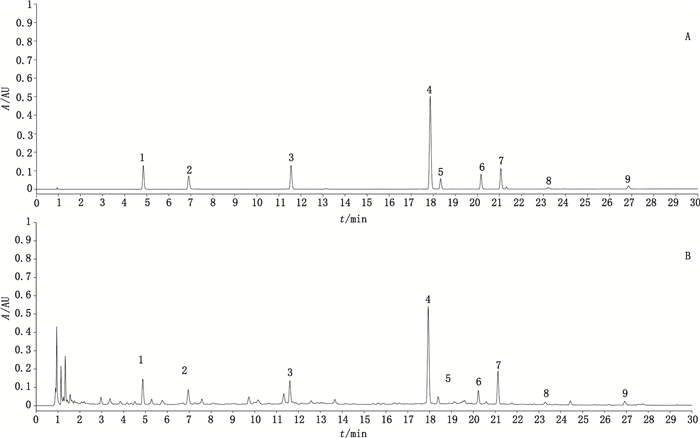
|
1.栀子苷(geniposide)2.芍药苷(paeoniflorin)3.连翘酯苷A(forsythoside A)4.黄芩苷(baicalin)5.连翘苷(forsythin)6.千层纸素A-7-O-β-D-葡萄糖醛酸苷(oroxylin A-7-O-glucuronide)7.汉黄芩苷(wogonoside)8.黄芩素(baicalein)9.汉黄芩素(wogonin) 图 1 混合对照品(A)及供试品(B)的UPLC图谱 Figure 1 UPLC chromatograms of mixed reference substances(A)and sample(B) |
超高效液相色谱仪(Acquity H-class)PDA检测器从190~400 nm全波长扫描,结果栀子苷在239 nm,芍药苷在232 nm,连翘酯苷A在218和327 nm,黄芩苷在214、277和316 nm,连翘苷在228和276 nm,千层纸素A-7-O-β-D-葡萄糖醛酸苷在270和311 nm,汉黄芩苷在273和339 nm,黄芩素在215、274和321 nm,汉黄芩素在275 nm处有最大吸收,结合9个成分3D色谱图,最终确定220 nm作为检测波长。前期波长考察试验时,对比9个成分分别在其最大吸收波长处与220 nm处测得的含量,最终得到的结果一致,说明选择220 nm作为检测波长较为合适。
2.4 QAMS方法学考察 2.4.1 专属性考察分别精密吸取混合对照品溶液2 μL,供试品溶液、阴性样品溶液各1 μL,进样分析。结果显示,供试品溶液中各待测成分色谱峰分离度较好,阴性样品溶液在相应位置处无干扰。
2.4.2 线性关系考察在“2.2”项色谱条件下,分别精密吸取混合对照品溶液2 μL,注入超高效液相色谱仪,记录色谱图。以对照品溶液质量浓度(X)为横坐标,峰面积(Y)为纵坐标,进行线性回归。结果见表 1。
|
|
表 1 9个成分线性关系考察结果 Table 1 Results of linear relationship of nine components |
取“2.4.2”项下的同一混合对照品溶液,连续进样6针,记录各组分色谱峰峰面积并计算RSD,结果栀子苷、芍药苷、连翘酯苷A、黄芩苷、连翘苷、千层纸素A-7-O-β-D-葡萄糖醛酸苷、汉黄芩苷、黄芩素、汉黄芩素峰面积的RSD分别为0.67%、0.54%、0.47%、0.30%、0.58%、0.55%、0.17%、0.74%、0.59%,表明仪器精密度良好。
2.4.4 稳定性试验精密称取9个对照品适量,加适量甲醇溶解制备成相应浓度的混合对照品溶液;取样品(批号1801134),按照“2.1.2”项下方法制备供试品溶液。于制备后0、2、4、6、8、12和24 h,分别取混合对照品和供试品溶液,注入超高效液相色谱仪,分别计算各组分色谱峰峰面积的RSD。结果栀子苷、芍药苷、连翘酯苷A、黄芩苷、连翘苷、千层纸素A-7-O-β-D-葡萄糖醛酸苷、汉黄芩苷、黄芩素、汉黄芩素对照品峰面积的RSD分别为0.85%、0.22%、0.83%、0.75%、1.0%、0.93%、0.53%、0.45%、0.64%,样品峰面积的RSD分别为1.8%、0.56%、0.48%、0.56%、0.35%、1.5%、1.3%、1.0%、0.92%,表明各组分在24 h内稳定性良好。
2.4.5 重复性试验取样品(批号1801134),按照“2.1.2”项下方法制备6份供试品溶液,每份平行做2份,测定并计算各成分的含量。结果栀子苷、芍药苷、连翘酯苷A、黄芩苷、连翘苷、千层纸素A-7-O-β-D-葡萄糖醛酸苷、汉黄芩苷、黄芩素、汉黄芩素的含量分别为4.479、2.891、1.239、3.955、0.532 4、0.558 7、1.247、0.076 97、0.115 1 mg·g-1,RSD分别为1.0%、1.6%、0.93%、1.3%、1.8%、1.4%、1.5%、1.9%、2.0%,表明该方法重复性良好。
2.4.6 加样回收率取已知含量的小儿豉翘清热颗粒样品(批号1801134)共6份,每份1.0 g,精密称定,置具塞锥形瓶中,分别精密加入各对照品或对照品溶液适量,按照“2.1.2”项下方法制备供试品溶液,测定并计算各成分的回收率。结果栀子苷、芍药苷、连翘酯苷A、黄芩苷、连翘苷、千层纸素A-7-O-β-D-葡萄糖醛酸苷、汉黄芩苷、黄芩素、汉黄芩素的平均加样回收率(n=6)分别为100.1%、96.3%、95.7%、102.5%、101.3%、100.0%、101.6%、99.2%、96.9%,RSD分别为0.50%、1.0%、0.57%、1.7%、1.5%、2.3%、1.3%、0.63%、1.4%,表明该方法的准确度良好。
2.5 f的确定 2.5.1 f的测定精密吸取“2.1.1”项下各浓度的混合对照品溶液2 μL,注入超高效液相色谱仪,按照“2.2”项下色谱条件测定,记录相应的色谱峰面积。以黄芩苷为内参物,计算栀子苷、芍药苷、连翘酯苷A、连翘苷、千层纸素A-7-O-β-D-葡萄糖醛酸苷、汉黄芩苷、黄芩素和汉黄芩素的f,计算公式如下:
| $ f = {f_{\rm{s}}}/{f_{\rm{k}}} = {W_{\rm{s}}}{A_{\rm{k}}}/{W_{\rm{k}}}{A_{\rm{s}}} $ |
式中:Ak为内参物峰面积,Wk为内参物浓度,As为某待测成分峰面积,Ws为某待测成分浓度,结果见表 2。
|
|
表 2 以黄芩苷为内参物的8个成分的f Table 2 The f of eight components with baicalin as an internal standard |
本研究采用相对保留时间对待测成分色谱峰进行定位,即各待测成分与黄芩苷间保留时间的比值,结果栀子苷、芍药苷、连翘酯苷A、连翘苷、千层纸素A-7-O-β-D-葡萄糖醛酸苷、汉黄芩苷、黄芩素、汉黄芩素与黄芩苷的相对保留时间分别为0.245、0.368、0.647、1.055、1.173、1.209、1.330、1.501,RSD分别为5.0%、3.8%、2.5%、4.7%、3.3%、4.0%、3.7%、4.9%。
2.5.3 不同仪器、色谱柱对f的影响本实验考察了2台超高效液相色谱仪(Waters H-Class、Thermo Scientific Vanquish)和3个色谱柱(Waters BEH C18、Waters HSS T3 C18、Agilent ZORBAX Extend C18)对f的影响,结果8个成分f的RSD分别为1.3%、1.8%、0.27%、2.0%、0.73%、0.56%、3.4%、1.6%,表明不同仪器、不同色谱柱对各成分的f无显著影响,结果见表 3。
|
|
表 3 不同仪器、不同色谱柱对f的影响 Table 3 The relative correction factors determined by different instruments and columns |
本实验考察了不同柱温(23、25、27 ℃)对各f的影响,结果8个成分f的RSD分别为0.42%、0.90%、0.30%、0.29%、0.43%、1.2%、1.7%、0.68%,表明不同柱温对各成分的f无显著影响,结果见表 4。
|
|
表 4 不同柱温对f的影响 Table 4 The relative correction factors determined by different column temperature |
根据以上考察结果,最终确定栀子苷、芍药苷、连翘酯苷A、连翘苷、千层纸素A-7-O-β-D-葡萄糖醛酸苷、汉黄芩苷、黄芩素和汉黄芩素的f分别为4.621 1、4.105 5、1.825 3、1.796 5、1.040 2、1.339 8、0.647 4、0.888 7。
2.6 QAMS与EMS测定结果的比较取10批样品,按照“2.1.2”项下方法制备供试品溶液,按“2.2”项下色谱条件进样测定,记录各色谱峰峰面积,采用外标法对8个成分及黄芩苷进行定量测定,再用所建立的QAMS法进行定量计算,以验证QAMS法用于小儿豉翘清热颗粒中多指标评价的准确性,结果见表 5。2种方法测得的各成分含量无明显差异,表明建立的方法准确性较好。
|
|
表 5 QAMS与ESM测定小儿豉翘清热颗粒中9个成分的对比结果(mg·g-1,n=2) Table 5 Comparison of determination results of Xiao'er Chiqiao Qingre granules by QAMS and ESM |
根据文献报道,小儿豉翘清热颗粒质量控制研究的含量指标多集中在1~2个成分[19-21],前期本项目组研究建立了UPLC法,用于同时检测小儿豉翘清热颗粒中栀子苷、芍药苷、连翘酯苷A、黄芩苷、连翘苷、甘草酸、大黄酸、和厚朴酚、厚朴酚9个成分的含量[5]。虽然采用该法使小儿豉翘清热颗粒质量控制标准有所提高,但所需对照品品种较多,成本较高,因此希望建立1种既能提高质量控制标准,又能降低检测成本的方法。QAMS在原多成分检测方法基础上,保留了栀子苷、芍药苷、连翘酯苷A、黄芩苷、连翘苷,舍弃了甘草酸、大黄酸、和厚朴酚、厚朴酚4个含量较低的成分,并增加了千层纸素A-7-O-β-D-葡萄糖醛酸苷、汉黄芩苷、黄芩素、汉黄芩素4个成分。
3.2 内参物的选择本实验曾选择栀子苷、芍药苷、连翘苷、黄芩苷作为内参物,建立QAMS法计算各成分的量,通过与ESM的计算结果比较,以黄芩苷作为内参物的相对偏差波动范围小,故选择含量高、出峰时间居中的黄芩苷作为内参物。
3.3 色谱条件 3.3.1 检测波长的选择本实验测定的9个指标成分具有不同类型的化学结构,紫外吸收亦不相同,为保证各成分都具有适宜的灵敏度与精密度,采用二极管阵列检测器在210~400 nm分析对照品溶液和供试品溶液,发现供试品溶液在220 nm时9个成分均有较合适的吸收,分别对比9个成分的最大吸收波长测得含量和220 nm测得含量,结果均无显著差异。因此,确定检测波长为220 nm。
3.3.2 分离条件的优化本研究测定的指标成分为不同类型的化合物且极性差异大,在HPLC上进行方法摸索时间较长(100 min以上),为提高分析检测的时间又使各成分得到较好的分离,本实验在现有小儿豉翘清热颗粒质量研究[5]的基础上,利用UPLC梯度洗脱,并优化洗脱条件,达到同时检测小儿豉翘清热颗粒中9个成分的目的。该条件极大地缩短了分析时间,且精密度、重复性等方法学考察均符合要求,可用于小儿豉翘清热颗粒的质量控制。
3.4 QAMS中色谱峰的定位待测成分色谱峰的准确定位是保证QAMS应用的前提,一般采用保留时间差或相对保留时间的方法。本研究分别采用2种方法进行峰定位,结果发现:采用保留时间差法,各待测成分与黄芩苷在不同色谱柱上RSD均大于5.0%;采用相对保留时间法,计算的各组分与黄芩苷的相对保留时间RSD在5.0%范围内,故采用相对保留时间法对各色谱峰进行定位。
3.5 QAMS的耐用性考察本研究考察了2种超高效液相色谱仪Waters H-Class、Thermo Scientific Vanquish及Waters BEH C18、Waters HSS T3 C18、Agilent ZORBAX Extend C18色谱柱,结果表明,不同仪器及色谱柱对各f的RSD及各成分相对保留时间的RSD均小于5%,表明该方法耐用性良好。
4 结论QAMS不仅可以在缺少对照品的情况下实现定量分析和质量控制,而且能较大程度地降低多成分含量测定的检验成本。本研究建立了QAMS测定小儿豉翘清热颗粒中9个成分含量,即通过测定其中1个成分(黄芩苷),建立该成分与其他有效成分(栀子苷、芍药苷、连翘酯苷A、连翘苷、千层纸素A-7-O-β-D-葡萄糖醛酸苷、汉黄芩苷、黄芩素、汉黄芩素)间的f,计算各成分的含量,实现多指标组分的同步测定。利用相对保留时间法对各色谱峰进行准确定位。多批样品测定的结果显示,QAMS与EMS在多指标成分定性、定量上无显著性差异,可以作为1种简便准确的质量评价模式,用于小儿豉翘清热颗粒中9个成分的含量测定。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 553 ChP 2015.Vol Ⅰ[S].2015: 553 |
| [2] |
宋根伟, 王鑫, 金萍, 等. 小儿豉翘清热颗粒临床应用进展[J]. 中国药业, 2015, 24(2): 91. SONG GW, WANG X, JIN P, et al. Progress in clinical application of Xiao'er Chiqiao Qingre granules[J]. China Pharm, 2015, 24(2): 91. |
| [3] |
周蓬, 宋青, 马帅. HPLC法同时测定小儿豉翘清热颗粒中栀子苷、芍药苷、黄芩苷、黄芩素和汉黄芩素[J]. 中成药, 2013, 35(8): 1693. ZHOU P, SONG Q, MA S. Simultaneous determination of geniposide, peoniflorin, baicalin, baicalein, and wogonin in Xiao'er Chiqiao Qingre granules by HPLC[J]. Chin Tradit Pat Med, 2013, 35(8): 1693. DOI:10.3969/j.issn.1001-1528.2013.08.024 |
| [4] |
宋根伟, 金萍, 赵利军, 等. HPLC同时测定小儿豉翘清热颗粒中两种苷含量[J]. 湖北医药学院学报, 2015, 34(4): 344. SONG GW, JIN P, ZHAO LJ, et al. Simultaneous determination of the contents of geniposide and baicalin in Xiaoer Chiqiao Qingre granule by high performance liquid chromatography[J]. J Hubei Univ Med, 2015, 34(4): 344. |
| [5] |
田刚, 杨学芳, 李超, 等. UPLC法同时检测小儿豉翘清热颗粒中9种成分的含量[J]. 中国中药杂志, 2018, 43(9): 361. TIAN G, YANG XF, LI C, et al. Simultaneous determination of 9 components in Xiao'er Chiqiao Qingre granules by UPLC[J]. China J Chin Mater Med, 2018, 43(9): 361. |
| [6] |
王智民, 钱忠直, 张启伟, 等. 一测多评法建立的技术指南[J]. 中国中药杂志, 2011, 36(6): 657. WANG ZM, QIAN ZZ, ZHANG QW, et al. Technical manual of QAMS[J]. China J Chin Mater Med, 2011, 36(6): 657. |
| [7] |
王智民, 高慧敏, 付雪涛, 等. "一测多评"法中药质量评价模式方法学研究[J]. 中国中药杂志, 2006, 31(23): 1925. WANG ZM, GAO HM, FU XT, et al. Multi-components quantitation by one marker new method for quality evaluation of Chinese herbal medicine[J]. China J Chin Mater Med, 2006, 31(23): 1925. DOI:10.3321/j.issn:1001-5302.2006.23.001 |
| [8] |
秦昆明, 杨冰, 胡静, 等. 一测多评法在中药多组分质量控制中的应用现状与思考[J]. 中草药, 2018, 49(3): 725. QIN KM, YANG B, HU J, et al. Application status and thinking of quantitative analysis of multi-components by single marker in quality control of multi-components traditional Chinese medicine[J]. Chin Herb Med, 2018, 49(3): 725. |
| [9] |
江美芳, 胡晓茹, 林瑞超, 等. 三黄片一测多评的方法学研究[J]. 药物分析杂志, 2015, 35(12): 2148. JIANG MF, HU XR, LIN RC, et al. Methodology study of multi-component quantitative analysis of Sanhuang tablets by single marker[J]. Chin J Pharm Anal, 2015, 35(12): 2148. |
| [10] |
昝珂, 崔淦, 过立农, 等. 一测多评法同时测定冬虫夏草中5个核苷类成分的含量[J]. 药物分析杂志, 2018, 38(4): 630. ZAN K, CUI G, GUO LN., et al. Simultaneous determination of five nucleosides in Cordyceps sinensis(Ber K.) Sacc.by QAMS[J]. Chin J Pharm Anal, 2018, 38(4): 630. |
| [11] |
王晓燕, 霍甜甜, 李振国. 一测多评法同时测定杞菊地黄口服液中4种有效成分的含量[J]. 药物分析杂志, 2017, 37(2): 290. WANG XY, HUO TT, LI ZG, et al. Simultaneous determination of 4 active components in Qiju Dihuang oral liquid by QAMS method[J]. Chin J Pharm Anal, 2017, 37(2): 290. |
| [12] |
刘志辉, 顾玮, 常星洁, 等. "一测多评"法测定麦贞花颗粒中不同类型成分的含有量[J]. 中成药, 2012, 34(12): 2342. LIU ZH, GU W, CHANG XJ, et al. Quantitative analysis of polytype components in Maizhenhua granules by QAMS[J]. Chin Tradit Pat Med, 2012, 34(12): 2342. DOI:10.3969/j.issn.1001-1528.2012.12.019 |
| [13] |
倪力军, 丁璐, 张立国, 等. 一测多评法测定洋常春藤及其提取物中4个主要皂苷类成分[J]. 药物分析杂志, 2018, 38(6): 986. NI LJ, DING L, ZHANG LG, et al. Simultaneous determination of four saponins in Hedera helix and its extracts by quantitative analysis on multi-components by a single marker[J]. Chin J Pharm Anal, 2018, 38(6): 986. |
| [14] |
陆林杰, 姜洪旭, 潘科, 等. 一测多评法同时测定玉液消渴颗粒中八种成分[J]. 中成药, 2018, 40(6): 1302. LU LJ, JIANG HX, PAN K, et al. Simultaneous determination of eight constituents in Yuye Xiaoke granules by QAMS[J]. Chin Tradit Pat Med, 2018, 40(6): 1302. DOI:10.3969/j.issn.1001-1528.2018.06.015 |
| [15] |
董迎, 夏彦铭, 狄留庆, 等. 一测多评法同时测定补肾清利颗粒中8种成分[J]. 中草药, 2017, 48(24): 5158. DONG Y, XIA YM, DI LQ, et al. Simultaneous determination of eight ingredients in Bushen Qingli granules by HPLC-QAMS[J]. Chin Herb Med, 2017, 48(24): 5158. DOI:10.7501/j.issn.0253-2670.2017.24.016 |
| [16] |
何春喜, 袁丁, 何毓敏, 等. 一测多评法在五子衍宗丸质量控制中应用[J]. 中草药, 2017, 48(18): 3754. HE CX, YUAN D, HE YM, et al. Application of QAMS in quality control of Wuzi Yanzong pills[J]. Chin Herb Med, 2017, 48(18): 3754. DOI:10.7501/j.issn.0253-2670.2017.18.014 |
| [17] |
翟宏宇, 单柏宇, 王海洋, 等. 一测多评法测定保心宁片中6个丹参类指标性成分的含量[J]. 药物分析杂志, 2018, 38(6): 973. ZHAI HY, SHAN BY, WANG HY, et al. Simultaneous determination of six index components in Baoxinning tablets by a single marker[J]. Chin J Pharm Anal, 2018, 38(6): 973. |
| [18] |
丁琳, 戴涌, 刘雪峰. 一测多评法同时测定莨菪浸膏片中3个生物碱的含量[J]. 药物分析杂志, 2018, 38(4): 696. DING L, DAI Y, LIU XF, et al. Simultaneous determination of 3 alkaloids in Hyoscyamus extract tablets by QAMS method[J]. Chin J Pharm Anal, 2018, 38(4): 696. |
| [19] |
吴嫣艳. HPLC法测定小儿豉翘清热颗粒中连翘苷的含量[J]. 海峡药学, 2014, 26(3): 49. WU YY. The content determination of phillyrin in Xiaoer Chiqiao Qingre granules by HPLC[J]. Strait Pharma J, 2014, 26(3): 49. |
| [20] |
许文清, 魏学涛, 马青青, 等. 小儿豉翘清热颗粒HPLC-PAD指纹图谱的建立及有效成分含量测定[J]. 河南师范大学学报(自然科学版), 2018, 46(4): 60. XU WQ, WEI XT, MA QQ, et al. The fingerprints and determination of effective components were established in Xiaoer Chiqiao Qingre granules by HPLC-PAD[J]. J Henan Nor Univ(Nat Sci), 2018, 46(4): 60. |
| [21] |
李伟, 钟世华, 张卡. 高效液相色谱法测定小儿豉翘清热颗粒中黄芩苷含量[J]. 中国药师, 2009, 12(2): 216. LI W, ZHONG SH, ZHANG K. Determination of the content of baicalin in Xiaoer Chiqiao Qingre granules by HPLC[J]. China Pharm, 2009, 12(2): 216. DOI:10.3969/j.issn.1008-049X.2009.02.032 |
 2018, Vol. 38
2018, Vol. 38 
