C1酯酶抑制剂(C1 esterase inhibitor,C1INH)于1957年由Ratnoff等发现并首次报道[1]。C1INH是serpin超家族中的1种丝氨酸蛋白酶抑制剂,是1种血浆单链糖蛋白,包含478个氨基酸[2]。人的C1INH相对分子质量约为104 k,重组人C1INH(rhC1INH)糖基化程度较低,相对分子质量约为98 k[3]。C1INH有2个结构域:1个是由366个氨基酸组成的C-端丝氨酸蛋白酶抑制剂结构域,含有1个由20个氨基酸组成的外露的活性中心环(RCL);另1个是由112个氨基酸组成的N-端非蛋白酶抑制剂结构域[4-5]。C1INH是四大血浆级联系统的中心调节物质,在补体系统、缓激肽释放系统、凝血系统和纤溶系统中,均发挥重要的功能[4, 6-7]。在缓激肽释放系统中,C1INH可抑制激肽释放酶与活化的凝血因子Ⅻ(FⅫa)的活性,进而抑制缓激肽的形成[5],而缓激肽可通过引起毛细血管扩张和渗透压提高,导致血管内容物渗出,形成局部水肿,诱发遗传性血管水肿(hereditary angioedema,HAE)[8],严重的可导致窒息死亡。
在该系统中,C1INH与靶蛋白酶结合后,RCL插入靶蛋白的b折叠区域中心,然后水解抑制剂与靶蛋白结合形成的乙酰键。在这一相互作用中,靶蛋白的丝氨酸活性中心和C1INH的RCL的P1残基(决定蛋白酶特异性的主要残基)间形成1个共价键,导致P1和P1’残基间的肽键被切断,形成了C1INH与靶蛋白的1:1复合物,并伴随靶蛋白活性的丧失,由此发挥C1INH的抑制活性。C1INH在发挥蛋白酶抑制剂的作用后,RCL裂解,丧失蛋白酶抑制剂功能,成为失活的C1INH(inactivated C1INH,iC1INH),也称为反应中心断裂的C1INH(reactive center cleaved C1INH,rcc-C1INH)。
而rhC1INH在生产及储存过程中,某些特定氨基酸(如甲硫氨酸等)可能会被氧化,形成氧化rhC1INH(oxidized C1INH,ox-rhC1INH),虽然氧化不能导致蛋白完全失活,但可显著降低蛋白的生物学活性。rcc-rhC1INH和ox-rhC1INH的形成与rhC1INH制品的有效性和稳定性密切相关,因此需要对rcc-rhC1INH和ox-rhC1INH进行质量控制。
本研究采用反相高效液相色谱(RP-HPLC)技术,建立了针对rhC1INH制品中rcc-rhC1INH和ox-rhC1INH质量控制的方法,并用该方法对4批rhC1INH制品中的rcc-rhC1INH和ox-rhC1INH进行了检测。
1 仪器与试药HPLC色谱仪(Waters 2659分离器,2487/2489紫外检测器,Empower工作站);RP-C4蛋白保护柱(Grace Vydac,2.1 mm×7.5 mm,5 μm);RP-C4蛋白分析柱(Grace Vydac,3.0 mm×250 mm,5 μm)。
三氟乙酸(TFA)(分析纯,Aladdin);乙腈(色谱纯,Merk);核糖核酸酶A、溶菌酶均为分析纯。
rhC1INH(S1,S2,S3和S4共计4批供试品,科室留存);rhC1INH对照品(40 mg·mL-1)、rcc-rhC1INH对照品(40 mg·mL-1)和ox-rhC1INH对照品(40 mg·mL-1)(科室留存)。
2 方法与结果 2.1 溶液的配制 2.1.1 空白对照溶液采用PBS溶液(pH 7.0)作为空白对照溶液。
2.1.2 对照品混合溶液取rhC1INH、rcc-rhC1INH及ox-rhC1INH对照品,分别用PBS溶液溶解并稀释成2.0 mg·mL-1;将500 μL rhC1INH对照品溶液和500 μL rcc-rhC1INH对照品溶液涡旋混合均匀。
2.1.3 系统适用性溶液用PBS配制质量浓度分别为0.03 mg·mL-1的核糖核酸酶A和溶菌酶的混合溶液。
2.1.4 供试品溶液的预处理用PBS溶液将供试品稀释至2.0 mg·mL-1。
2.2 色谱条件采用带Grace Vydac RP-C4蛋白保护柱的Grace Vydac RP-C4蛋白分析柱;柱温40 ℃;检测波长214 nm;进样量15 μL;流速0.29 mL·min-1;用流动相A(0.1%TFA水溶液)和B(0.1%TFA乙腈溶液)进行梯度洗脱,具体洗脱过程按表 1所示进行。
|
|
表 1 梯度洗脱条件 Table 1 Gradient elution conditions |
取系统适用性溶液和空白溶液,按“2.2”项色谱条件,分别检测核糖核酸酶A和溶菌酶含量。如图 1所示,核糖核酸酶A的保留时间为10.07 min,峰面积为3.21×105 μV×s,塔板数为1.72×104;溶菌酶的保留时间为12.36 min,峰面积为1.46×106 μV×s,塔板数为4.61×104。各项数据表明,适合用于该试验中相关物质的分离。
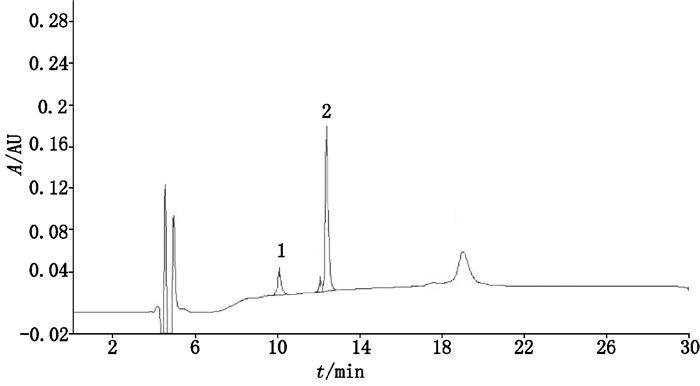
|
图 1 核糖核酸酶A(1)和溶菌酶(2)的色谱图 Figure 1 Chromatograms of ribonuclease A(1) and lysozyme(2) |
取rhC1INH对照品溶液、rcc-rhC1INH对照品溶液、ox-rhC1INH对照品溶液和对照品混合溶液,按“2.2”项色谱条件,分别检测rhC1INH、rcc-rhC1INH、ox-rhC1INH含量以及rhC1INH与rcc-rhC1INH的分离度。结果显示(见图 2),三者单独色谱的峰面积分别为6.45×107、8.79×106和9.05×106,塔板数分别为5.85×103、2.78×104、1.34× 104。在对照品混合溶液的色谱图中,rhC1INH与rcc-rhC1INH 2个主峰之间的分离度为3.19(图 2-D)。在rhC1INH与rcc-rhC1INH浓度较低时(图 2-A、B),ox-rhC1INH均能与较低浓度的rhC1INH或rcc-rhC1INH较好分离;而rhC1INH或rcc-rhC1INH浓度较高时,ox-rhC1INH对照品峰形有稍许拖尾或前伸。
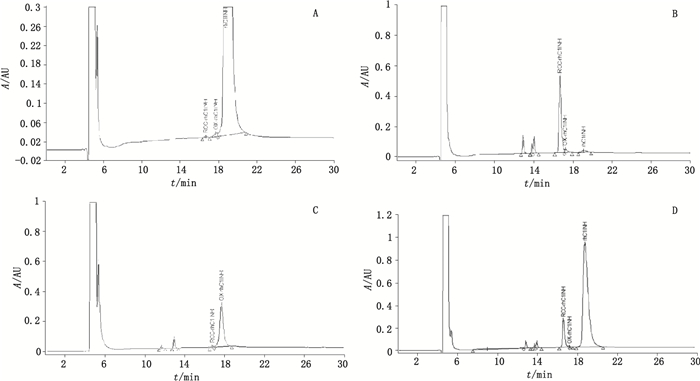
|
图 2 rhC1INH对照品(A)、rcc-rhC1INH对照品(B)、ox-rhC1INH对照品(C)及rhC1INH对照品和rcc-rhC1INH对照品混合溶液(D)色谱图 Figure 2 The chromatograms of rhC1INH reference substance(A), rcc-rhC1INH reference substance(B), ox-rhC1INH reference substance(C) and the mixture of rhC1INH reference substance and rcc-rhC1INH reference substance(D) |
取1批供试品(供试品S1),按“2.2”项色谱条件测定6次,对试验的精密度进行验证,结果如表 2所示。该批供试品中,rcc-rhC1INH含量占总量的比例为(0.082±0.010)%,RSD为12.2%;ox-rhC1INH含量占总量的比例为(0.35±0.05)%,RSD为14.3%。
|
|
表 2 精密度试验结果 Table 2 The result of precision |
将1批供试品(供试品S1)分为高、中、低剂量(900、500、300 μL)组,再分别加入rcc-rhC1INH对照品100、500、700 μL,得到rcc-rhC1INH对照品浓度分别为0.2、1和1.4 mg·mL-1的高、中、低3种浓度的加标供试溶液,按“2.2”项色谱条件进行检测,每组重复测定3次,计算最终rcc-rhC1INH含量,均值减去各剂量组初始所含rcc-rhC1INH(0.001 66 mg·mL-1)后,除以所加rcc-rhC1INH对照品的含量,计算rcc-rhC1INH回收率。
2.6.2 ox-rhC1INH回收率同时,在该批供试品高、中、低剂量组中分别加入ox-rhC1INH对照品100、500、700 μL,得到ox-rhC1INH对照品浓度分别为0.2、1和1.4 mg·mL-1的高、中、低3种浓度的加标供试溶液,按“2.2”项色谱条件进行检测,每组重复测定3次,计算最终ox-rhC1INH含量,均值减去各剂量组初始所含ox-rhC1INH(0.006 8 mg·mL-1)后,除以所加ox-rhC1INH对照品的含量,计算ox-rhC1INH回收率。
结果(表 3)显示,rcc-rhC1INH和ox-rhC1INH 3种浓度下的回收率均在85%~115%之间,表明试验体系无干扰,试验结果有较高的准确性。
|
|
表 3 1批供试品不同加标浓度的回收率结果 Table 3 Recovery rates of one batch of test samples at three added standard concentrations |
取rhC1INH对照品溶液、rcc-rhC1INH对照品溶液、ox-rhC1INH对照品溶液和4批供试品,分别按“2.2”项色谱条件进行检测,供试品重复测定2次,计算4批供试品中rcc-rhC1INH和ox-rhC1INH的百分含量。结果见表 4。
|
|
表 4 3批供试品中rcc-rhC1INH和ox-rhC1INH的含量测定 Table 4 Content determination for rcc-rhC1INH and ox-rhC1INH of 3 batches of test samples |
rhC1INH的反应中心断裂后,丧失了蛋白酶抑制活性[9],导致无法用于HAE的治疗。此外,蛋白质中许多氨基酸残基侧链可被包括氧自由基的氧化剂氧化,即使在温和的条件下,半胱氨酸和蛋氨酸也有可能被氧化,是影响蛋白制品稳定的主要因素之一[10]。因此,出于稳定性和有效性的考虑,在rhC1INH制品中,rcc-rhC1INH和ox-rhC1INH的定量分析是必不可少的指标。
生物制品的杂质主要分为产品相关杂质和工艺相关杂质[11]。产品相关杂质(蛋白)主要源于生物技术产品异质性和降解产物,会严重影响产品的有效性、稳定性以及安全性,因此要加以检测控制。末端氨基酸异质性、电荷异质性、分子大小变异体以及各类翻译后修饰等异质性可能导致产品中存在几种分子或变异体,如变异体的活性与目标产品不一致时,可用多种方法对其进行检测控制[12-15];而来自于生产和储存过程的降解产物,一般采用高效液相色谱等方法进行检测[16]。本实验建立了检测rhC1INH制品中相关蛋白rcc-rhC1INH和ox-rhC1INH的RP-HPLC方法,该方法重复性好,精密度较高,符合对rhC1INH产品中rcc-rhC1INH和ox-rhC1INH的质量控制要求。实验过程中,rcc-rhC1INH和ox-rhC1INH在样品S1中的含量均高于其在样品S2、S3和S4中的含量,可能与后3批样品和S1的储存时间不同有关。供试品S1生产后的储存时间比后3批供试品多出近1年时间,而后3批供试品的储存时间大体相同,因此,rcc-rhC1INH和ox-rhC1INH的形成速度也影响了供试品有效期的长短。
| [1] |
RATNOFF OD, LEPOW IH. Some properties of an esterase derived from preparations of the first component of complement[J]. J Exp Med, 1957, 106(2): 327. DOI:10.1084/jem.106.2.327 |
| [2] |
ZEERLEDER S. C1-inhibitor:more than a serine protease inhibitor[J]. Semin Thromb Hemost, 2011, 37(4): 362. DOI:10.1055/s-0031-1276585 |
| [3] |
CRUZ MP. Conestat alfa(ruconest):first recombinant Cl esterase inhibitor for the treatment of acute attacks in patients with hereditary angioedema[J]. P&T, 2015, 40(2): 109. |
| [4] |
BEINROHR L, HARMAT V, DOBO J, et al. C1 inhibitor serpin domain structure reveals the likely mechanism of heparin potentiation and eonformational disease[J]. J Biol Chem, 2007, 282(29): 21100. DOI:10.1074/jbc.M700841200 |
| [5] |
WAGENAAR-BOS IG, HACK CE. Structure and function of C1-inhibitor[J]. Immunol Allergy Clin North Am, 2006, 26(4): 615. DOI:10.1016/j.iac.2006.08.004 |
| [6] |
JOSEPH K, THOLANIKUNNEL BG, KAPLAN AP, et al. Factor Ⅻ-independent cleavage of high-molecular-weight kininogen by prekallikrein and inhibition by C1 inhibitor[J]. J Allergy Clin Immunol, 2009, 124(1): 143. DOI:10.1016/j.jaci.2009.02.006 |
| [7] |
CALIEZI C, WUILLEMIN WA, ZEERLEDER S, et al. C1-esterase inhibitor:an anti-inflammatory agent and its potential use in the treatment of diseases other than hereditary angioedema[J]. Pharmacol Rev, 2000, 52(1): 91. |
| [8] |
BORK K, STEFFENSEN I, MACHNIG T. Treatment with C1-esterase inhibitor concentrate in type Ⅰ or Ⅱ hereditary angioedema:a systematic literature review[J]. Allergy Asthma Proc, 2013, 34(4): 312. DOI:10.2500/aap.2013.34.3677 |
| [9] |
汪菲菲, 李策生. 人C1酯酶抑制剂的研究进展[J]. 中国生物制品学杂志, 2017, 30(11): 1227. WANG FF, LI CS. Progress in research on C1 esterase inhibitor[J]. Chin J Biologicals, 2017, 30(11): 1227. |
| [10] |
陶蔚孙, 李惟, 姜涌明. 蛋白质的分子基础[M]. 北京: 高等教育出版社, 2002: 276. TAO YS, LI W, JIANG YM. The Molecular Basis of Protein[M]. Beijing: Higher Education Press, 2002: 276. |
| [11] |
中华人民共和国药典2015年版.三部[S].2015: 37, 41 ChP 2015.Vol Ⅲ[S].2015: 37, 41 |
| [12] |
史新昌, 杨靖清, 韩春梅, 等. N-末端氨基酸测序数据估计N-末端不均一的单链重组蛋白制品主肽链比例方法的建立[J]. 中国生物制品学杂志, 2016, 29(10): 1073. SHI XC, YANG JQ, HAN CM, et al. Estimation of most-peptide-chain-component-ratio of heterogeneous N-terminal single chain recombinant protein by N-terminal sequencer data[J]. Chin J Biol, 2016, 29(10): 1073. |
| [13] |
陶磊, 李响, 周勇, 等. 我国已上市重组人促红细胞生成素的一级结构比较[J]. 中国药学杂志, 2016, 51(13): 1071. TAO L, LI X, ZHOU Y, et al. Comparison of primary structure of recombinant human erythropoietin marketed in China[J]. Chin Pharm J, 2016, 51(13): 1071. |
| [14] |
陶磊, 丁有学, 刘兰, 等. 应用串联质谱技术分析几种重组蛋白药物的翻译后修饰[J]. 中国药学杂志, 2015, 50(19): 1726. TAO L, DING YX, LIU L, et al. Indentification of several kinds of post-translational modifications in recombinant protein pharmaceuticals using MS/MS[J]. Chin Pharm J, 2015, 50(19): 1726. |
| [15] |
丁有学, 韩春梅, 毕华, 等. SEC-HPLC法测定rhTNK-tPA单链含量[J]. 药物分析杂志, 2014, 34(7): 1208. DING YX, HAN CM, BI H, et al. SEC-HPLC chromatography method for determination of rhTNK-tPA's single-chain content[J]. Chin J Pharm Anal, 2014, 34(7): 1208. |
| [16] |
毕华, 韩春梅, 丁有学, 等. 重组人血管内皮生长因子抑制剂中异天门冬氨酸含量检测[J]. 药物分析杂志, 2015, 35(5): 879. BI H, HAN CM, DING YX, et al. Determination of isoaspartic acid in the recombinant human vascular endothelial growth factor inhibitor[J]. Chin J Pharm Anal, 2015, 35(5): 879. |
 2018, Vol. 38
2018, Vol. 38 
