2. 沃特世科技有限公司, 上海 201206
2. Waters Technology Co., Ltd., Shanghai 201206, China
近年来,利用重组技术,将内源性多肽、受体或配体片段与长效载体蛋白融合表达的融合蛋白药物开发技术发展迅猛,10余种融合蛋白药物已在国内外批准上市。重组胰高血糖素样肽-1-Fc融合蛋白(rGLP-1-Fc)是胰高血糖素样肽-1(GLP-1)肽段基因与抗体Fc段基因通过linker连接后,在CHO细胞融合表达的蛋白药物,作为体内GLP-1受体激动剂,刺激胰岛素分泌,用于糖尿病治疗。GLP-1是人体内源性多肽,具有降糖作用,但其体内半衰期仅有几分钟,与抗体Fc段融合表达后,体内半衰期显著延长,成为长效药物[1-2]。礼来公司的杜拉鲁肽(dulaglutide)最早于2014年9月被美国FDA批准上市,这种长效GLP-1融合蛋白药物已经成为该类药物的主流研究方向[3]。国内多家企业开发的此类长效融合蛋白药物处于申报临床或临床试验阶段,因此,对此类蛋白药物的质量控制也迫在眉睫。
由于生产工艺复杂,步骤繁多,重组融合蛋白药物的异质性普遍存在,虽经多步纯化工艺,但在终产品中仍有多种经不同翻译后修饰或共价、非共价结合形式的变异体与主成分共存,如氧化型、脱酰胺型、二硫键错配异构体、赖氨酸残基糖化异构体等等,统称为制品相关蛋白。研究发现,制品相关蛋白对产品的稳定性、生物活性、药物的免疫原性等均有不同程度的影响[4-5]。在药物的质量研究中,应采用不同的分析方法,对制品相关蛋白进行定量或定性分析,评价其对药品质量的影响。质谱分析是目前进行蛋白质结构研究的强有力技术,在相关蛋白的鉴别研究中发挥着重要作用[6-7]。
本研究中rGLP-1-Fc的单链N-末端为肽段GLP-1,由16个氨基酸组成的linker与人IgG4的Fc相连,而终产品是由2条相同的单链通过链间二硫键形成的二聚体,Fc段有2个N-糖基化位点,含2条链间二硫键和4条链内二硫键,理论相对分子质量62 561。本文采用液质联用技术,对rGLP-1-Fc的制品相关蛋白进行了初步定性、定量分析。
1 材料超纯水为密理博超纯水机制备;乙腈为色谱纯;三氟乙酸、甲酸、碳酸氢铵、二硫苏糖醇(DTT)、碘乙酰胺(IAM)均为分析纯;胰蛋白酶购自Promega公司;变性剂RapiGest SF购自Waters公司;rGLP-1-Fc原液为本室留样。
Acquity UPLC Ⅰ class色谱仪、PDA紫外检测器、Xevo G2-XS质谱仪均为Waters公司产品。
2 方法 2.1 反相超高效液相色谱(RP-UPLC)分析未处理样品:将rGLP-1-Fc原液用水稀释到1 mg·mL-1,进样50 μL。
还原样品处理:将rGLP-1-Fc原液用50 mmol·L-1的碳酸氢铵溶液稀释至1 mg·mL-1,加DTT至终浓度为20 mmol·L-1,37 ℃水浴10 min,10 000 r·min-1离心5 min后取上清,进样50 μL。
色谱条件:色谱柱为ACQUITY UPLC BEH300 C4(2.1 mm×100 mm,1.7 μm);柱温60 ℃,样品室温度10 ℃,检测波长280 nm,流速0.2 mL·min-1。流动相A为0.2%的三氟乙酸水溶液,流动相B为0.2%的三氟乙酸乙腈溶液,B相在25 min内由35%到39%。
2.2 液质联用分析液相色谱条件同“2.1”。质谱仪离子化模式:正离子、灵敏度模式;毛细管电压:3 000 V;锥孔电压:100 V;源温度:120 ℃,去溶剂气体温度:450 ℃,锥孔气体流速:50 L·h-1,去溶剂气体流速:600 L·h-1。
2.3 液质肽图分析蛋白酶解:向rGLP-1-Fc原液中加入RapiGest SF至终质量浓度为0.05%,加入DTT至终浓度为10 mmol·L-1,60 ℃加热30 min;加入IAM至终浓度为13 mmol·L-1,室温放置45min,按酶与样品质量比为1:50加入胰蛋白酶,37 ℃水浴16 h;加甲酸至终体积百分比为0.5%,12 000 r·min-1离心10 min,取上清进样。
色谱条件:色谱柱为ACQUITY UPLC BEH300 C18(2.1 mm×100 mm,1.7 μm);柱温40 ℃,样品室温度10 ℃,流速0.2 mL·min-1。流动相A为0.1%甲酸的水溶液,流动相B为0.1%甲酸的乙腈溶液,B相在40 min内由2%到50%。
质谱仪采用正离子、灵敏度、MSE模式采集;锥孔电压:40 V;扫描范围(m/z):50~2 000;二级质谱碰撞能量:20~45 eV;其余同“2.1”项。
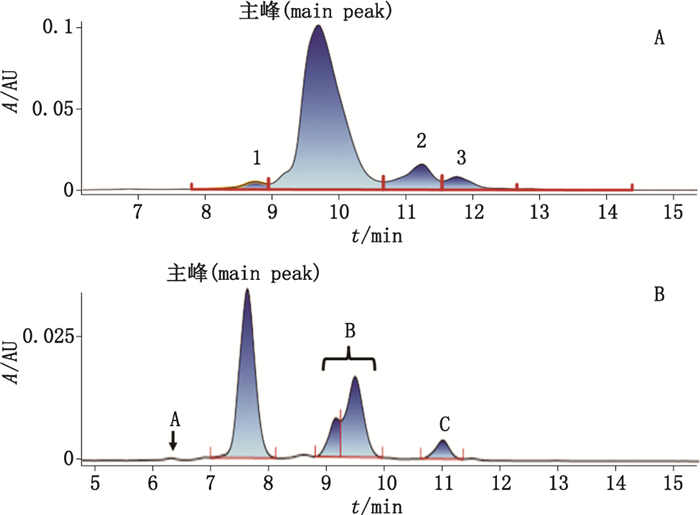
3 结果 3.1 RP-UPLC纯度分析结果本研究首先用RP-UPLC对rGLP-1-Fc样品进行了纯度分析,发现除主峰外,还有其他3个色谱峰,分别定义为峰1、峰2和峰3。由于该蛋白是由2个相同的亚基组成的二聚体,亚基之间通过链间二硫键连接,所以推测其他色谱峰的出现可能是由于二硫键错配导致;随即将样品还原后再进行RP-UPLC分析,结果除主峰外,仍有其他色谱峰出现,分别定义为峰A、峰B和峰C,其中峰B由2个色谱峰组成,两者不能充分分离,共称为峰B。样品还原前后的色谱图见图 1。通过还原后分析,不能对其他色谱峰的性质进行判断,所以对其作进一步的质谱鉴定。
|
图 1 未处理(A)及还原(B)后rGLP-1-Fc的色谱图 Figure 1 Chromatography of untreated(A) and reduced(B) rGLP-1-Fc |
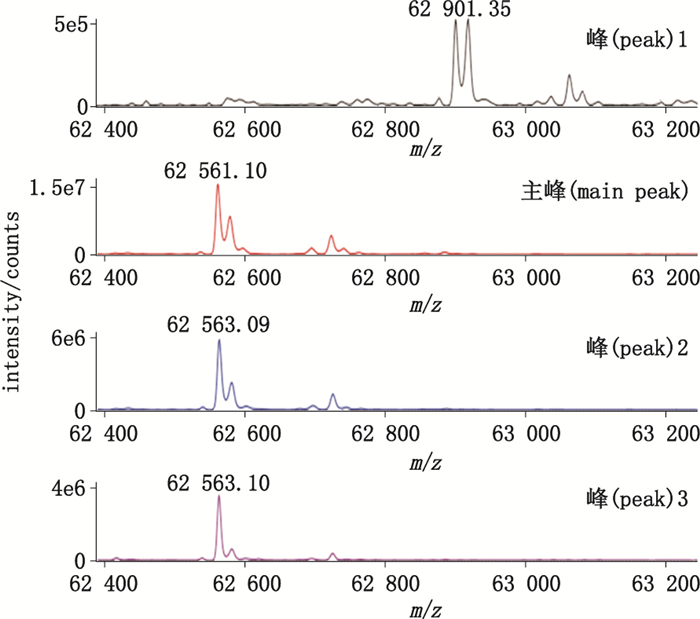
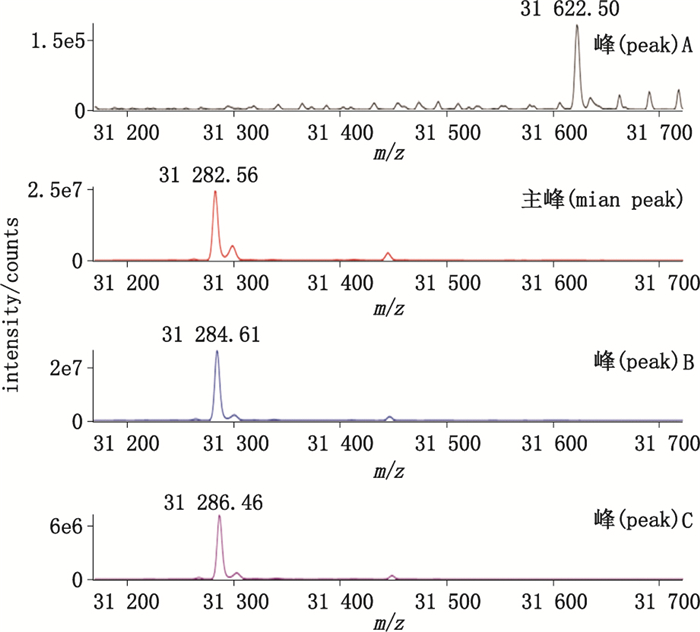
采用液质联用法对样品还原前后的相对分子质量进行测定,结果见图 2、图 3。将实测值与该蛋白的理论相对分子质量进行比较发现,主峰的实测值与理论值一致,其他色谱峰的实测值与理论值存在一定差异。根据相对分子质量的差异并结合该蛋白的结构特点,对各色谱峰可能发生的修饰进行了鉴定,结果见表 1。其中峰1与峰A存在氧化(+O)和2个己糖的糖化(+2Hex),其他色谱峰存在1或2条二硫键的还原(+2H或+4H)。考虑到各色谱峰存在的修饰后,其实测相对分子质量与调整后的理论值均相匹配,误差均在0.5以内。
|
图 2 质谱测定未处理rGLP-1-Fc各色谱峰的相对分子质量 Figure 2 Relative molecular mass of peaks in chromatography for untreated rGLP-1-Fc measured by mass spectrometry |
|
图 3 质谱测定rGLP-1-Fc还原后各色谱峰的相对分子质量 Figure 3 Relative molecular mass of peaks in chromatography for reduced rGLP-1-Fc measured by mass spectrometry |
|
|
表 1 rGLP-1-Fc还原前后所得各色谱峰的修饰类型鉴定结果 Table 1 The identified modifications of peaks in chromatography for untreated and reduced rGLP-1-Fc |
为确定氧化及糖化修饰位点,将该蛋白用胰蛋白酶酶切,随后进行液质肽图分析。结果未检测到比理论酶切肽段的相对分子质量多16(+O)或324(+2Hex)的质谱信号,却检测到比肽段“E21FIAWLVKGGGGGGGSGG GGSGGGGSAESK50”的理论相对分子质量多340的质谱信号,而“+O”与“+2Hex”可共同造成肽段相对分子质量增加340,据此推测该肽段同时发生了以上2种修饰。为进一步确定修饰位点,对该肽段进行了串联质谱分析,结果2种修饰均发生在第28位赖氨酸残基(K28),该肽段的串联质谱图见图 4。

|
图 4 氧化及糖化修饰肽段的串联质谱图 Figure 4 MS/MS spectrum of the oxidized and glycated peptide |
采用液质联用的方法对该样品中的制品相关蛋白进行了鉴定,随后采用RP-UPLC法对3批样品中各相关蛋白的含量进行了测定,结果见表 2。
|
|
表 2 3批原液中制品相关蛋白的含量测定结果 Table 2 Percentage contents of product-related proteins in 3 lots of bulk |
蛋白质的糖化为非酶促的化学修饰,主要发生在赖氨酸等残基上,与糖基化、氧化、脱酰胺、异构化等翻译后修饰共同导致了重组蛋白药物的高度异质性[8-9]。近年来,不仅在体内抗体发现有糖化修饰,在重组表达抗体药物的发酵培养、制剂配制及储存使用等过程中,均检测到糖化修饰,糖化修饰能改变蛋白药物的电荷特性,同时有可能影响蛋白药物的安全性和有效性[10-12]。本研究中的rGLP-1-Fc属于Fc融合蛋白,发酵工艺与抗体药物类似。本文利用液质联用技术,对该蛋白的异质性进行了分析,检测到3种变异体,1种是K28的氧化及糖化修饰,另2种是二硫键解链导致的异构体。
还原前后蛋白的质谱实测相对分子质量结果显示,氧化及糖化修饰发生在融合蛋白的一条单链中。由于该融合蛋白药物是由2条同源单链通过链间二硫键共价连接而成,因此1条未修饰单链和1条修饰单链共价结合的可能性是存在的。文献报道中糖化修饰主要发生在赖氨酸残基侧链,有单糖糖化、双糖糖化等,本研究通过胰酶酶切液质肽图分析,发现包含K28的肽段存在酶切位点(K28羧基端)漏切的现象,提示该位点有可能存在修饰,抑制了胰酶酶切。进一步的串联质谱分析结果显示,氧化及糖化修饰位点位于K28。RP-UPLC分析结果显示:该蛋白药物中有超过2%的氧化及糖化修饰变异体存在。由于该修饰位点位于融合蛋白的GLP-1功能性肽段中,该修饰对药物与体内受体结合及其对生物学功能的影响尚待进一步研究。
本研究还发现该药物中有高达13%的由二硫键的解链所导致的变异体(峰2+峰3)。由于该药物N-末端的功能肽段不存在二硫键,全部6条二硫键均存在于Fc段中,具体哪条二硫键发生解链有待进一步研究。另外,由于抗体Fc融合蛋白的Fc段负责与新生受体FcRn结合,从而起到延长半衰期的作用。至于该段二硫键解链导致的结构变异体是否会影响药物在体内的半衰期,进而影响药物的药效,也有待进一步的研究。
综上所述,本文对rGLP-1-Fc中的制品相关蛋白进行了初步的定性、定量研究。现行WHO的“重组DNA技术制备的生物治疗性蛋白的质量、安全性和有效性指南”和《中华人民共和国药典》2015年版三部的“人用重组蛋白制品总论”已对蛋白的异质性研究作了明确的细化要求,本研究结果将为治疗性蛋白药物的相关蛋白质量控制研究提供技术参考[13-14]。
| [1] |
Strohl WR. Fusion proteins for half-life extension of biologics as a strategy to make biobetters[J]. BioDrugs, 2015, 29(4): 215. DOI:10.1007/s40259-015-0133-6 |
| [2] |
Kontermann RE. Half-life extended biotherapeutics[J]. Expert Opin Biol Ther, 2016, 16(7): 903. DOI:10.1517/14712598.2016.1165661 |
| [3] |
Sanford M. Dulaglutide:first global approval[J]. Drugs, 2014, 74(17): 2097. DOI:10.1007/s40265-014-0320-7 |
| [4] |
BeATE B, MANFRED S, ALOIS J, et al. Microheterogeneity of recombinant antibodies:analytics and functional impact[J]. Biotechnol J, 2017, 13(1): 1700268. |
| [5] |
Hmiel LK, Brorson KA, Boyne Ⅱ MT. Post-translational structural modifications of immunoglobulin G and their effect on biological activity[J]. Anal Bioanal Chem, 2015, 407: 79. DOI:10.1007/s00216-014-8108-x |
| [6] |
Ren D, Ratnaswamy G, Beierle J, et al. Degradation products analysis of an Fc fusion protein using LC/MS methods[J]. Int J Biol Macromol, 2009, 44(1): 81. DOI:10.1016/j.ijbiomac.2008.10.006 |
| [7] |
Rathore D, Faustino A, Schiel J, et al. The role of mass spectrometry in the characterization of biologic protein products[J]. Expert Rev Prot, 2018, 15(5): 431. DOI:10.1080/14789450.2018.1469982 |
| [8] |
Dorai H, Ganguly S. Mammalian cell-produced therapeutic proteins:heterogeneity derived from protein degradation[J]. Curr Opin Biotechnol, 2014, 30: 198. DOI:10.1016/j.copbio.2014.07.007 |
| [9] |
Gramer MJ. Product quality considerations for mammalian cell culture process development and manufacturing[J]. Adv Biochem Eng Biotechnol, 2014, 139: 123. |
| [10] |
Lapolla A, Tonani R, Fedele D, et al. Non-enzymatic glycation of IgG:an in vivo study[J]. Horm Metab Res, 2002, 34(5): 260. DOI:10.1055/s-2002-32140 |
| [11] |
Mo J, Jin RZ, Yan QR, et al. Quantitative analysis of glycation and its impact on antigen binding[J]. Mabs, 2018, 10(3): 406. DOI:10.1080/19420862.2018.1438796 |
| [12] |
Miller AK, Hambly DM, Kerwin BA, et al. Characterization of site-specific glycation during process development of a human therapeutic monoclonal antibody[J]. J Pharm Sci, 2011, 100(7): 2543. DOI:10.1002/jps.22504 |
| [13] |
World Health Organiztion. Guidelines on the quality, safety, and efficacy of biotherapeutic protein products prepared by recombinant DNA technology[EB/OL].[2016-02-26]. http://www.who.int/biologicals/biotherapeutics/rDNA_DB_final_19_Nov_2013.pdf.
|
| [14] |
中华人民共和国药典2015年版.三部[S]. 2015: 37 ChP 2015. Vol Ⅲ[S]. 2015: 37 |
 2018, Vol. 38
2018, Vol. 38 
