尿酸酶可以将尿酸氧化为水溶性更好的尿囊素,更利于排出体外。在进化过程中,人类的尿酸酶基因成为假基因,尿酸代谢缓慢甚至出现障碍[1-2],血尿酸水平比其他含有正常尿酸酶的哺乳动物高出3~10倍,因此更易罹患高尿酸血症[3]。重组尿酸酶是一种很有前景的降尿酸药物,它直接作用于尿酸本身,几乎不存在与其他药物的相互作用[4],并且可以消除关节处已经形成的尿酸结晶[5],适用于各种类型的高尿酸血症[6-9]。重组假丝酵母尿酸酶是将假丝酵母的尿酸酶基因转入大肠杆菌表达生产的,与其他物种的尿酸酶相比,假丝酵母尿酸酶具有活性高及水溶性好的特点。重组假丝酵母尿酸酶由302个氨基酸组成,相对分子质量为34064,以同源四聚体的形式发挥酶活性。
作为治疗用重组蛋白药物,制品相关蛋白是质量控制中的关键环节。制品相关蛋白是指在重组蛋白药物在生产和/或贮藏过程中形成的预期制品的变异体,如聚合物、修饰产物及降解产物等。如果这些变异体在活性、有效性和安全性方面与预期制品不同,称为制品相关杂质;如果它们具有一定活性且对制剂的安全性和有效性无有害影响,则称为制品相关物质。其中,聚合物是比较常见的一类制品相关蛋白,聚合物的形成机制非常复杂,主要涉及三方面的原因:蛋白本身的理化特性;蛋白溶液的pH、盐浓度与种类等;外部因素的刺激,如温度、光照、反复冻融、冷冻干燥、氧化环境及容器材质等。蛋白聚集可引起重组蛋白药物免疫原性的升高,在质量控制中应密切关注。前期研究结果显示,重组假丝酵母尿酸酶很容易形成聚合物,本文针对聚合物的形成机制及其对蛋白结构功能的影响展开了研究。
1 材料 1.1 仪器Waters Alliance 2695高效液相色谱仪(Waters公司);XCell SureLockTM蛋白电泳仪(Thermo公司);Acquity UPLC-Xevo G2-S液质联用仪(Waters公司);Jasco J-810圆二色谱仪(JASCO公司);Dawn Heleos多角度激光散射仪(Wyatt Technology公司);96孔石英板及SpectraMax M5酶标仪(Molecular Devices公司)。
1.2 试药超纯水由密理博超纯水机制备;乙腈为色谱纯;甲酸、盐酸、三氟乙酸、尿酸均为分析纯;三羟甲基氨基甲烷(Tris)购自Solarbio公司,分析纯;氯化钠、磷酸氢二钠、磷酸二氢钠、盐酸胍购自国药集团化学试剂有限公司,均为分析纯;二硫苏糖醇(纯度≥99%)、碘乙酰胺(纯度≥99%)、胰蛋白酶(货号T6567)均购自Sigma Aldrich公司,为蛋白质组学级;电泳胶(NuPAGE® 4%~12% Bis-Tris gel)购自Invitrogen公司;重组假丝酵母尿酸酶样品为本实验室表达和纯化。
2 方法与结果 2.1 样品前处理为保证样品的稳定,重组假丝酵母尿酸酶纯化后置-70 ℃保存,测定前将样品取出并置室温融化,即得“-70 ℃保存的样品”。为分析重组假丝酵母尿酸酶的聚集特性以及聚集对结构、功能的影响,将刚融化后的-70 ℃保存的样品置37 ℃分别孵育2、4、6、20 h,即得37 ℃孵育2、4、6、20 h的样品。
2.2 SEC-HPLC分析色谱条件:采用Yarra SEC-2000色谱柱(300 mm×7.8 mm,3 µm),以20 mmol·L-1 Tris-盐酸-0.1 mol·L-1的氯化钠缓冲液(pH 8.0)为流动相,等度洗脱,流速0.5 mL·min-1,柱温35 ℃,检测器采用紫外检测器与多角度激光散射检测器串联,紫外检测波长280 nm,采集时间30 min。
样品稀释及测定:将-70 ℃保存的样品及37 ℃孵育2、4、6、20 h的样品分别用流动相将蛋白质量浓度稀释至1 mg·mL-1,10 000 r·min-1离心5 min后取上清上样测定,进样量50 µL。
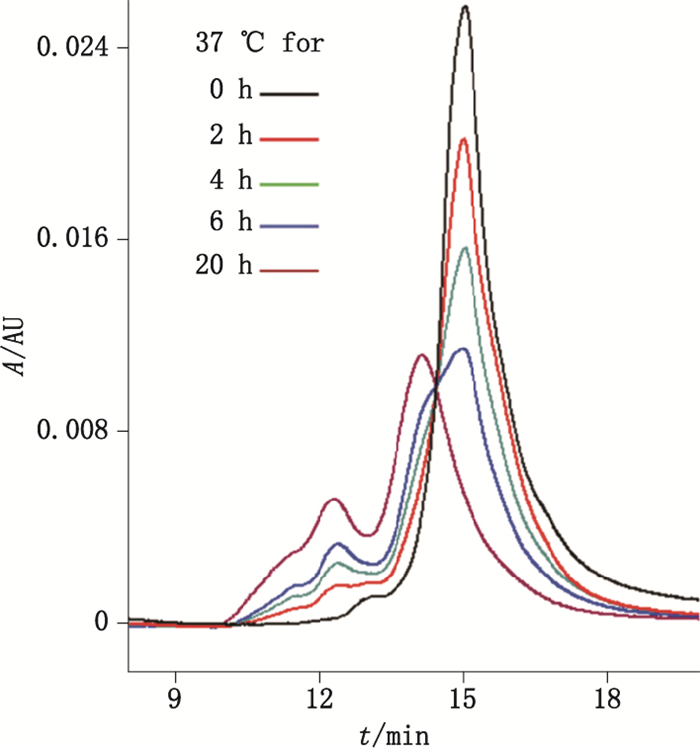
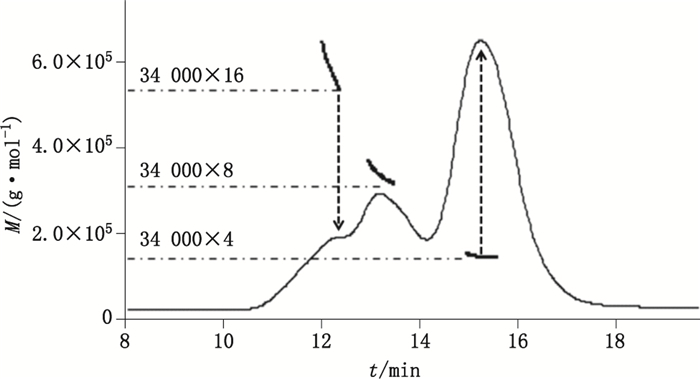
结果显示:样品在37 ℃放置的过程中,聚集产物逐渐形成,聚合物的峰面积百分比从最初的2%增加到30%(见图 1),说明重组假丝酵母尿酸酶性质不稳定,很容易形成聚合物。通过多角度激光散射仪测定相对分子质量(见图 2)发现:主峰中蛋白的相对分子质量约为1.4×105,说明主峰中的蛋白以四聚体的形式存在;另外2种高聚体的相对分子质量分别为3.0×105、5.5×105,分别对应八聚体与十六聚体,说明重组假丝酵母尿酸酶在四聚体的基础上进一步形成高级聚合物。
|
图 1 尿酸酶样品的SEC-HPLC色谱图 Figure 1 SEC-HPLC chromatograms of uricase samples |
|
图 2 多角度激光散射仪测定尿酸酶聚合物的相对分子质量 Figure 2 Relative molecular mass of uricase polymers detected by MALLS |
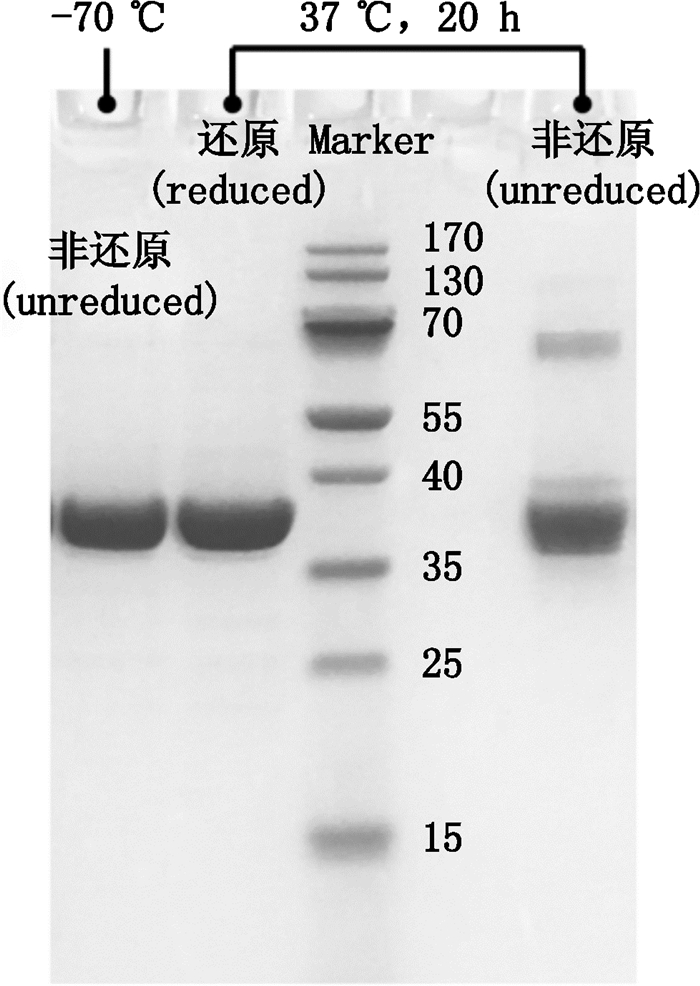
取-70 ℃保存的样品,进行非还原SDS-PAGE分析;取37 ℃孵育20 h的样品,同时进行还原及非还原SDS-PAGE分析。上样量均为10 µg,采用Invitrogen公司预制电泳胶,考马斯亮蓝染色,具体方法参见《中华人民共和国药典》三部(2015年版)通则0541电泳法第五法SDS-聚丙烯酰胺凝胶电泳法。
电泳结果见图 3,-70 ℃保存的样品非还原电泳后呈现单体条带,说明重组假丝酵母尿酸酶的四聚体形式是通过非共价键作用形成的,因为电泳试剂中的十二烷基硫酸钠将非共价键破坏,四聚体变为单体。37 ℃孵育20 h的样品在非还原电泳时存在单体条带和二聚体条带,还原电泳时二聚体条带消失,说明二聚体是通过链间二硫键形成的。以上结果说明,重组假丝酵母尿酸酶在37 ℃孵育的过程中,链间二硫键形成并导致了高级聚合物的出现。
|
图 3 尿酸酶的SDS-PAGE测定结果 Figure 3 SDS-PAGE results of uricase |
液质联用条件:采用BEH 300 C4色谱柱(2.1 mm×50 mm,3.5 µm),以0.1%的甲酸水溶液(A)-0.1%的甲酸乙腈溶液(B)为流动相,梯度洗脱(0~60 min,99%A→40%A),流速0.2 mL·min-1,柱温40 ℃;样品池温度10 ℃;质谱仪采用正离子、灵敏度、MSE模式采集数据,毛细管电压3 kV,Cone电压40 V,去溶剂气体温度350 ℃,源温120 ℃,去溶剂气体流速800 L·h-1,扫描范围m/z 50~2 000;采用UNIFI操作软件对各肽段进行分析鉴定。样品的酶解及测定:取37 ℃孵育20 h的样品200 µL,加入5 mol·L-1盐酸胍-0.1 mol·L-1 Tris-盐酸缓冲液(pH 8.3)800 µL,混匀后加入孔径为10 000的超滤管,10 000 r·min-1离心10 min,弃去下层滤过液,用5 mol·L-1盐酸胍-0.1 mol·L-1 Tris-盐酸缓冲液(pH 8.3)将上层溶液补足至约1 mL,10 000 r·min-1离心10 min,取出上层溶液,用5 mol·L-1盐酸胍-0.1 mol·L-1 Tris-盐酸缓冲液(pH 8.3)调节质量浓度至1 mg·mL-1;从中取200 µL,加入0.7 mol·L-1碘乙酰胺溶液6 µL,室温避光反应30 min;加入0.1 mol·L-1的Tris-盐酸缓冲液(pH 7.5)800 µL,混匀后加入孔径为10 000的超滤管,10 000 r·min-1离心10 min,弃去下层滤过液,用0.1 mol·L-1的Tris-盐酸缓冲液(pH 7.5)将上层溶液补足至约1 mL,10 000 r·min-1离心10 min,取出上层溶液,用0.1 mol·L-1的Tris-盐酸缓冲液(pH 7.5)调节质量浓度至0.5 mg·mL-1;从中取0.3 mL,加入胰蛋白酶10 µg,37 ℃温育7 h;完毕后加入30 µL 10%三氟乙酸溶液终止反应,10 000 r·min-1离心5 min,取上清上样测定,进样量10 µL。
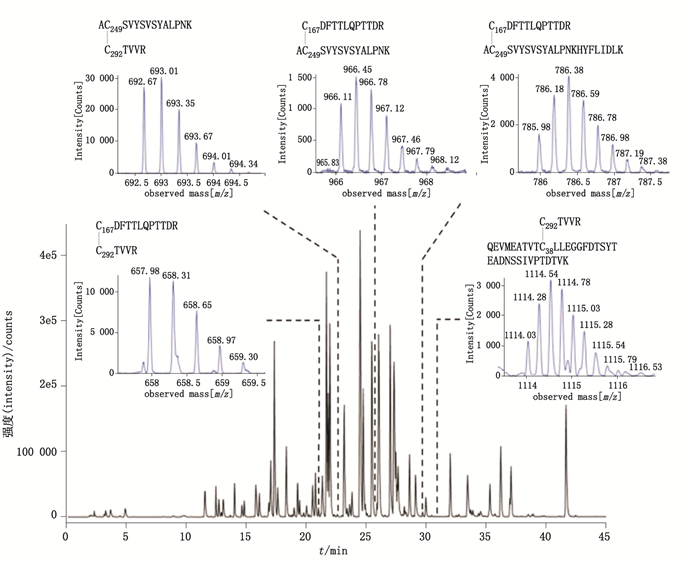
通过碘乙酰胺将样品中游离的巯基封闭,避免了在酶切过程中新的二硫键形成。酶切后进行液质联用检测,通过理论相对分子质量与实测相对分子质量的匹配鉴定二硫键连接肽段。结果发现以下二硫键配对方式:Cys249-Cys292、Cys249-Cys267、Cys292-Cys167、Cys292-Cys38(见图 4),这些二硫键的形成导致了高级聚合物的出现。
|
图 4 液质联用法鉴定二硫键配对方式 Figure 4 Identification of disulfide bonds pairing by UPLC-MS |
圆二色谱条件:带宽1 nm,响应时间1 s,灵敏度模式为standard,检测范围193~240 nm,数据间隔0.1 nm,扫描速度100 nm·min-1,数据叠加次数为4。
样品处理及测定:各取-70 ℃保存的样品及37 ℃孵育20 h的样品200 µL,分别加入0.1 mol·L-1的磷酸盐缓冲液(pH 7.0)800 µL,混匀后加入孔径为10 000的超滤管,10 000 r·min-1离心10 min,弃去下层滤过液,用0.1 mol·L-1的磷酸盐缓冲液(pH 7.0)将上层溶液补足至约1 mL,10 000 r·min-1离心10 min,取出上层溶液,用0.1 mol·L-1的磷酸盐缓冲液(pH 7.0)调节蛋白质量浓度至0.15 mg·mL-1,分别测定圆二色谱。
测定结果显示,两者的圆二色谱基本一致(见图 5),说明高级聚合物的形成对蛋白二级结构的影响不大。

|
图 5 尿酸酶的圆二色谱图 Figure 5 Circular dichroism spectra of uricase |
多角度激光散射仪条件:采集时间5 s;温度范围25~70 ℃;温度升高速度1 ℃·min-1。
样品处理及测定:取-70 ℃保存的样品,用超纯水调节蛋白质量浓度至2 mg·mL-1,平分为2份,1份加入二硫苏糖醇至终浓度为2 mmol·L-1,另1份加相同体积的超纯水,分别混匀并采用动态光散射法测定转变温度。
本实验以蛋白发生聚集时的临界温度(转变温度)作为评价热稳定性的指标。1份样品直接加热测定转变温度,另1份样品中加入二硫苏糖醇后测定转变温度,因为二硫苏糖醇形成的还原环境可避免二硫键的形成,藉此评价二硫键形成对蛋白稳定性的影响。结果显示2种条件下蛋白的转变温度仅有1.8 ℃的差异,说明二硫键的形成对蛋白的热稳定性影响不大。见图 6。

|
图 6 动态光散射测定转变温度 Figure 6 Transition temperature detected by dynamic light scattering(DLS) |
样品活性测定:用0.1 mol·L-1磷酸盐缓冲液(pH 7.0)溶解适量尿酸制备150 µmol·L-1尿酸溶液,并预热至37 ℃;将-70 ℃保存的样品及37 ℃孵育20 h的样品”用0.1 mol·L-1磷酸盐缓冲液(pH 7.0)分别稀释至10 µg·mL-1,各取30 µL分别加入96孔石英板,另取30 µL 0.1 mol·L-1磷酸盐缓冲液(pH 7.0)加入96孔石英板做阴性对照,以上各孔分别加入270 µL尿酸溶液并混匀,另取300 µL 0.1 mol·L-1的磷酸盐缓冲液(pH 7.0)加入石英板作空白对照,将石英板放入酶标仪在37 ℃进行动态检测,检测波长293 nm,每30 s检测1次,测定10 min,记录检测数据。根据单位时间尿酸的消耗量计算酶活性。
检测结果显示:-70 ℃保存的样品的酶活性为(9.2±0.1)U·mg-1(n=3),37 ℃放置20 h后酶活性降为(8.3±0.2)U·mg-1(n=3),两者经t检验显示存在显著差异(P<0.05),说明高级蛋白聚合物的形成降低了酶活性。
3 讨论本文对重组假丝酵母尿酸酶中聚合物的聚集方式及其对结构功能的影响展开研究,结果显示:重组假丝酵母尿酸酶正常以同源四聚体的形式存在,与文献报道[10-11]一致;在37 ℃放置过程中,由于链间二硫键的形成导致高级聚合物的出现,新形成的二硫键包括Cys249-Cys292、Cys249-Cys267、Cys292-Cys167、Cys292-Cys38;高级聚合物的形成对蛋白的二级结构及热稳定性影响不大,但是可以造成酶活性的降低。
蛋白是对温度变化比较敏感的一类物质,本文展示了重组假丝酵母尿酸酶在37 ℃放置时可以产生高级聚合物。除此之外,25、4、-20、-70 ℃的分析结果显示:在25 ℃与4 ℃放置时,重组假丝酵母尿酸酶同样有高级聚合物生成,只是聚集速度相对较慢,在-20 ℃与-70 ℃放置时蛋白相对比较稳定。
本实验中,蛋白聚集造成了酶活性的降低,但是蛋白的二级结构却未发生明显的改变。文献报道,重组假丝酵母尿酸酶的活性中心涉及Lys 11、Tyr 59、Phe 161、Arg 178、Gln 234、Asn 260、His 262[16],部分氨基酸残基与参与形成二硫键的半胱氨酸残基比较接近,如Cys 157、Cys 249,因此推测:由于链间二硫键的形成导致酶活性中心的氨基酸残基的相对位置发生改变,虽然对于蛋白整体结构来说变化不大,但这些关键部位的细微结构变化降低了该蛋白的酶活性。
蛋白的聚集方式有多种分类形式,包括聚集是否伴随着结构改变、聚集反应的可逆与否、共价键形成的聚集还是非共价键形成的聚集等[12]。本文的实验结果显示重组假丝酵母尿酸酶的同源四聚体是通过非共价键形成的,更高级别的聚合物则是通过共价键形成的。蛋白聚集是治疗用重组蛋白药物应重点关注的方面,因为它是引起免疫原性的重要原因[13-14],而免疫原性可导致抗药抗体的生成,并进一步造成蛋白药代动力学性质改变及疗效消失,甚至超敏反应,严重影响治疗用重组蛋白药物的安全性和有效性[15]。
综上所述,本研究对重组假丝酵母尿酸酶聚合物的形成原因及影响进行了分析,分析结果可为该制品的后续研究及质量控制提供依据。
| [1] |
Friedman TB, Polanco GE, Appold JC, et al. On the loss of uricolytic activity during primate evolution -Ⅰ.Silencing of urate oxidase in a hominoid ancestor[J]. Comp Biochem Physiol B, 1985, 81(3): 653. DOI:10.1016/0305-0491(85)90381-5 |
| [2] |
Yeldandi AV, Yeldandi V, Kumar S, et al. Molecular evolution of the urate oxidase-encoding gene in hominoid primates:nonsense mutations[J]. Gene, 1991, 109(2): 281. DOI:10.1016/0378-1119(91)90622-I |
| [3] |
Richette P, Bardin T. Gout[J]. Lancet, 2010, 375(9711): 318. DOI:10.1016/S0140-6736(09)60883-7 |
| [4] |
Malaguarnera M, Vacante M, Russo C, et al. A single dose of rasburicase in elderly patients with hyperuricaemia reduces serum uric acid levels and improves renal function[J]. Expert Opin Pharmacother, 2009, 10(5): 737. DOI:10.1517/14656560902781972 |
| [5] |
Schlesinger N, Yasothan U, Kirkpatrick P. Pegloticase[J]. Nat Rev Drug Discov, 2011, 10(1): 17. DOI:10.1038/nrd3349 |
| [6] |
Alakel N, Middeke JM, Schetelig J, et al. Prevention and treatment of tumor lysis syndrome, and the efficacy and role of rasburicase[J]. Onco Targets Ther, 2017, 10: 597. DOI:10.2147/OTT |
| [7] |
Dave AJ, Kelly VM, Krishnan E. Pegloticase and the patient with treatment-failure gout[J]. Expert Rev Clin Pharmacol, 2012, 5(5): 501. DOI:10.1586/ecp.12.48 |
| [8] |
George RJ, Sundy JS. Pegloticase for treating refractory chronic gout[J]. Drugs Today (Barc), 2012, 48(7): 441. |
| [9] |
Yood RA, Ottery FD, Irish W, et al. Effect of pegloticase on renal function in patients with chronic kidney disease:a post hoc subgroup analysis of 2 randomized, placebo-controlled, phase 3 clinical trials[J]. BMC Res Notes, 2014, 7: 54. DOI:10.1186/1756-0500-7-54 |
| [10] |
Colloc'H N, Girard E, Dhaussy AC, et al. High pressure macromolecular crystallography:the 140-MPa crystal structure at 2.3 A resolution of urate oxidase, a 135-kDa tetrameric assembly[J]. Biochim Biophys Acta, 2006, 1764(3): 391. DOI:10.1016/j.bbapap.2006.01.006 |
| [11] |
Kratzer JT, Lanaspa MA, Murphy MN, et al. Evolutionary history and metabolic insights of ancient mammalian uricases[J]. Proc Natl Acad Sci U S A, 2014, 111(10): 3763. DOI:10.1073/pnas.1320393111 |
| [12] |
Roberts CJ. Non-native protein aggregation kinetics[J]. Biotechnol Bioeng, 2007, 98(5): 927. DOI:10.1002/(ISSN)1097-0290 |
| [13] |
Fathallah AM, Chiang M, Mishra A, et al. The effect of small oligomeric protein aggregates on the immunogenicity of intravenous and subcutaneous administered antibodies[J]. J Pharm Sci, 2015, 104(11): 3691. DOI:10.1002/jps.24592 |
| [14] |
Ahmadi M, Bryson CJ, Cloake EA, et al. Small amounts of sub-visible aggregates enhance the immunogenic potential of monoclonal antibody therapeutics[J]. Pharm Res, 2015, 32(4): 1383. DOI:10.1007/s11095-014-1541-x |
| [15] |
Moussa EM, Panchal JP, Moorthy BS, et al. Immunogenicity of therapeutic protein aggregates[J]. J Pharm Sci, 2016, 105(2): 417. DOI:10.1016/j.xphs.2015.11.002 |
| [16] |
Liu X, Wen M, Li J, et al. High-yield expression, purification, characterization, and structure determination of tag-free Candida utilis uricase[J]. Appl Microbiol Biotechnol, 2011, 92(3): 529. DOI:10.1007/s00253-011-3244-0 |
 2018, Vol. 38
2018, Vol. 38 
