重组人粒细胞刺激因子(recombinant human granulocyte colony-stimulating factor,rhG-CSF)是人体内粒细胞刺激因子模拟分子,与天然hG-CSF结构相似,生物学效应基本一致[1-2]。
rhG-CSF在大肠杆菌中表达,由174/175个氨基酸残基组成(N末端含有蛋氨酸残基)则有175个氨基酸残基),相对分子质量为18.7 k~18.8 k,等电点5.5~6.1,虽无糖基修饰,但其生物学活性与天然hG-CSF无明显区别[3]。
rhG-CSF主要生物学功能是促进中性粒细胞系造血细胞的增殖、分化和活化,临床上用于治疗放疗、化疗以及骨髓移植后中性粒细胞减少症。rhG-CSF于1991年由美国FDA首次批准上市,我国已批准15家制药企业生产rhG-CSF。
目前,各家企业生产的rhG-CSF的N端序列并不完全一致,多数企业的rhG-CSF序列是以蛋氨酸(M)起始,N端15个氨基酸残基为MTPLGPASSLPQSFL;部分企业是以苏氨酸(T)起始,N端15个氨基酸残基为TPLGPASSLPQSFLL。hG-CSF的理论序列以T起始,M是大肠杆菌表达系统引入的,带有M的rhG-CSF实际上是hG-CSF的衍生物。这2个N端序列从2010年版《中华人民共和国药典》开始,都被确认为主药成分。为确定某一rhG-CSF制品的N端氨基酸序列的异质性,本文开展了方法学研究。
1 仪器、试剂及样品N末端序列分析仪(PROTEIN SEQUENER PPSQ-53,岛津公司);超高效液相色谱仪(ACQUITY H-Class,Waters公司);高效液相色谱仪(Alliance 2695,Waters公司);紫外检测器(2489,Waters公司);质谱仪(Xevo G2-S QTof,Waters公司);BEH300 C4色谱柱((2.1 mm×100 mm,1.7 μm),Waters公司);冻干机(ModulyoD,Thermo公司);Symmetry300 C18色谱柱(4.6 mm×250 mm,5 μm,Waters公司);BEH 300 C4色谱柱(2.1 mm×50 mm,3.5 μm,Waters公司)。
超纯水为密理博超纯水机制备;乙腈为色谱级,购自Fisher Chemical公司;三氟乙酸为分析纯,购自梯希爱(上海)化成工业发展有限公司;甲酸为分析纯,购自阿拉丁试剂(上海)有限公司;氨基酸测序用标准品及所用实际均购自岛津公司。
重组人粒细胞刺激因子样品为本实验室留样。
2 方法与结果 2.1 N端序列异质体的分离、收集及冷冻干燥色谱条件:采用Waters BEH 300 C4(2.1 mm×100 mm,1.7 μm)色谱柱,柱温30 ℃,流动相A为0.1%三氟乙酸水溶液,流动相B为0.1%三氟乙酸乙腈溶液,梯度洗脱(0~2 min流动相B比例维持50%,2~22 min流动相B比例由50%变为60%),流速0.2 mL·min-1,样品保存温度15 ℃,进样50 μL,检测波长280 nm。根据色谱图检测结果分别收集各色谱峰的流出液。
冷冻干燥:将各收集液放入冻干机的离心浓缩组件,35 ℃离心浓缩1 h;取出置于-70 ℃冰箱放置3 h;取出并迅速放置于冻干机的冷冻干燥组件,真空干燥15 h。
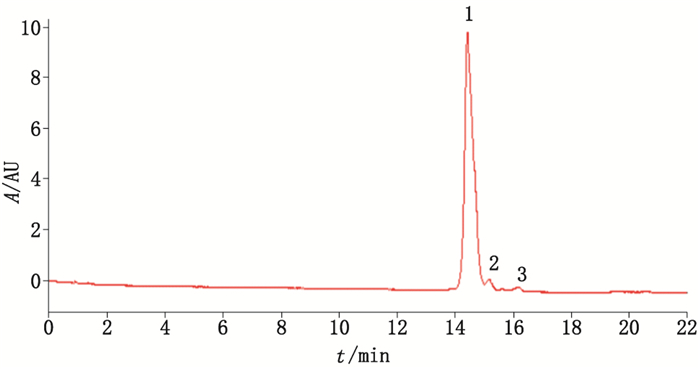
液相色谱图见图 1,峰1为主峰,峰2和峰1的保留时间相距较近,未有效地基线分离,所以在收集峰2流出液时,从峰2的后半部分开始收集。
|
1.主蛋白(target protein)2、3. N端异质性导致的制品相关蛋白(product-related proteins caused by N-terminal sequence heterogeneity) 图 1 rhG-CSF的超高效液相色谱图 Figure 1 UPLC chromatogram of rhG-CSF |
应用N端氨基酸测序仪内置的Edman降解法分析N端氨基酸序列[4-5]。取出收集并冻干的组分,加入10 μL超纯水溶解,加于玻璃膜上,氮气吹扫干燥10 min;将干燥的玻璃膜组装入反应池,运行N端氨基酸测定程序。仪器自动加载异硫氰酸苯酯与N端氨基结合,在三氟乙酸蒸汽下裂解N端第1个肽键,将裂解下来的氨基酸残基在线转化成稳定的PTH氨基酸,过特异的氨基酸分离柱并记录结果。
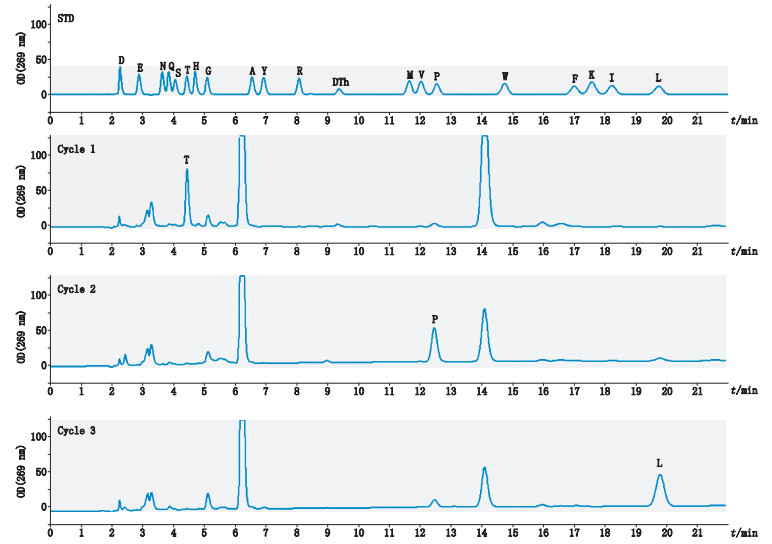
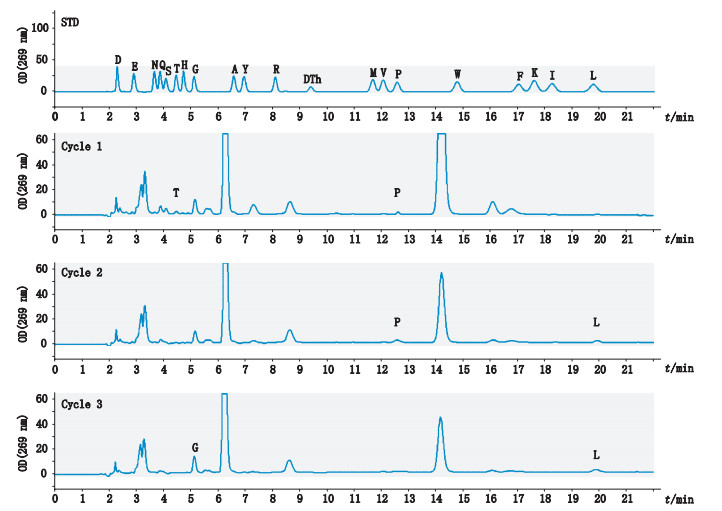
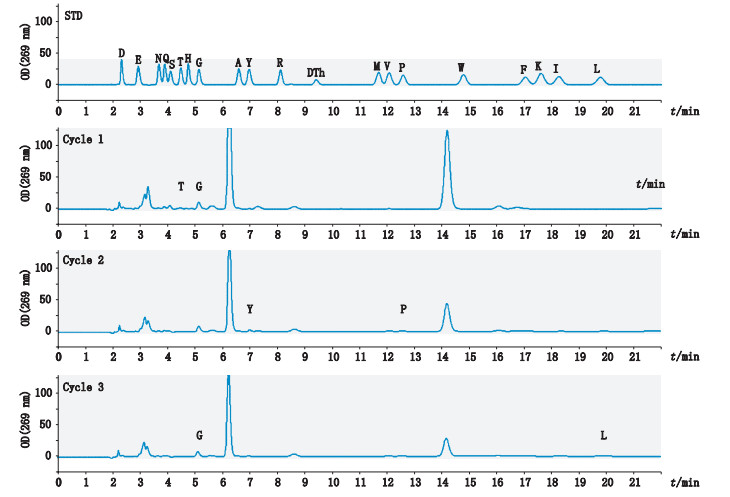
N末端测序仪分析结果如图 2~4(用氨基酸单字符表示),分别为峰1、峰2、峰3收集液的N端氨基酸序列谱图(共3个循环)。其中峰1的纯度较好,测序结果为TPL;峰2的总量较少不足5%,并受到峰1的干扰,测序结果为TPL和PLG,扣除峰1干扰序列,峰2的序列应为PLG,即N末端比峰1序列少1个氨基酸残基T;峰3的测序结果更为复杂,可能受到多个方面的影响,主要的序列为TPL和GYG,TPL应为峰1的干扰,GYG为部分分泌信肽的序列,参见质谱检测结果。
|
图 2 色谱峰1收集液的N端氨基酸序列检测结果(3个循环) Figure 2 The detection results of N terminal amino acid sequence of liquid collectedby chromatographic peak 1 (3 cycles) |
|
图 3 色谱峰2收集液的N端氨基酸序列检测结果(3个循环) Figure 3 The detection results of N terminal amino acid sequence of liquid collected by chromatographic peak 2 (3 cycles) |
|
图 4 色谱峰3收集液的N端氨基酸序列检测结果(3个循环) Figure 4 The detection results of N terminal amino acid sequence of liquid collected by chromatographic peak 3 (3 cycles) |
色谱条件:采用BEH300 C4色谱柱(2.1 mm×50 mm,3.5 μm),柱温为80 ℃,流动相A为超纯水,流动相B为乙腈,流动相C为1%的甲酸水溶液,洗脱梯度见表 1;MS条件:正离子、分辨率模式采集数据,毛细管电压3 kV,锥孔电压40 V,去溶剂气体温度350 ℃,源温120 ℃,去溶剂气体流速800 L·h-1,扫描范围(m/z)500~3 000;样品保存温度10 ℃,用超纯水将样品稀释至约1 mg·mL-1,进样量10 μL[6]。
|
|
表 1 液质联用分析的洗脱梯度 Table 1 Gradient elution procedure of UPLC-MS |
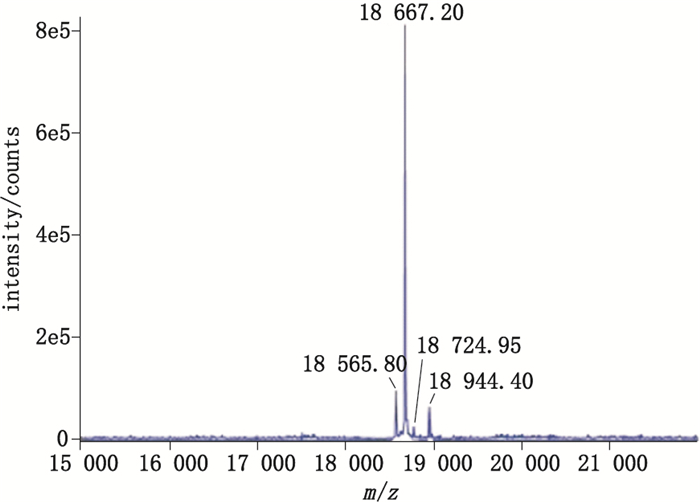
质谱检测结果见图 5,共有3个峰,其中主峰相对分子质量为18 667.20,与以TPL为起始序列的rhG-CSF的相对分子质量一致;18 565.80与主峰的相对分子质量差值为101.40,与苏氨酸(T)残基的相对分子质量一致,故18 565.80为以PLG为起始序列的rhG-CSF的相对分子质量;18 944.40与主峰相对分子质量量的差值为277.20,与N端氨基酸序列检测的GYG三肽残基(见图 4)的相对分子质量277.28一致,故应为以GYGTPL为起始序列的rhG-CSF的相对分子质量。图 5中丰度较低的、靠近主峰的小峰相对分子质量为18 724.95,与主峰相对分子质量的差值为57.29,即1个甘氨酸残基相对分子质量57.05,所以18 724.95应为以GTPL为起始序列的rhG-CSF的相对分子质量。从总体上看,这是表达系统信号肽切除时留下的痕迹,即在主切割位点附近,仍然留存非特异性切割位点,产生的蛋白起始序列呈现了梯次形态,及GYGTPL...、YGTPL...(未检出)、GTPL...(占比较低)、TPL...和PL...。
|
图 5 质谱检测rhG-CSF的相对分子质量 Figure 5 Relative molecular mass of rhG-CSF detected by mass spectrometry |
色谱条件:采用Symmetry 300 C18(4.6 mm×250 mm,5 μm)色谱柱,柱温30 ℃,流动相A为0.1%三氟乙酸水溶液,流动相B为0.1%三氟乙酸乙腈溶液,梯度洗脱(0~2 min,流动相B的比例维持0%;2~10 min,流动相B的比例由0%到40%;10~50 min,流动相B的比例由30%到70%),流速1.0 mL·min-1,检测波长214 nm。样品保存温度15 ℃,直接进样20 μL进行检测。
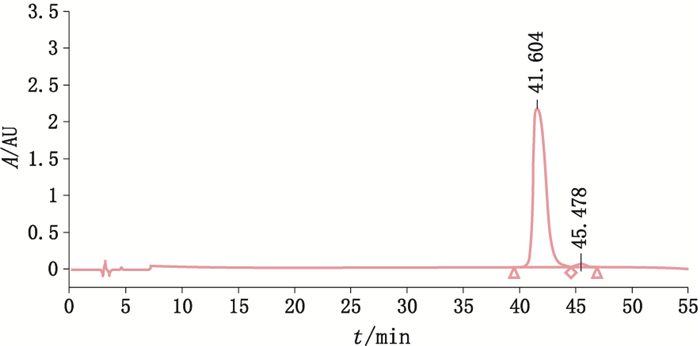
检测色谱图见图 6,按峰面积归一化法积分,主峰面积大于98.3%。
|
图 6 rhG-CSF的反相高效液相色谱图 Figure 6 RP-HPLC chromatogram of rhG-CSF |
部分单链重组蛋白类制品的蛋白质主链N-末端具有异质性,即有2个以上N-末端起始肽链,长的肽链序列包含短的肽链序列,或短的序列缺失了1个或几个氨基酸残基。产生这种现象的原因,可能与生产工艺相关或与肽链本身性质相关[7-9]。较常见的情况是:如果重组蛋白质是通过分泌表达,在过细胞膜的过程中需要膜肽酶的切割,而发酵环境的变化可使切割位点偏移[10],从而产生N端异质体;另外,脯氨酸残基在N端第2位的多肽,其N端第1位与第2位脯氨酸之间的肽键较其他肽键更易断裂[10],这也会导致N端异质体的出现。
具有N-末端异质性的各种蛋白是否有不同的生物学活性尚无定论[11-13]。如果缺失的氨基酸残基影响了蛋白的活性中心或改变了蛋白质的空间结构,那么蛋白的比活性可能损失较多;如果缺失的氨基酸残基使其与配体的结合力下降,也可能会引起比活性下降。2015年版《中华人民共和国药典》三部中将rhG-CSF以蛋氨酸残基起始的序列和以苏氨酸残基起始的序列均视为主药成分,这是不同生产企业制品标准合并的结果,部分生产企业制品属前者,部分属后者。2个N端序列不同的主药成分在比活性上未做明显区分,说明相差不显著。
很多学者倾向于将这种N端异质性蛋白看作相关蛋白。从逻辑上讲,蛋白分子上有任何基团的丢失或加入都带来分子结构的变化,这一过程在制品的生产和保藏过程中每时每刻都在发生,所以任何一个人们认为的纯蛋白类制品,也许只是“理论上的纯品”,实际上是各种相似物质的混合物,只是主药蛋白质占主体。只有占比较高的相关蛋白才容易引起人们的注意。
在制品申报过程中,人们是按照既定目标进行申报,即认定组分(主药蛋白)与杂质(如宿主蛋白等),而游离在两者之间的蛋白种类繁多。从检测手段上看,一些常规的质量控制检测方法并不能有效分离所有“主药蛋白”之外的其他蛋白,如本文中提及的RP-HPLC纯度检测法就不能完全区分部分N端异质性蛋白,纯度大于98.3%,即将部分相似物质也列入其中。
从分子结构上看,有些蛋白与主药蛋白非常相近且具有较高的同源性,性质上也较为接近,但如果其具有毒副作用,就应该格外关注并且加以控制。从理论上推测,N端异质性蛋白应具有与“主药蛋白”相似的生物学活性,但由于目前实验条件所限,本文未进行验证。后续将进一步对rhG-CSF样品进行分析和测定,如纯化收集足量的相关蛋白,测定蛋白含量,除菌过滤后测定生物学活性并统计分析其比活性,还需评价乙腈等有机溶剂对生物学活性测定的影响等。
本文对rhG-CSF蛋白质N-端异质性进行了分析,希望为国产rhG-CSF制品的质量标准提升提供参考和数据支持。
| [1] |
ASANO S. Function, molecular structure and gene expression of granulocyte colony-stimulating factor[J]. Nihon Rinsho, 1992, 50(8): 1854. |
| [2] |
MORSTYN G, FOOTE M, PERKINS D, et al. The clinical utility of granulocyte colony-stimulating factor:early achievements and future promise[J]. Stem Cells, 1994, 12(Suppl 1): 213. |
| [3] |
BABAEIPOUR V, KHANCHEZAR S, MOFID MR, et al. Efficient process development of recombinant human granulocyte colony-stimulating factor (rh-GCSF) production in Escherichia coli[J]. Iran Biomed J, 2015, 19(2): 102. |
| [4] |
梁逊, 郭小丽. 多肽、蛋白质固相分析[J]. 生物化学与生物物理学进展, 1988, 15(2): 105. LIANG X, GUO XL. Solid phase analysis of polypeptide and protein[J]. Prog Biochem Biophys, 1988, 15(2): 105. |
| [5] |
史新昌, 杨靖清, 韩春梅, 等. N-末端氨基酸测序数据估计N-末端不均一的单链重组蛋白制品主肽链比例的方法[J]. 中国生物制品学杂志, 2016, 29(10): 1073. SHI XC, YANG JQ, HAN CM, et al. Estimate most-peptide-chain-component-ratio of heterogeneous N-terminal single subunit recombinant protein biological products using N-terminal sequencer data[J]. Chin J Biol, 2016, 29(10): 1073. |
| [6] |
毕华, 陶磊, 韩春梅, 等. 重组人血管内皮生长因子抑制剂理化对照品质控方法及质量标准的建立[J]. 中国生物制品学杂志, 2017, 30(8): 833. BI H, TAO L, HAN CM, et al. Establishment of methods and standard for quality control of physicochemical reference substance for recombinant human vascular endothelial growth factor inhibitor[J]. Chin J Biol, 2017, 30(8): 833. |
| [7] |
BRORSON K, JIA AY. Therapeutic monoclonal antibodies and consistent ends:terminal heterogeneity, detection, and impact on quality[J]. Curr Opin Biotechnol, 2014, 30(30C): 140. |
| [8] |
RENZ A, SCHIKORA S, SCHMID R, et al.cDNA sequence and heterologous expression of monomeric spinach pullulanase: multiple isomeric forms arise from the same polypeptide[J].1998, 331(Pt 3): 937 https://www.ncbi.nlm.nih.gov/pubmed/9560325
|
| [9] |
VIGUERA AR, SERRANO L. Stable proline box motif at the N-terminal end of alpha-helices[J]. Protein Sci, 1999, 8(9): 1733. DOI:10.1110/(ISSN)1469-896X |
| [10] |
何冰芳, 米兰, 陈文华. 大肠杆菌蛋白质分泌机理及其重组蛋白分泌表达新进展[J]. 食品与生物技术学报, 2012, 31(6): 561. HE BF, MI L, CHEN WH. Research advances in mechanism of protein secretion and secretory expression of recombinant prote in E.coli[J]. J Food Sci Biotechnol, 2012, 31(6): 561. DOI:10.3969/j.issn.1673-1689.2012.06.001 |
| [11] |
RAUCCI R, COSTANTINI S, CASTELLO G, et al. An overview of the sequence features of N-and C-terminal segments of the human chemokine receptors[J]. Cytokine, 2014, 70(2): 141. DOI:10.1016/j.cyto.2014.07.257 |
| [12] |
HESS AD, THOBURN C, CHEN W, et al. The N-terminal flanking region of the invariant chain peptide augments the immunogenicity of a cryptic "self" epitope from a tumor-associated antigen[J]. Clin Immunol, 2001, 101(1): 67. DOI:10.1006/clim.2001.5096 |
| [13] |
EL-SHAMY A, SHOJI I, KIM SR, et al. Sequence heterogeneity in NS5A of hepatitis C virus genotypes 2a and 2b and clinical outcome of pegylated-interferon/ribavirin therapy[J]. PLoS One, 2012, 7(2): e30513. DOI:10.1371/journal.pone.0030513 |
 2018, Vol. 38
2018, Vol. 38 
