重组人干扰素β1b(IFN β1b)是1种大肠杆菌表达的基因工程药物,由165个氨基酸组成,相对分子质量约为18 k,与天然形式的干扰素β相比,其第17位半胱氨酸突变为丝氨酸,无N端甲硫氨酸,无糖基化修饰,但仍可折叠成正确的干扰素β分子,并与受体结合,具有表达量高、稳定性好的优点[1-2]。1993年被美国FDA批准上市,用于多发性硬化症的治疗,2010年获准在中国上市[3-6]。作为1种重组蛋白药物,IFNβ1b容易在生产或储存阶段发生蛋白质修饰反应,如氨基酸的氧化、脱酰胺、肽链断裂、聚集和错误折叠等,产生蛋白变异体,即相关蛋白,相关蛋白可以使重组蛋白药物的生物学活性下降,药代动力学特性发生改变,易诱生中和抗体或导致过敏等严重副反应,增加患者的用药风险[7-9]。氧化产物是一种非常重要的制品相关蛋白,由于其对重组蛋白免疫原性及生物学活性的潜在影响,在产品质控方面需要密切关注[10-11]。重组蛋白中容易发生氧化的氨基酸主要是蛋氨酸和半胱氨酸,蛋氨酸通过氧化可转变为蛋氨酸亚砜甚至蛋氨酸砜,对蛋白的结构和功能会产生一定的影响,进而影响药物的安全性、有效性和稳定性。IFN β1b分子中含有3个蛋氨酸,理论上都可以被氧化,且氧化后IFN β1b的生物学活性降低,免疫原性增加,因此需要对氧化型干扰素(ox-IFN β1b)进行控制[12-13]。目前欧洲药典中已收录了ox-IFNα2,ox-IFN β1a和ox-IFNγ1b的测定方法,但ox-IFN β1b的质控尚无相关报道[14-15]。因此,ox-IFN β1b检测方法的建立对于IFN β1b产品质量标准的提高具有重要意义。
欧洲药典中ox-IFNα2的测定采用C18反相高效液相色谱法(RP-HPLC)法,ox-IFN β1a采用肽图法,ox-IFNγ1b采用阳离子交换色谱法(CEC)。本研究采用C8 RP-HPLC技术,建立了针对IFN β1b原液中ox-IFN β1b质量控制的方法,并用该法对2个厂家6个批次的IFN β1b原液进行了检测。
1 仪器与试药HPLC色谱仪(Waters 2659分离器,2487紫外检测器,Empower工作站);RP-C8色谱柱(Grace Vydac,4.6 mm×250 mm,5μm)。
3批A厂家IFN β1b原液(MA)和3批B厂家IFN β1b原液(MB)均为本实验室留存样品;三氟乙酸(TFA)(分析纯,Aladdin);乙腈(色谱纯,Merk);H2O2、L-甲硫氨酸均为分析纯。
2 方法 2.1 样品制备 2.1.1 IFN β1b样品将IFN β1b原液用超纯水稀释至0.7 mg·mL-1,10 000 r·min-1离心1 min,取上清液,即得。
2.1.2 ox-IFN β1b样品从3批A厂家IFN β1b(MA)原液和3批B厂家IFN β1b(MB)原液中各选取1批,用超纯水稀释至0.7 mg·mL-1,分别加入不同体积的2.0% H2O2溶液,使H2O2终浓度分别为0.01%、0.05%和0.25%,室温放置1 h进行氧化反应,然后加入L-甲硫氨酸使其终浓度为12.5 mg·mL-1,室温放置1 h以终止氧化反应,10 000 r·min-1离心1 min,取上清液,即得。
2.2 色谱条件柱温40 ℃;检测波长214 nm;进样量20 μL;流速1.0 mL·min-1;用流动相A(0.1%TFA-10%乙腈-水溶液)和B(0.1%TFA-乙腈溶液)进行梯度洗脱,具体洗脱过程按表 1所示进行。
|
|
表 1 梯度洗脱条件 Table 1 Gradient elution conditions |
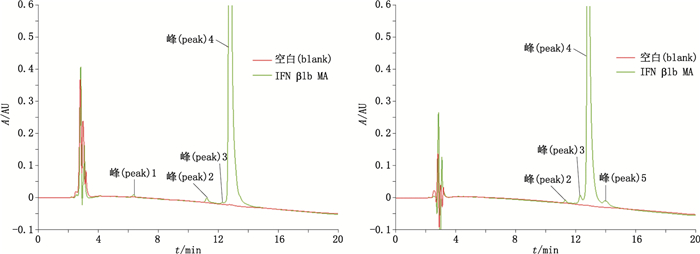
通过比较不同色谱柱(C4和C8反相柱),调整梯度洗脱条件,优化建立了适用于检测ox-IFN β1b的C8 RP-HPLC法,用该法测试A和B厂家的IFN β1b原液(MA和MB),色谱图见图 1。
|
图 1 RP-HPLC法分析A和B厂家的IFN β1b原液(IFN β1b MA和MB) Figure 1 Analysis of IFN β1b bulks from A and B manufacturers (IFN β1b MA和MB) by RP-HPLC |
除IFN β1b主峰(峰4)和溶剂峰外,均分离到3个杂质蛋白峰,各峰的保留时间、峰面积、峰面积百分比(%面积)、USP分离度和USP理论塔板数见表 2。
|
|
表 2 IFN β1b MA和MB样品的色谱峰参数 Table 2 Parameters of chromatographic peaks of IFN β1b MA and MB samples |
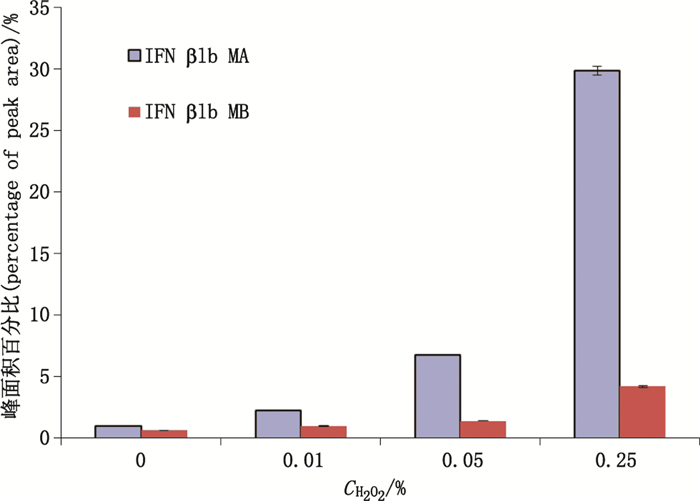
为鉴定ox-IFN β1b峰,采用不同浓度H2O2处理IFN β1b样品1 h后进行测试。如图 2所示,IFN β1b MA和IFN β1b MB的峰2随着H2O2浓度升高而增加,且两者的保留时间基本一致,说明此峰为ox-IFN β1b峰。图 3为不同浓度H2O2处理1 h后ox-IFN β1b峰面积百分比,随着H2O2浓度增加,ox-IFN β1b峰明显增加,且MA样品的增加趋势较MB样品明显,当H2O2浓度为0.25%时,ox-IFN β1b峰面积百分比可增至30%左右。

|
图 2 IFN β1b MA和MB中ox-IFN β1b峰的鉴定 Figure 2 Identification of ox-IFN β1b peak in IFN β1b MA and MB bulks |
|
图 3 不同浓度H2O2处理1 h后ox-IFN β1b峰面积百分比 Figure 3 The peak area percentages of ox-IFN β1b after incubation with different concentration of H2O2 for 1 h |
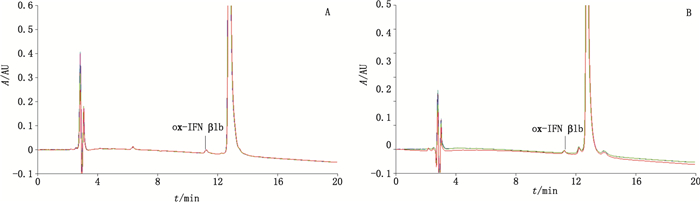
用RP-HPLC法对A和B厂家的IFN β1b样品进行测试,分别重复进样6次,计算RSD。6次进样的色谱图见图 4。
|
图 4 IFN β1b MA(A)和MB(B)6次进样的色谱图 Figure 4 Chromatograms of 6 injections of IFN β1b MA(A) and MB(B) |
6次重复进样的ox-IFN β1b峰保留时间、峰面积、峰面积百分比及相应RSD计算结果见表 3。保留时间的RSD仅为0.1%,峰面积和峰面积百分比的RSD均小于5%。说明该法的精密度较好。
|
|
表 3 6次进样的ox-IFN β1b峰结果 Table 3 Ox-IFN β1b peak results of 6 injections |
用RP-HPLC法测试A和B厂家共6批IFN β1b原液各3次。所有样品中均检出ox-IFN β1b,用面积归一化法计算百分含量,结果见表 4。
|
|
表 4 IFN β1b原液中ox-IFN β1b百分含量计算结果 Table 4 Results of ox-IFN β1 percentage contents in IFN β1b bulks |
目前对于氧化型相关蛋白的检测方法主要分为肽段水平检测及完整蛋白水平检测。肽段水平检测是先将待测蛋白酶解成肽段,液相色谱分离氧化及未氧化的相关肽段,再通过紫外检测器或质谱进行测定,该法仅能测定特定位点的修饰比例,不能区分多位点氧化变异体并进行定量,且酶解过程可能引入新的修饰,使测定结果不准确[16]。目前欧洲药典中ox-IFN β1a的测定方法即为肽图法。完整蛋白水平的检测可以避免这些问题,但要对分离方法进行优化,以使氧化产物与预期制品可有效分离[17-18]。目前欧洲药典中ox-IFNα2和ox-IFNγ1b的测定方法均为完整蛋白水平的检测。本研究中所建立的RP-HPLC法也是在完整蛋白水平上检测ox-IFN β1b。前期研究比较了C4和C8色谱柱,发现两者均可有效分离ox-IFN β1b峰,但是C8柱的基线更平滑,因此选择C8柱。通过调整流动相A和B的比例,优化梯度洗脱条件,使各峰在短时间(20 min)内达到最佳分离。采用优化的RP-HPLC法将IFN β1b样品中的主峰和杂质蛋白峰进行有效分离,通过H2O2处理来定位ox-IFN β1b峰。进一步的结构鉴定还需分离纯化ox-IFN β1b组分,用质谱技术进行分析。从检测结果来看,尽管A厂家和B厂家的相关蛋白分布有所不同,但所建方法均可将ox-IFN β1b进行有效分离,ox-IFN β1b峰保留时间为11.2 min,与峰3的分离度为4.0左右,理论塔板数大于20,000。通过6次重复进样计算,ox-IFN β1b峰面积百分比的RSD小于5%,说明该法的精密度较高。目前尚无ox-IFN β1b参考品,只能采用峰面积归一化法计算ox-IFN β1b峰面积百分比进行定量。2个厂家6批IFN β1b原液测定结果显示,所有样品中均检出ox-IFN β1b,说明ox-IFN β1b的测定是非常必要的,应作为关键质量属性纳入IFN β1b质量控制体系,该法的建立对IFN β1b质量控制体系的完善具有重要的促进作用。
| [1] |
HAJI AM, MOFRAD MR, SCHELLEKENS H. Interferon beta:from molecular level to therapeutic effects[J]. Int Rev Cell Mol Biol, 2016, 326: 343. DOI:10.1016/bs.ircmb.2016.06.001 |
| [2] |
GARTNER J, BRUCK W, WEDDIGE A, et al. Interferon beta-1b in treatment-naïve paediatric patients with relapsing-remitting multiple sclerosis:two-year results from the BETAPAEDIC study[J]. Mult Scler J Exp Transl Clin, 2017, 3(4): 1842799705. |
| [3] |
DOSHI A, CHATAWAY J. Multiple sclerosis, a treatable disease[J]. Clin Med (Lond), 2017, 17(6): 530. DOI:10.7861/clinmedicine.17-6-530 |
| [4] |
杨云凯, 马昱, 刘明, 等. 注射用重组人干扰素β1b规模化分离纯化工艺的建立及其产品质量的检定[J]. 中国生物制品学杂志, 2017, 30(12): 1321. YANG YK, MA Y, LIU M, et al. Establishment of process for large-scale purification of recombinant human interferonβ1b for injection and quality control of products[J]. Chin J Biol, 2017, 30(12): 1321. |
| [5] |
张书艳, 柳文科, 陈忠义. 不同剂量的干扰素-β对多发性硬化(MS)的疗效探讨[J]. 中外医疗, 2015(23): 94. ZHANG SY, LIU WK, CHEN ZY. Observe the curative effect of different doses of interferon-β on multiple sclerosis[J]. Chin Foreign Med Treat, 2015(23): 94. DOI:10.3969/j.issn.1674-0742.2015.23.044 |
| [6] |
ZETTL U, BAUERSTEINHUSEN U, GLASER T, et al. Adherence to long-term interferon beta-1b injection therapy in patients with multiple sclerosis using an electronic diary[J]. Adv Ther, 2016, 33(5): 834. DOI:10.1007/s12325-016-0325-6 |
| [7] |
陶磊, 丁有学, 刘兰, 等. 应用串联质谱技术分析几种重组蛋白药物的翻译后修饰[J]. 中国药学杂志, 2015, 50(19): 1726. TAO L, DING YX, LIU L, et al. Identification of several kinds of post-translational modifications in recombinant protein pharmaceuticals using MS/MS[J]. Chin Pharm J, 2015, 50(19): 1726. |
| [8] |
MAHJOUBI N, FAZELI MR, DINARVAND R, et al. Preventing aggregation of recombinant interferon beta-1b in solution by additives:approach to an albumin-free formulation[J]. Adv Pharm Bull, 2015, 5(4): 497. |
| [9] |
DEEHAN M, GARCES S, KRAMER D, et al. Managing unwanted immunogenicity of biologicals[J]. Autoimmun Rev, 2015, 14(7): 569. DOI:10.1016/j.autrev.2015.02.007 |
| [10] |
LAROCQUE L, BLIU A, XU R, et al. Bioactivity determination of native and variant forms of therapeutic interferons[J]. J Biomed Biotechnol, 2011, 2011: 174615. |
| [11] |
SKRLIN A, KOSOR K, GOSAK D, et al. Correlation of liquid chromatographic and biological assay for potency assessment of filgrastim and related impurities[J]. J Pharm Biomed Anal, 2010, 53(3): 262. DOI:10.1016/j.jpba.2010.02.006 |
| [12] |
Van BEERS MMC, SAUERBORN M, GILLI F, et al. Oxidized and aggregated recombinant human interferon beta is immunogenic in human interferon beta transgenic mice[J]. Pharm Res, 2011, 28(10): 2393. DOI:10.1007/s11095-011-0451-4 |
| [13] |
ABDOLVAHAB MH, FAZELI A, HALIM A, et al. Immunogenicity of recombinant human interferon beta-1b in immune-tolerant transgenic mice corresponds with the biophysical characteristics of aggregates[J]. J Interferon Cytokine Res, 2016, 36(4): 247. DOI:10.1089/jir.2015.0108 |
| [14] |
杨云凯, 马昱, 孙玉杰, 等. 反相高效液相色谱法测定注射用重组人干扰素β1b中干扰素β1b的含量[J]. 中国生物制品学杂志, 2015, 28(10): 1053. YANG YK, MA Y, SUN YJ, et al. Determination of interferon β1b content in recombinant human interferonβ1b for injection by reversed phase high performance liquid chromatography[J]. Chin J Biol, 2015, 28(10): 1053. |
| [15] |
TOROSANTUCCI R, SHAROV VS, Van BEERS M, et al. Identification of oxidation sites and covalent cross-links in metal catalyzed oxidized interferon beta-1a:potential implications for protein aggregation and immunogenicity[J]. Mol Pharm, 2013, 10(6): 2311. DOI:10.1021/mp300665u |
| [16] |
LIU H, NEILL A, PONNIAH G, et al. Accurate determination of protein methionine oxidation by stable isotope labeling and LC-MS analysis[J]. Anal Chem, 2013, 85(24): 11705. DOI:10.1021/ac403072w |
| [17] |
FORSTENLEHNER IC, HOLZMANN J, TOLL H, et al. Site-specific characterization and absolute quantification of pegfilgrastim oxidation by top-down high-performance liquid chromatography-mass spectrometry[J]. Anal Chem, 2015, 87(18): 9336. DOI:10.1021/acs.analchem.5b02029 |
| [18] |
HAUSBERGER A, LAMANNA WC, HARTINGER M, et al. Identification of low-level product-related variants in filgrastim products presently available in highly regulated markets[J]. BioDrugs, 2016, 30(3): 233. DOI:10.1007/s40259-016-0169-2 |
 2018, Vol. 38
2018, Vol. 38 
