粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)于1977年被发现[1],1985年人GM-CSF的cDNA克隆成功[2]。GM-CSF由T细胞、B细胞、巨噬细胞等细胞生成,主要参与粒细胞系和单核细胞系细胞的维持存活、促进生长、诱导分化和增强功能等生物学作用。GM-CSF由127个氨基酸组成,相对分子质量为14 474,含有2条二硫键(Cys54-Cys96,Cys88-Cys121)。1991年,酵母表达的重组人GM-CSF(rhGM-CSF)被FDA批准上市,用于骨髓移植后的白细胞恢复。国内同类制品于1998年被批准上市,由大肠杆菌表达生产,疗效与进口产品无显著差别[3]。
2005年版《中华人民共和国药典》(简称《中国药典》)三部已纳入“注射用重组人粒细胞巨噬细胞刺激因子”各论,检定项目涉及理化性质、纯度、杂质、活性等,但缺少制品相关蛋白检测[4]。所谓制品相关蛋白即是在重组蛋白生产和存放过程中发生修饰、降解或聚集等形成的一类物质,这类物质的形成可影响重组蛋白药物的安全性和有效性。目前现行版《中国药典》仍缺少制品相关蛋白检测[5],为促进药典标准提高,国家药典委员会立项“重组细胞因子类制品质量标准提高研究”课题,拟将制品相关蛋白检测项目加入该制品各论中,中国食品药品检定研究院与重庆市食品药品检验检测研究院共同承担了该课题的研究工作。
通过对比国外主流药典,发现仅有欧洲药典及英国药典收载该品种的制品相关蛋白检测项目[6-7],两者方法一致,因此本研究按该方法对征集的国产rhGM-CSF原液进行了分析,并用液相质谱联用的方法对分离的制品相关蛋白进行了鉴定,以期为《中国药典》标准的提高提供依据。
1 材料 1.1 试剂超纯水为密理博超纯水机制备;乙腈为色谱纯,购自Fisher Scientific公司;三氟乙酸、磷酸氢二钠、磷酸二氢钠均为分析纯,购自国药集团化学试剂有限公司;牛血白蛋白(BSA)购自Calbiochem公司;rhGM-CSF原液来自我国4家生产企业,共7批(编号:1-1/1-2/1-3,2-1/2-2,3-1,4-1);选取企业1的批次1(1-1)作为标准品。
1.2 仪器Waters Alliance 2690高效液相色谱仪与996紫外检测器(Waters公司);Acquity UPLC-Xevo G2-S液相质谱联用仪(Waters公司)。
2 方法 2.1 按欧洲药典方法[6]进行制品相关蛋白含量分析样品处理:待检原液用0.05 mol·L-1磷酸盐缓冲液(pH 7.0)稀释至0.5 mg·mL-1,即为供试品溶液;标准品用0.05 mol·L-1的磷酸盐缓冲液(pH 7.0)稀释至0.5 mg·mL-1,即为标准品溶液a;另将1体积的标准品溶液a与4体积的0.125 mg·mL-1 BSA溶液混匀,制备标准品溶液b。
色谱条件:色谱柱为Jupiter C4 300 Å(4.6 mm ×150 mm,5 µm);以0.1%的三氟乙酸水溶液(A)-0.1%的三氟乙酸90%乙腈溶液(B)为流动相,梯度洗脱(0~30 min,64% A→44% A);流速1.2 mL·min-1;进样体积100 µL,供试品溶液各进样3次,标准品溶液a进样2次,标准品溶液b进样4次;检测波长:214 nm。在(5~30)min范围内进行积分,记录各峰保留时间及峰面积百分比。
2.2 液相质谱联用鉴定制品相关蛋白色谱柱为Waters BEH300 C4(2.1 mm×150 mm,1.7 µm);流速:0.2 mL·min-1;进样体积:30 µL,样品处理及其他液相色谱仪参数同“2.1”项,质谱仪采用MS模式采集数据;毛细管电压:3.0 kV;Cone电压:40 V;去溶剂气体温度:350 ℃;源温:120 ℃;去溶剂气体流速:800 L·h-1,扫描范围(m/z):500~3 000;采用Unify操作软件进行数据处理。
3 结果 3.1 系统适用性测定结果欧洲药典所列方法的系统适用性要求是:标准品溶液b中rhGM-CSF的保留时间大约为22 min;4针连续进样的峰面积RSD不高于5.0%;BSA与rhGM-CSF的分离度不小于2。测定结果:进样4针标准品溶液b测得rhGM-CSF的保留时间为(22.5±0.1)min;峰面积的RSD为0.11%;BSA与rhGM-CSF的分离度为5.73±0.02,标准品溶液b的色谱图见图 1。测定结果满足该方法的系统适用性要求。

|
图 1 标准品溶液b的色谱图 Figure 1 Chromatography of standard solution b |
按欧洲药典所列方法,对国内4家生产企业的7批rhGM-CSF原液进行了检测。根据欧洲药典的判定标准:供试品溶液中任何杂质不超过1.5%;在(5~30)min范围内进行积分,杂质总量不超过4%,3家企业生产的5批原液符合规定,2家企业生产的2批原液不符合规定(见表 1)。
|
|
表 1 国产rhGM-CSF原液制品相关蛋白含量测定结果 Table 1 Contents of product-related proteins in rhGM-CSF bulks produced in China |
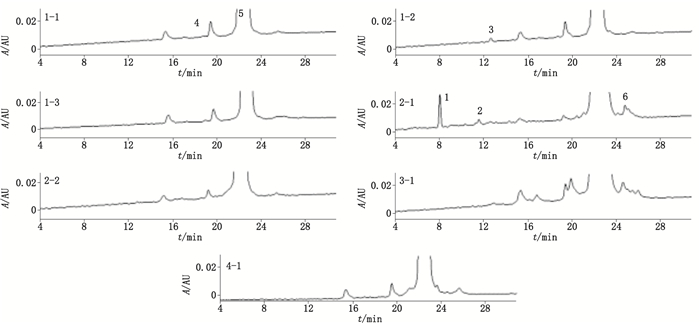
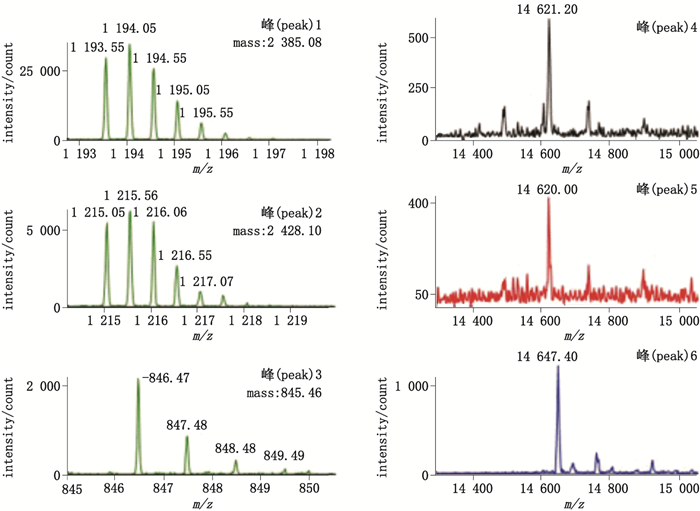
通过对比各批次原液的制品相关蛋白组成情况,发现有些制品相关蛋白为某批次原液所特有,如图 2中的峰1~3;有些在多批原液中普遍存在,如峰4~6。通过质谱对以上各峰进行了相对分子质量的测定,结果显示:峰1~3为相对分子质量不等的肽段;峰4与峰5为氧化形式(氧化后理论相对分子质量为14 620.75);峰6为乙酰化形式(乙酰化后理论相对分子质量为14 646.79),相对分子质量测定结果见图 3。
|
1.相对分子质量为2 385.08的多肽(peptide with relative molecular weight of 2 385.08)2.相对分子质量为2 428.10的多肽(peptide with relative molecular weight of 2 428.10)3.相对分子质量为845.46的多肽(peptide with relative molecular weight of 845.46)4.氧化型GM-CSF(oxidized GM-CSF)5.氧化型GM-CSF(oxidized GM-CSF)6.乙酰化型GM-CSF(acetylated GM-CSF) 图 2 各批次原液的制品相关蛋白组成色谱图 Figure 2 Chromatograms of constituents of product-related proteins in different lots of bulks |
|
图 3 质谱测定各制品相关蛋白的相对分子质量 Figure 3 Relative molecular weights of different product-related proteins measured by mass spectrometry |
采用液质联用的方式对主峰中的蛋白相对分子质量进行了测定(图 4),结果发现:主峰中的蛋白成分并不均一,其中绝大部分为完整的rhGM-CSF分子(理论相对分子质量为14 604.75),还存在部分N-末端缺少“Met”的蛋白(理论相对分子质量为14 473.56)以及N-末端缺少“MetAla”的蛋白(理论相对分子质量为14 402.48)。除此之外,还有一定数量的相对分子质量为14 719左右的蛋白,经分析为完整蛋白与流动相中的三氟乙酸(TFA)加合形成,该加合物的理论相对分子质量为14 718.78。

|
图 4 质谱测定主峰中蛋白相对分子质量 Figure 4 Relative molecular mass of proteins in the main peak measured by mass spectrometry |
天然GM-CSF存在糖基化修饰[8],FDA批准的原研药Sargramostim采用酵母系统表达,也存在糖基化修饰,其制品是由含不同类型糖基的rhGM-CSF组成的混合物[9]。与原研药不同,国产rhGM-CSF一般通过大肠杆菌表达生产,由于该表达系统自身的特点,所生产的蛋白没有糖基化修饰。研究显示,糖基化程度不影响GM-CSF的生物学活性[10-11],甚至有报道证明大肠杆菌表达的非糖基化GM-CSF比真核系统表达的糖基化GM-CSF有更高的生物学活性[12]。
大肠杆菌表达的蛋白还有另外一个特点:N-末端一般带有蛋氨酸[13-14],所以国产rhGM-CSF由128个氨基酸组成,理论相对分子质量为14 604.75。本研究通过对主峰蛋白相对分子质量的测定发现:各厂家的产品以N-末端含有蛋氨酸的GM-CSF为主,此外还存在不同比例的N-末端缺失1~2个氨基酸的GM-CSF。N-末端氨基酸的缺失对该蛋白的疏水性影响不大,所以在本研究中未能通过液相分离。有研究显示,GM-CSF N-末端的1~13位氨基酸的去除对活性没有明显影响,而14~25位氨基酸,特别是16~18位氨基酸残基对保持生物学活性是至关重要的[15]。N-末端缺失1~2个氨基酸残基的GM-CSF的存在可能跟生产工艺有关,它们可以作为目标产品的一部分而不是制品相关蛋白。
本研究在样品1-2及2-1中发现有相对分子质量不等的肽段出现,而在同一厂家生产的其他批次里未发现相应肽段。这些肽段的出现可能与生产工艺的细微变化有关,也可能在产品放置过程中形成,具体原因还有待进一步的分析。研究还发现,rhGM-CSF普遍存在的制品相关蛋白是氧化形式及乙酰化形式,这在其他大肠杆菌表达的蛋白中也比较常见[16]。不同企业由于生产工艺的差异,相应蛋白的含量也高低不同,为提高产品的质量,生产企业应针对性的优化生产工艺及保存条件,减少相关蛋白的含量。
本研究利用欧洲药典方法,对4家企业生产的7批rhGM-CSF原液进行了制品相关蛋白含量的测定,结果5批符合欧洲药典要求,合格率为71%,可以考虑将制品相关蛋白含量项目纳入新版药典各论中,以提高产品质量。
| [1] |
Shah RG, Caporale LH, Moore MA. Characterization of colony-stimulating activity produced by human monocytes and phytohemagglutinin-stimulated lymphocytes[J]. Blood, 1977, 50(5): 811. |
| [2] |
Wong GG, Witek-Giannotti JS, Temple PA, et al. Isolation of cDNAs encoding human and gibbon GM-CSF[J]. Prog Clin Biol Res, 1985, 191: 351. |
| [3] |
胡善联, 沈志祥, 袁弥满, 等. 国产与进口重组人粒细胞巨噬细胞集落刺激因子药物经济学评价比较[J]. 中国新药与临床杂志, 2000, 19(4): 309. HU SL, SHEN ZX, YUAN MM, et al. Pharmacoeconomic study on domestic and imported rHu GM-CSF product[J]. Chin J New Drugs Clin Rem, 2000, 19(4): 309. DOI:10.3969/j.issn.1007-7669.2000.04.029 |
| [4] |
中华人民共和国药典2005年版.三部[S].2005: 236 ChP 2005.Vol Ⅲ[S].2005: 236 |
| [5] |
中华人民共和国药典2015年版.三部[S].2015: 343 ChP 2015.Vol Ⅲ[S].2015: 343 |
| [6] |
EP 9.3[S].2017: 5719
|
| [7] |
BP 2015.Vol Ⅱ[S].2015: 304
|
| [8] |
Griffin JD, Cannistra SA, Sullivan R, et al. The biology of GM-CSF:regulation of production and interaction with its receptor[J]. Int J Cell Cloning, 1990, 8(Suppl 1): 35. |
| [9] |
USP 40[S].2016: 6108
|
| [10] |
Hussein AM, Ross M, Vredenburgh J, et al. Effects of granulocyte-macrophage colony stimulating factor produced in Chinese hamster ovary cells (regramostim), Escherichia coli (molgramostim) and yeast (sargramostim) on priming peripheral blood progenitor cells for use with autologous bone marrow after high-dose chemotherapy[J]. Eur J Haematol, 1995, 55(5): 348. |
| [11] |
Kim J, Park H, Park BT, et al. O-glycans and O-glycosylation sites of recombinant human GM-CSF derived from suspension-cultured rice cells, and their structural role[J]. Biochem Biophys Res Commun, 2016, 479(2): 266. DOI:10.1016/j.bbrc.2016.09.057 |
| [12] |
Cebon J, Nicola N, Ward M, et al. Granulocyte-macrophage colony stimulating factor from human lymphocytes.The effect of glycosylation on receptor binding and biological activity[J]. J Biol Chem, 1990, 265(8): 4483. |
| [13] |
Ahsan F, Arif A, Mahmood N, et al. Characterization and bioassay of post-translationally modified interferon α-2b expressed in Escherichia coli[J]. J Biotechnol, 2014, 184: 11. DOI:10.1016/j.jbiotec.2014.05.001 |
| [14] |
Piatkov KI, Vu TT, Hwang CS, et al. Formyl-methionine as a degradation signal at the N-termini of bacterial proteins[J]. Microb Cell, 2015, 2(10): 376. DOI:10.15698/mic |
| [15] |
Clark-Lewis I, Lopez AF, To LB, et al. Structure-function studies of human granulocyte-macrophage colony-stimulating factor.Identification of residues required for activity[J]. J Immunol, 1988, 141(3): 881. |
| [16] |
Ahsan F, Gardner QA, Rashid N, et al. Preventing the N-terminal processing of human interferon α-2b and its chimeric derivatives expressed in Escherichia coli[J]. Bioorg Chem, 2018, 76: 294. DOI:10.1016/j.bioorg.2017.11.016 |
 2018, Vol. 38
2018, Vol. 38 
