粒细胞集落刺激因子(granulocyte-colony stimulating factor,G-CSF)由活化的单核细胞、巨噬细胞、成纤维细胞等细胞分泌,主要生物学作用是促进中性粒细胞的增值和分化[1]。重组人G-CSF(rhG-CSF)由175个氨基酸组成,相对分子质量为18 799,其中含有5个半胱氨酸,形成两条二硫键(Cys37-Cys43,Cys65-Cys75),二硫键的形成对于维持G-CSF的生物学功能是必需的[2]。1996年,国产rhG-CSF批准上市,用于治疗放疗后的中性粒细胞减少症[3-4]。
作为重组蛋白,rhG-CSF在生产和储存过程中可能会发生氧化[5-6]、还原等反应,导致理化特性甚至生物学活性改变,这类新形成的物质称为制品相关蛋白[7]。2005年版《中华人民共和国药典》三部已将“重组人粒细胞刺激因子注射液”纳入各论,限于当时的技术条件,检定内容无制品相关蛋白检测项目[8]。2010年版在2005年版的基础上稍作改动[9],2015年版与2010年版一致[10]。经过10多年的发展,“重组人粒细胞刺激因子注射液”各论仍缺少“制品相关蛋白”检测项目。
在以上背景下,国家药典委员会立项“重组细胞因子类制品质量标准提高研究”课题,中国食品药品检定研究院与重庆市食品药品检验检测研究院共同承担了该课题的研究工作。本研究通过对比国外主流药典[11-13],选择最通用的欧洲药典(EP)中所列方法,对国内rhG-CSF原液的制品相关蛋白含量进行了分析检测,以期为该制品药典标准的提高提供数据支持。
1 材料超纯水为密理博超纯水机制备;乙腈为色谱纯;三氟乙酸、甲酸、L-甲硫氨酸、双氧水均为分析纯;二硫苏糖醇(DTT,纯度≥99%)购自Sigma Aldrich公司;rhG-CSF原液从国内12家生产企业征集,共33批;rhG-CSF对照品来自于中国食品药品检定研究院蛋白含量测定国家标准品,批号270023-200801。
Waters Alliance 2690高效液相色谱仪与996紫外检测器(Waters公司);Acquity UPLC-Xevo G2-S液质联用仪(Waters公司)。
2 方法 2.1 国外主流药典所列方法的对比本研究参考EP 9.3、美国药典(USP 41)、日本药典(JP 17))等国外主流药典,比较其中收录的rhG-CSF的制品相关蛋白检测方法,选择通用性最好的EP方法,对国内rhG-CSF原液进行分析测定。
2.2 按EP 9.3方法进行制品相关蛋白含量分析样品处理:待检rhG-CSF原液用超纯水稀释至0.5 mg·mL-1;取rhG-CSF对照品用超纯水稀释至0.5 mg·mL-1,即为对照品溶液A;取250 μL对照品溶液A,加入4.5 g·L-1的双氧水2.5 μL,混匀后于(25±2)℃放置30 min,再加入甲硫氨酸1.9 mg,即为对照品溶液B;取250 μL对照品溶液A,加入DTT 0.25 mg,混匀后于(35±2)℃温浴60 min,即为对照品溶液C。
色谱条件:色谱柱为TSKgel Protein C4-300(4.6 mm×150 mm,3 μm);以0.1%的三氟乙酸水溶液(A)-0.1%的三氟乙酸90%乙腈溶液(B)为流动相,梯度洗脱(0 ~ 30 min,60%A→20%A);流速:0.8 mL·min-1;柱温:60 ℃;进样体积:50 μL;检测波长:215 nm。
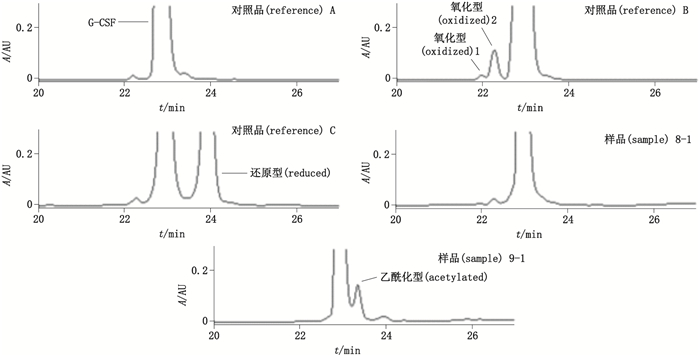
数据处理:rhG-CSF保留时间约23 min;氧化rhG-CSF(1)与rhG-CSF保留时间的比约为0.84;氧化rhG-CSF(2)与rhG-CSF保留时间的比约为0.98;还原型rhG-CSF与rhG-CSF保留时间的比约为1.04。
系统适用性要求:供试品与对照品主峰的保留时间应基本一致;供试品主峰的峰形应与对照品一致;对照品溶液B主峰(rhG-CSF)的对称因子最大不超过1.8;峰谷比不小于2.0(Hp指氧化峰2在基线以上的峰高;Hv指氧化峰2与主峰之间最低点的高度);对照品溶液C主峰和还原产物的分离度应不低于1.5,主峰(rhG-CSF)的对称因子最大不超过1.8。
判定标准:用归一化法计算供试品溶液图谱中各峰的含量,任何杂质不超过1.0%,杂质总量不超过2.0%。
2.3 液质联用鉴定未知制品相关蛋白样品处理及液相色谱仪参数同“2.2”,质谱仪采用MS模式采集数据;毛细管电压:3 000 V;Cone电压:40 V;去溶剂气体温度:350 ℃;源温:120 ℃;去溶剂气体流速:800 L·h-1,扫描范围(m/z):500~3 000;采用Unify操作软件进行数据处理。
3 结果 3.1 国外药典检测方法对比结果通过对比EP 9.3、USP 41、JP 17所列方法,发现USP 41与EP 9.3检测方法一致,仅在系统适应性要求、数据处理及结果判定方面稍有差别(见表 1);JP 17虽收录了rhG-CSF,但无制品相关蛋白检测项目。可见EP 9.3所列方法最为通用,因此本研究以该方法对国产rhG-CSF原液进行制品相关蛋白含量测定。
|
|
表 1 EP 9.3与USP 41中制品相关蛋白检测方法的比较 Table 1 Comparison of methods for detecting product related proteins in EP 9.3 and USP 41 |
按EP 9.3所列的rhG-CSF制品相关蛋白检测方法,对国内12家生产企业的33批原液进行检测,结果显示,4家企业的原液达到了EP 9.3的标准,1家企业的部分批次达到了EP 9.3标准,其余7家企业的产品不符合EP 9.3标准(见表 2)。
|
|
表 2 国产rhG-CSF原液制品相关蛋白含量测定结果 Table 2 Contents of product related proteins in rhG-CSF bulk produced in China |
另外,由于EP 9.3与USP 41在结果判定方面存在少许差异(见表 1),样品8-1中最大组分为氧化峰2(见图 1),含量为1.1%,按EP 9.3标准不合格,但是按USP 41标准合格。33批原液中仅1批存在该情况,其余样品按EP 9.3与USP 41判定结果一致。
|
图 1 部分样品的制品相关蛋白测定图谱 Figure 1 Chromatograms of some samples for detecting product related proteins |
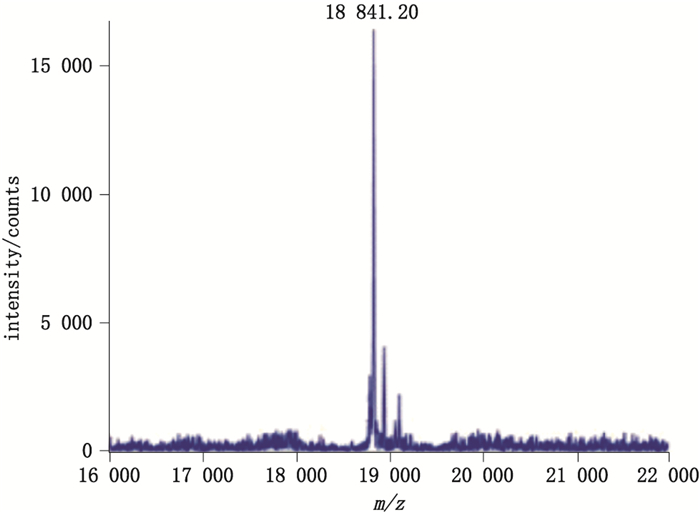
欧洲药典所列的方法通过对对照品溶液的氧化及还原处理得到了G-CSF的氧化峰及还原峰,可以指示样品中的相应制品相关蛋白。但是,有些样品中除氧化峰及还原峰外,还存在其他种类的制品相关蛋白,如样品9,在主峰与还原峰之间存在含量较高的未知峰(图 1中样品9-1),经质谱鉴定为乙酰化峰,实测相对分子质量为18 841.20(见图 2,G-CSF乙酰化后理论相对分子质量为18 840.92)。检测发现,有2家企业生产的原液存在此种情况,乙酰化峰的出现可能与生产工艺有关,乙酰化对制品的影响以及对该类结果如何判定,还需要后续的研究讨论。
|
图 2 样品9-1中乙酰化峰的质谱图 Figure 2 The mass spectrum of acetylated peak in sample 9-1 |
国产G-CSF从1996年批准上市至今,经历了20余年的发展,共有16家企业获得批准文号。本次研究对其中12家生产企业的33批原液进行了测定,结果具有一定的代表性。测定结果显示,4家企业达到了欧洲药典的标准,1家企业的部分批次达到了欧洲药典标准,其余7家企业的产品不符合欧洲药典标准。从厂家数量来说,符合欧洲药典标准的占少数;但是从市场占有率看,4家合格企业及原研厂家的产品占比接近70%。以上情况说明,经过20多年的发展进步,我国市场上的大部分G-CSF制品的对应原液已符合欧洲药典的制品相关蛋白的标准,目前已经具备了提高药典标准、淘汰质量较差产品的条件。
另一方面,国外G-CSF药物的发展趋势显示,长效G-CSF以显著的治疗优势逐渐成为市场主流[14-16],占据约70%的全球市场份额。目前,国内有3家企业生产的长效G-CSF上市,虽然国内市场还是以短效G-CSF占据主导地位,但是,随着2017年医保目录调整,长效G-CSF进入国家医保乙类目录,国内长效G-CSF将进入快速发展期。在此节点,提高G-CSF的药典标准,淘汰落后产品,促进国内G-CSF药物市场的升级换代变得十分必要。
综上所述,本研究利用欧洲药典方法对国产rhG-CSF原液进行了制品相关蛋白含量的测定,测定结果支持提高药典标准,将制品相关蛋白含量项目纳入新版药典。
| [1] |
Nagata S. Gene structure and function of granulocyte colony-stimulating factor[J]. Bioessays, 1989, 10(4): 113. DOI:10.1002/(ISSN)1521-1878 |
| [2] |
Lu HS, Clogston CL, Narhi LO, et al. Folding and oxidation of recombinant human granulocyte colony stimulating factor produced in Escherichia coli.Characterization of the disulfide-reduced intermediates and cysteine-serine analogs[J]. J Biol Chem, 1992, 267(13): 8770. |
| [3] |
Koloc G, Scharnweber K. Recombinant human granulocyte colony-stimulating factor:an overview[J]. J Intraven Nurs, 1993, 16(4): 234. |
| [4] |
Carulli G. Recombinant human granulocyte colony-stimulating factor and neutrophil phenotype[J]. Br J Haematol, 1995, 91(2): 513. |
| [5] |
Forstenlehner IC, Holzmann J, Toll H, et al. Site-specific characterization and absolute quantification of pegfilgrastim oxidation by top-down high-performance liquid chromatography-mass spectrometry[J]. Anal Chem, 2015, 87(18): 9336. DOI:10.1021/acs.analchem.5b02029 |
| [6] |
Kryndushkin D, Wu WW, Venna R, et al. Complex nature of protein carbonylation specificity after metal-catalyzed oxidation[J]. Pharm Res, 2017, 34(4): 765. DOI:10.1007/s11095-017-2103-9 |
| [7] |
Hausberger A, Lamanna WC, Hartinger M, et al. Identification of low-level product-related variants in filgrastim products presently available in highly regulated markets[J]. BioDrugs, 2016, 30(3): 233. DOI:10.1007/s40259-016-0169-2 |
| [8] |
中华人民共和国药典2005年版.三部[S].2005: 236 ChP 2005.Vol Ⅲ[S].2005: 236 |
| [9] |
中华人民共和国药典2010年版.三部[S].2010: 296 ChP 2010.Vol Ⅲ[S].2010: 296 |
| [10] |
中华人民共和国药典2015年版.三部[S].2015: 341 ChP 2015.Vol Ⅲ[S].2015: 341 |
| [11] |
EP 9.3[S].2017: 4899
|
| [12] |
USP 41[S].2017: 1739
|
| [13] |
JP 17.Vol ⅩⅦ[S].2016: 929
|
| [14] |
Morishita M, Leonard RC. Pegfilgrastim; a neutrophil mediated granulocyte colony stimulating factor-expanding uses in cancer chemotherapy[J]. Expert Opin Biol Ther, 2008, 8(7): 993. DOI:10.1517/14712598.8.7.993 |
| [15] |
Aapro M, Boccia R, Leonard R, et al. Refining the role of pegfilgrastim (a long-acting G-CSF) for prevention of chemotherapy-induced febrile neutropenia:consensus guidance recommendations[J]. Support Care Cancer, 2017, 25(11): 3295. DOI:10.1007/s00520-017-3842-1 |
| [16] |
Kuan JW, Su AT, Leong CF, et al. Pegylated granulocyte-colony stimulating factor versus non-pegylated granulocyte-colony stimulating factor for peripheral blood stem cell mobilization:a systematic review and meta-analysis[J]. J Clin Apher, 2017, 32(6): 517. DOI:10.1002/jca.v32.6 |
 2018, Vol. 38
2018, Vol. 38 
