重组人干扰素α-2是一种通过工程化大肠杆菌表达系统表达后,经纯化制备的产品,用于治疗恶性肿瘤、亚急性重症肝炎、肝纤维化(早期肝硬化)、感染与损伤性疾病、骨髓增生异常综合症、病毒性疾病、系统性硬皮病、异位性皮炎、风湿性关节炎等症[1-3]。人干扰素α-2包括α-2a和α-2b,两者氨基酸序列相似,只是在第23位,人干扰素α-2a为赖氨酸残基,而α-2b为精氨酸残基。重组人干扰素α-2作为重组蛋白药物,很容易在生产或储存阶段由于某些氨基酸的氧化、脱酰胺、肽链断裂、蛋白水解、聚集和错误折叠等原因,产生多种蛋白变异体,即重组人干扰素α-2的制品相关蛋白[4-6]。这些相关蛋白与天然蛋白相比,结构已发生变化,并可能带来一些不良后果:生物活性下降;药代动力学特性发生改变;免疫原性改变从而产生不希望的免疫反应等[7-10]。因此,制品相关蛋白的产生可能导致产品质量下降,对其进行分析和控制是重组蛋白药物质量控制的重要项目[11-13]。欧洲药典(EP)采用反相HPLC方法对干扰素α-2产品相关蛋白进行分析[14-15]。但是在现行版《中华人民共和国药典》(简称《中国药典》)中,重组人干扰素α-2a/2b的质量标准不包含该项目的检测[16]。本研究拟采用EP的干扰素α-2相关蛋白分析方法,对国内不同厂家生产的产品进行检测,为提高干扰素产品的药典标准,即增加制品相关蛋白检测项目提供实验数据支持,从而为进一步提高国内干扰素的产品质量奠定基础。
1 材料与方法 1.1 仪器与试剂仪器:Waters 2695型液相色谱仪;Waters 2489型紫外检测器;Waters Empower数据分析软件。三氟乙酸、乙腈为色谱纯,水为超纯水。20批重组人干扰素α-2原液获自7家生产企业(A~G)。
1.2 溶液的制备 1.2.1 供试品溶液分别取适量来源于7家生产企业的20批重组人干扰素α-2原液,用注射用水稀释至1 mg·mL-1,混匀,作为供试品溶液。
1.2.2 参比溶液取一定量的其中1份供试品溶液(D厂家),加入适量的0.25%过氧化氢溶液,使过氧化氢终浓度为0.05%,室温放置1 h或能够生成5%氧化干扰素的时间。每1 mL溶液中加入L-甲硫氨酸12.5 mg,室温放置1 h,在2~8 ℃储存不超过24 h。
1.3 分析方法 1.3.1 色谱系统色谱柱:Agilent Zorbax 300SB-C18(4.6 mm×250 mm,5 μm);流速1.0 mL·min-1;柱温:室温,进样体积:50 μL;检测波长:210 nm。流动相:流动相A为0.2%三氟醋酸+30%乙腈溶液,流动相B为0.2%三氟醋酸+80%乙腈溶液。线性洗脱梯度程序:0 min,28%B;1 min,28%B;5 min,33%B;20 min,37%B;30 min,43%B;40 min,60%B;42 min,60%B;50 min;28%B。供试品溶液和参比溶液各进样1次。采集60 min数据,并处理色谱信息,打印报告。
1.3.2 判定标准供试品图谱中干扰素α-2的保留时间约20 min;参比溶液图谱中氧化干扰素α-2的保留时间为主峰的0.9倍,氧化干扰素α-2与主峰的分离度应不小于1.0。按面积归一化法计算,在主峰保留时间的0.7至1.4之间积分,供试品单个相关蛋白洗脱峰积分面积应不高于总积分面积的3.0%,总的相关蛋白洗脱峰积分面积应不高于总积分面积的5.0%。
2 结果与讨论 2.1 参比品溶液的分析结果在对参比品溶液的分析中,干扰素α-2的保留时间为20.7 min,参比溶液图谱中氧化干扰素α-2的保留时间为主峰的0.9倍,干扰素峰和氧化干扰素峰的分辨率为2.4,系统适用性符合要求(见图 1)。
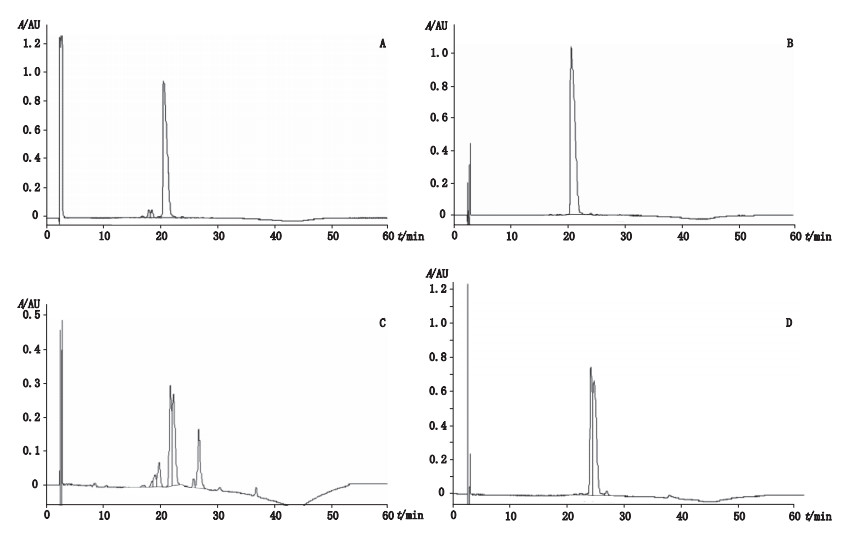
|
A.参比溶液(D企业)(reference solution,manufacturer D)B. A企业(manufacturer A)C. E企业(manufacturer E)D. G企业(manufacturer G) 图 1 重组人干扰素α-2b产品色谱图 Figure 1 HPLC chromatograms of interferon-α-2b produced |
对7家企业生产的20批重组人干扰素α-2原液进行制品相关蛋白的含量分析,结果见表 1。经过检测分析,其中A、B、C、D和G 5家企业的16批产品符合规定,E和F 2家企业的4批产品不符合规定。20批产品的制品相关蛋白总含量最低为0.9%,最高为58.2%,不同企业产品的制品相关蛋白含量存在较大的差异。得到含量大于3.0%的相关蛋白峰的数量最高为5个,含量大于3.0%的单个相关蛋白峰的含量最高为19.9%。从结果看,本次检测A企业的产品相关蛋白含量最低(典型色谱图见图 1-B),E企业的制品相关蛋白含量最高(典型色谱图见图 1-C),7家企业的制品相关蛋白符合要求的为5家,不符合要求的为2家,同一厂家不同批次产品的结果较为相似。对于不符合要求的产品,其制品相关蛋白产生的具体原因有待各厂家予以分析调查,并可能需要改进生产工艺,以提高产品的质量。另外,需要指出的是,D、E、F和G 4家企业的产品在干扰素α-2主峰后紧随有较大的未得到有效分离的肩峰,特别是E、F和G 3家企业的产品,该峰的高度几乎与主峰接近(见图 1-C、D)。参考以往的研究[5-6],该峰很有可能是N端甲硫氨酸化的干扰素α-2,而在本次检测中未把该峰作为相关蛋白计算,这有待以后采用质谱分析等手段予以证明。
|
|
表 1 EP方法测定20批重组人干扰素α-2原液相关蛋白含量的结果 Table 1 Results of related protein content from 20 batches rhIFNα-2b bulk substances analyzed by the EP method |
采用EP的标准和方法对7家企业生产的20批重组人干扰素α-2原液进行制品相关蛋白含量的分析,其中2家企业的产品不符合规定,且相关蛋白含量严重超标。从本次调查性检测的结果看,一方面部分企业产品的质量离国际药品标准的要求还有较大差距,另一方面也有多家企业的产品达到相关质量要求来满足市场需求,目前已具备提高药典标准、淘汰质量较差产品的条件。因此,为了提高干扰素产品的质量使其达到国际标准,建议在下一版《中国药典》的重组人干扰素α-2原液质量标准中,增加制品相关蛋白含量检测项目。
| [1] |
GEORGE PM, BADIGER R, ALAZAWI W, et al. Mitchell, pharmacology and therapeutic potential of interferons[J]. Pharmacol Ther, 2012, 135(1): 44. DOI:10.1016/j.pharmthera.2012.03.006 |
| [2] |
王军志. 生物技术药物研究开发和质量控制[M]. 第三版. 北京: 科学出版社, 2018: 467. WANG JZ. Research, Development and Quality Control of Biopharmaceuticals[M]. 3th ed. Beijing: Science Publishers, 2018: 467. |
| [3] |
PLATANIAS LC. Interferons and their antitumor properties[J]. Interferon Cytokine Res, 2013, 33(4): 143. DOI:10.1089/jir.2013.0019 |
| [4] |
LAROCQUE L, BLIU A, XU R, et al. Bioactivity determination of native and variant forms of therapeutic interferons[J]. J Biomed Biotechnol, 2011, 2011: 174615. |
| [5] |
LI Y, RAO C, TAO L, et al. Improved detection of variants in recombinant human interferon alpha-2a products by reverse-phase high-performance liquid chromatography on a core-shell stationary phase[J]. J Pharm Biomed Anal, 2013, 88C: 123. |
| [6] |
李永红, 韩春梅, 裴德宁, 等. 2种重组人干扰素α-2b相关蛋白分析方法的应用比较[J]. 药物分析杂志, 2014, 34(7): 1204. LI YH, HAN CM, PEI DN, et al. Comparison of two methods in analyzing recombinant human interferon α-2b related proteins[J]. Chin J Pharm Anal, 2014, 34(7): 1204. |
| [7] |
JENKINS N, MURPHY L, TYTHER R. Post-translational modifications of recombinant proteins:significance for biopharmaceuticals[J]. Mol Biotechnol, 2008, 39(2): 113. DOI:10.1007/s12033-008-9049-4 |
| [8] |
JENKINS N. Modifications of therapeutic proteins:challenges and prospects[J]. Cytotechnology, 2007, 53(1-3): 121. DOI:10.1007/s10616-007-9075-2 |
| [9] |
SINGH SK. Impact of product-related factors on immunogenicity of biotherapeutics[J]. J Pharm Sci, 2011, 100(2): 354. DOI:10.1002/jps.22276 |
| [10] |
AHRER K, JUNGBAUER A. Chromatographic and electrophoretic characterization of protein variants[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2006, 841(1-2): 110. DOI:10.1016/j.jchromb.2006.05.044 |
| [11] |
BRACEWELL DG, SMALES CM. The challenges of product- and process-related impurities to an evolving biopharmaceutical industry[J]. Bioanalysis, 2013, 5(2): 123. DOI:10.4155/bio.12.314 |
| [12] |
ALDINI G. Advanced analytical strategies for recombinant therapeutic proteins[J]. Curr Pharm Biotechnol, 2011, 12(10): 1507. DOI:10.2174/138920111798357366 |
| [13] |
DUVAL E, BROLY H, GLEIXNER R. Quality attributes of recombinant therapeutic proteins:an assessment of impact on safety and efficacy as part of a quality by design development approach[J]. Biotechnol Prog, 2012, 28(3): 608. DOI:10.1002/btpr.1548 |
| [14] |
EP.9.5[S].2016: 2780
|
| [15] |
MARK JK, DIONNE S, CYR TD, et al. Utility of standard pharmacopeial and nonpharmacopeial methods in distinguishing folded, unfolded, and process variant forms of interferon α-2[J]. J Pharm Sci, 2012, 101(10): 3672. DOI:10.1002/jps.23276 |
| [16] |
中华人民共和国药典2015年版.三部[S]: 2015: 297 ChP 2015.Vol Ⅲ[S]: 2015: 297 |
 2018, Vol. 38
2018, Vol. 38 
