从1992年第1个重组药物—基因工程干扰素α1b上市以来,我国重组药物行业已经历了20多年的发展。在此期间,新技术、新方法、新品种不断涌现,相应的质控技术也得到较大提高。1995年,仅有2个重组药物的制造及检定规程纳入《中国生物制品规程》,至2015年版《中华人民共和国药典》(简称《中国药典》)三部,已有38种重组蛋白药物被纳入各论,这些质量标准和检定方法在保证我国重组药物的安全、有效和质量可控方面发挥了重要作用[1]。
随着我国建设世界科技强国战略部署的开展,加快提升我国药品质量,使之与国际接轨,更好地保障公众用药安全的要求日趋迫切。与化学药物相比,重组蛋白药物结构复杂,稳定性相对较差,生产工艺需要严格控制,对其进行质量控制也更具挑战性,尤其是在制品相关蛋白的分析鉴定以及质量控制方面。为此,国家药典委员会专门启动“重组细胞因子类制品质量标准提高研究”课题,对制品相关蛋白进行初步研究,旨在提高细胞因子类的质量标准,逐步与国际标准接轨,此举不仅有利于提高国产制品的质量,更为国产制品走出国门,参与国际市场竞争提供便利。在此背景下,本文对制品相关蛋白的技术问题进行了回顾。
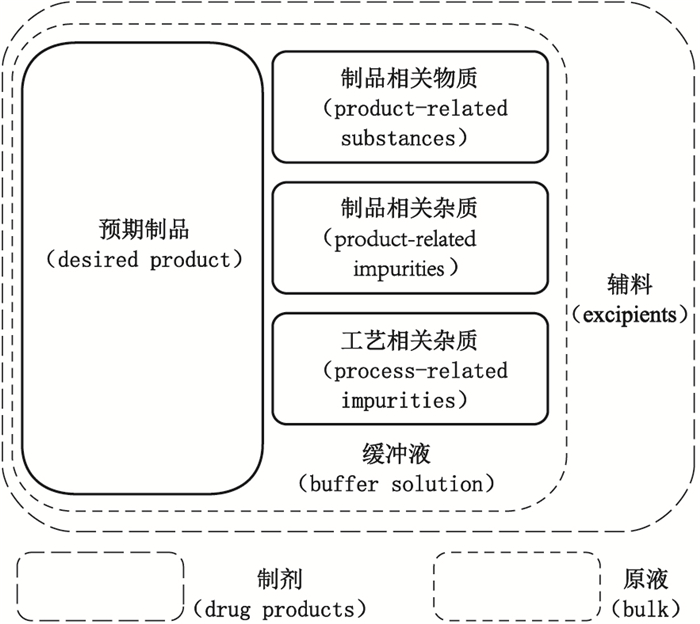
1 制品相关蛋白的概念重组蛋白药物生产工艺复杂,产品稳定性相对较差,因此其制剂的组成也相对复杂(见图 1)。参考人用药品注册技术要求国际协调会(ICH)的指导原则Q6B及2015年版《中国药典》三部,本文首先对重组蛋白药物的部分相关概念进行阐述。
|
图 1 重组蛋白药物制剂组成示意图 Figure 1 The schematic diagram of the composition of recombinant protein products |
重组蛋白药物的制剂是包含预期制品及辅料的一种药品类型,其中辅料是指有意加入的,在使用时不应有药理作用的成分。重组蛋白药物常用的辅料包括甘露醇、海藻糖、白蛋白等。制剂经分装(或冻干),以适宜方式封闭于最终容器中,再经目检、贴签、包装后即为成品。由于有些辅料会对特定检测方法产生干扰,导致相关检测项目不能在成品中测定,故必须在原液中检定。
原液是指与辅料配制成制剂的物质,它由预期制品、制品相关物质、制品相关杂质及工艺相关杂质组成。其中预期制品是指具有期望结构的蛋白质,或是来源于所期望的DNA序列并通过预期的翻译后修饰及下游修饰产生的有活性的蛋白分子。需要注意的是,由于重组蛋白通过工程菌或工程细胞表达生产,有些制品本身就是目标蛋白发生不同的翻译后修饰而形成的混合物。这些修饰往往是可以预见的(如糖基化),修饰后的蛋白可能具有同样的生物学活性,并且修饰本身也许不会影响蛋白制品的安全性和有效性,这些翻译后修饰产物被作为预期制品的一部分。
制品相关杂质是指预期制品的分子变异体(如:前体,某些在生产和/或贮藏中出现的分解产物等),它们在活性、有效性和安全性方面与预期制品不同;制品相关物质是指在生产和/或贮藏中形成的预期产品的分子变异体,它们具有一定活性且对制剂的安全性和有效性无有害影响。制品相关杂质和相关物质的区别主要在于它们与预期制品是否具有类似的属性,包括活性、有效性及安全性,当它们的属性与预期制品一致时,被认为是制品相关物质,反之则被认为是制品相关杂质。两者均源于生物技术制品的异质性和降解产物,本质上均属于蛋白质,因此本文统称为制品相关蛋白。
工艺相关杂质是指从生产过程中产生的杂质,可能来源于细胞基质(如宿主细胞蛋白、宿主细胞DNA)、细胞培养物(如诱导剂、抗生素或培养基成分)或下游工艺(如处理试剂或柱子滤出物)。该类杂质不在本文讨论范围之内。
2 国内外对制品相关蛋白的技术法规要求 2.1 人用药品注册技术要求国际协调会(ICH)ICH的指导原则Q6B中要求:在产品的开发阶段,需要对其进行详尽的鉴定工作并制定适宜的质量标准。产品的工艺如有明显改变,必要时也需对产品进行详细鉴定,鉴定的内容包括产品的异质性、纯度及杂质等。
异质性:生产者应详细说明目标产品异质性的类型,并证明临床前与临床研究所用批次的一致性。如果已证明每批产品异质性的类型是固定的,就不必对异质混合体中每一种形式的活性、有效性和安全性(包括免疫原性)再作评价。原液和制剂在生产和/或贮存过程中也会产生异质性,产品的异质性与质量有关,因此应鉴定其异质程度和概况,以确保批间一致性。当工艺改变或产品降解而导致异质体类型与临床前和临床开发所用产品不一致时,应对这些改变的影响作出评价。
纯度:测定绝对纯度和相对纯度对于分析方法具有一定的挑战性,其结果与所用方法密切相关。因此,原液和制剂的纯度一般是用几种方法合并估计。原液分析方法的选择和优化主要考虑预期制品与制品相关物质及制品相关杂质的分离;成品分析方法除考虑以上因素外,还应考虑预期制品与辅料的分离。对制品相关物质应酌情制订单独的和/或总体的认可标准。对于批放行检验可选择部分合适的方法测定纯度并进行验证。
杂质:除了对原液和制剂的纯度进行评估外,生产者还应对可能出现的杂质作出评估。杂质可能与工艺有关,亦可能与产品有关;杂质的结构有的已知,有的部分阐明,有的是未知的。如果杂质有一定的数量,应尽可能予以鉴别,有可能的话还应评估其生物活性。对制品相关杂质应酌情制订单独的和/或总体的认可标准,认可标准要根据临床前和临床研究批次的数据及生产一致性批次的数据而定。对于制剂的杂质控制,如果杂质在质和量上(即相对含量和/或浓度)与原液一致,则不必再进行检测。如杂质是在制剂生产过程和/或储存过程中产生的,应根据以往批次的杂质含量检测结果,制定制剂中杂质含量的认可标准,以评价制剂在生产和/或存储过程中原料药的变化。
2.2 世界卫生组织(WHO)WHO的指南《Guidelines on the Quality,Safety,and Efficacy of Biological Medicinal Products Prepared by Recombinant DNA Technology》包括生产与质控、非临床评价、临床评价3个方面,其中生产与质控方面对制品相关蛋白的要求与ICH的指导原则Q6B基本一致。
该指南认为,在产品研发阶段对重组蛋白药物进行严格的鉴定是必须的,通过鉴定可以获得产品的理化特性、生物学活性、免疫化学特性、纯度及杂质等信息。特别是应该采用多种分析手段获取蛋白分子的各种理化特性,如相对分子质量、电荷状态、等电点、氨基酸组成、疏水性质等。对产品的翻译后修饰(如糖基化)、立体构像及聚集状态也应进行充分的鉴定和分析,因为有些重组蛋白药物的糖基化修饰类型可能与天然的蛋白分子不一致,进而可能对重组蛋白药物的生物学、药理学及免疫学特性产生影响。以上研究内容其实为后续相关蛋白的质量控制奠定了基础。
具体到纯度及杂质的鉴定方面,该指南认为生物技术产品通常存在不同原因导致的异质性(如C-末端加工、N-末端焦谷氨酸化、脱氨基、氧化、异构化、片段化、二硫键错配、N-糖基或O-糖基化、糖化、聚集),应当结合不同的分析方法对其纯度和杂质进行评估,并应针对相应的制品相关蛋白设定单独的和/或总体的认可标准。这些方法通常包括理化性质的测定,如相对分子质量大小、异构体类型、疏水性分析、电泳图谱、色谱数据(如肽图)、一级结构修饰方式等。蛋白聚集体也应采用多种方法进行适当鉴定,除非有其他理由,蛋白聚集体、不溶性微粒及可见异物的形成均应在产品放行及稳定性评价时进行研究并密切关注。
在纯度及杂质的常规质控方面,该指南建议:鉴于重组蛋白药物纯度及杂质的复杂性,应结合基于不同分离机制的方法进行分析评价,并应针对相应的制品相关蛋白设定单独的和/或总体的认可标准。能用于检测产品的片段化、解离及聚合的色谱和/或电泳方法应被纳入,并酌情设定含量限度。考虑到糖基化和聚乙二醇化修饰能影响制品的药代动力学性质及免疫原性,应考虑为这些属性设定合适的接受标准。
2.3 欧洲药典欧洲药典在重组DNA技术产品的通则中仅列出了研发和生产重组DNA技术产品的一般要求。比如在预期制品的鉴定部分:通过一系列化学、物理、免疫化学及生物学的测定,初步完成原液的特性、纯度、效价及稳定性分析。在化学纯度部分:通过合适的方法,如液相色谱、毛细管电泳或十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),对蛋白制品的纯度进行分析,并与参比制剂进行对比。涉及具体产品的鉴定、分析和测试的内容均放在相应制品的各论中进行阐述,以下列举2个例子:
干扰素α2浓缩液:该各论中涉及制品相关蛋白的检测项目有2个:相对分子质量与干扰素α2不同的杂质的检测、相关蛋白检测。前者采用SDS-PAGE(还原及非还原)的方法,后者采用反相高效液相色谱的方法,2种方法均列出了详细的操作步骤,均使用参比溶液,均设定了系统适用性标准及质量标准。
干扰素γ-1b浓缩液:该各论中涉及制品相关蛋白的检测项目有4个:共价结合的二聚体及寡聚体,采用分子排阻色谱法测定;单体及聚合体,采用分子排阻法测定;脱氨基、氧化形式及异二聚体,采用离子交换色谱法测定;相对分子质量与干扰素γ-1b不同的杂质,采用SDS-PAGE(还原及非还原)法测定。各方法同样列出了详细的操作步骤,均使用参比溶液,均设定了系统适应性标准及质量标准。
2.4 《中国药典》2015年版《中国药典》三部的“人用重组DNA蛋白制品总论”中规定:制品质量控制包括采用参比品和经验证的方法评估已知和(或)潜在制品相关物质和工艺相关物质,以及采用适宜的方法对制品鉴别、生物学活性、纯度和杂质等检测进行分析。其他有关制品的特性分析、异质性、翻译后修饰、制品相关物质/杂质的规定与ICH指导原则及WHO指南基本一致,不再赘述。
在制品的各论部分,目前还未纳入具体的相关蛋白的检测项目,但是涉及纯度的检测有以下几种:非还原SDS-PAGE、分子排阻高效液相色谱法、反相高效液相色谱法等,可以通过对产品纯度的控制,对相关蛋白进行限定。
3 制品相关蛋白的产生及其对产品质量的影响制品相关蛋白的产生主要有2种方式:蛋白分子发生聚集或断裂和部分氨基酸发生化学修饰,其中氨基酸修饰的种类很多,包括氧化、脱氨基、糖化、乙酰化等。
3.1 蛋白聚集聚集是重组蛋白药物比较常见的一种现象[2-3],聚集的发生不仅会降低药物的产量,还会给下游的纯化工艺造成很大的压力[4],更重要的是,聚集还会增强重组药物的免疫原性,对其安全性和有效性产生不利的影响[5-8]。
蛋白聚集的原因非常复杂,主要包括:蛋白本身的理化特性;蛋白溶液的pH、盐浓度与种类等[9];外部因素的刺激,如机械应力[10]、光照[11]、冷冻干燥[12]、氧化环境[13]、气-液界面及固-液界面的相互作用[14-15]。蛋白的聚集方式涉及可逆的或不可逆的反应,非共价相互作用(如疏水相互作用)或共价相互作用(如链间二硫键的形成),可溶性的聚集或不溶性的聚集,空间结构改变形成的聚集或空间结构不变形成的聚集[16]等等。
治疗性重组蛋白聚集后如果激发免疫系统,一方面会导致抗药抗体的出现,使药物的疗效丧失,另一方面还可能通过抗体的交叉反应,中和内源性的功能蛋白,产生严重的副作用;更有甚者,还会引发急性超敏反应,造成更加严重的后果。聚集体免疫原性的高低主要跟2个因素相关:相对分子质量和溶解性。一般认为,相对分子质量大于10万的高聚体以及不溶性的蛋白聚合物更容易激发免疫系统[17]。另外,蛋白的来源及临床治疗方式也会对聚集体的免疫原性产生影响,如鼠源单抗比人源单抗的免疫原性要强,注射方式、剂量及频率、病人本身的遗传背景及免疫状态、免疫调节剂等因素也会对聚集体的免疫原性产生影响[18]。
由于蛋白聚集对重组药物的不利影响,人们采取各种措施避免蛋白聚集体的形成[19-20]。其中最主要的方式是在纯化及制剂过程中,往蛋白溶液中添加“蛋白聚集抑制剂”,也称为助溶剂或辅料[21-22]。辅料构成的溶液环境对蛋白质的稳定至关重要,比如pH的变化可影响蛋白的疏水性、电荷类型和溶解性;不同种类的盐离子可以影响蛋白的疏水性,从而影响其稳定性;盐浓度也是蛋白溶液稳定与否的重要因素,高浓度的盐可导致蛋白沉淀;表面活性剂也是一类常用的辅料,可以降低蛋白在气液界面的吸附而降低聚集[23],精氨酸、赖氨酸等也可达到类似效果[24];糖类辅料如甘露糖和葡萄糖可用于增强蛋白冻干时的稳定性[25];还有研究者通过高通量扫描技术评价辅料对抑制蛋白聚集的作用[26]。
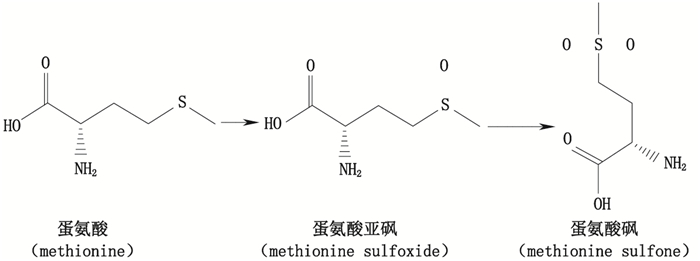
3.2 氧化氧化产物是一种非常重要的制品相关蛋白,由于其对重组蛋白免疫原性及生物学活性的潜在影响[27-29],在产品质控方面需要密切关注。容易发生氧化的氨基酸主要是蛋氨酸和半胱氨酸,人体内的蛋白质也会被活性氧(ROS)氧化,但是由于蛋氨酸亚砜还原酶的存在,蛋氨酸的氧化反应是可逆的[30]。在重组蛋白药物的生产过程中,将工程细胞从含血清培养基转换为无血清培养基时,最容易发生蛋氨酸的氧化[31]。蛋氨酸氧化可转变为蛋氨酸亚砜甚至蛋氨酸砜(见图 2)。
|
图 2 蛋氨酸氧化过程示意图 Figure 2 The schematic diagram of methionine oxidation process |
重组药物中蛋氨酸的氧化会对蛋白的结构和功能产生一定的影响,进而影响药物的安全性和有效性。研究发现,重组人IgG2抗体的重链第252位和428位蛋氨酸发生氧化后,其与蛋白A和FcRn的亲和力会减弱[32];重组人IgG1抗体的重链第256位和432位蛋氨酸发生氧化后,不仅造成其与蛋白A、蛋白G、FcRn及Fc γ受体的亲和力均减弱[33-35],还会明显缩短其血清半衰期[36];干扰素α2b的111位蛋氨酸发生氧化后会改变其二级结构,但对生物学活性没有影响[37],也有研究表明蛋氨酸氧化会导致干扰素热稳定性下降[38];重组人生长因子的第14位和125位蛋氨酸氧化后,虽然对其空间构象没有影响,但是会降低其热稳定性,并促进蛋白的聚集[39-40]。
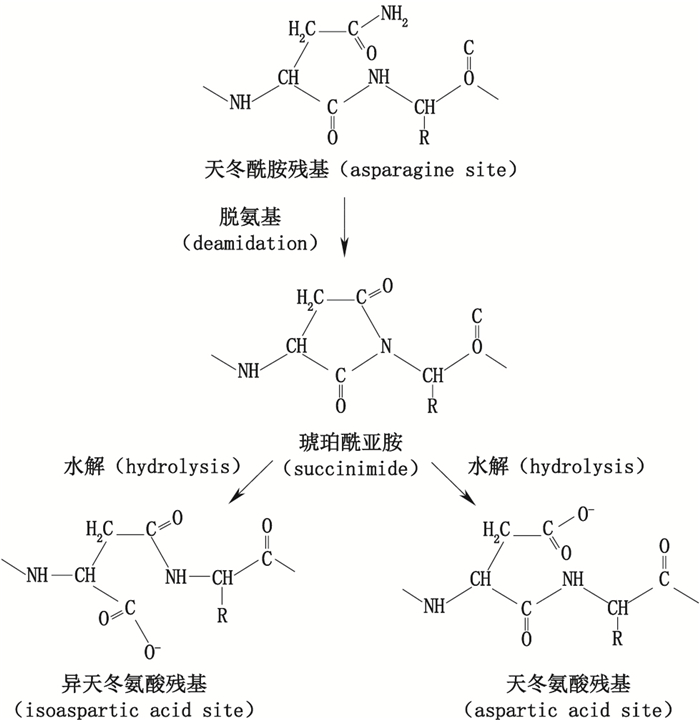
3.3 脱氨基脱氨基是重组蛋白药物在长期存放过程中常见的现象,脱氨基现象涉及的氨基酸包括天冬酰胺和谷氨酰胺。天冬酰胺脱氨基时,先形成中间体琥珀酰亚胺,琥珀酰亚胺中间体再水解成天冬氨酸或异天冬氨酸(见图 3),两者的比例大约为1:3[41-42]。由于异天冬氨酸不是天然的氨基酸,因此具有潜在的免疫原性。谷氨酰胺也能发生脱氨基现象,但它脱氨基的速率不及天冬酰胺的1%,在重组蛋白药物中很难检测到[43]。
|
图 3 天冬酰胺脱氨基示意图 Figure 3 The schematic diagram of asparagine deamination |
脱氨基的速率与蛋白的一级结构、高级结构以及溶液的性质(如pH、温度、离子强度及缓冲离子类型)相关。研究表明,当天冬酰胺的C-端氨基酸为甘氨酸、丝氨酸或组氨酸时,更易脱氨基形成琥珀酰亚胺[44],天冬酰胺N-端的氨基酸对其脱氨基没有明显的影响[45]。二级结构也对天冬酰胺残基稳定性有一定的影响,研究表明天冬酰胺的脱氨基现象仅在非α螺旋区域发生[46],β转角及蛋白疏水区形成的构象约束在一定程度上能抑制琥珀酰亚胺的形成[47]。碱性条件及温度的升高则能促进脱氨基反应的发生[48],溶液中添加甲醇以及降低溶液介电强度均能减缓脱氨基反应的速率[49-50]。
脱氨基能导致蛋白变异体的形成,可进一步影响蛋白药物的安全性、有效性及批间一致性。对于重组单克隆抗体来说,脱氨基有可能造成效价的下降、半衰期的缩短以及免疫原性的增加[51-52]。比如,重组IgG1型单抗中重链的互补决定区含有几个容易发生脱氨基的“热点”,而互补决定区介导抗体与抗原的特异结合,如果结构发生变化,将造成抗体效价的降低[53-54];也有研究发现,脱氨基能增强干扰素β-1a的生物学活性[55];还有研究显示脱氨基的发生会影响局部的氢键网络,并进一步改变蛋白的空间结构[56]。
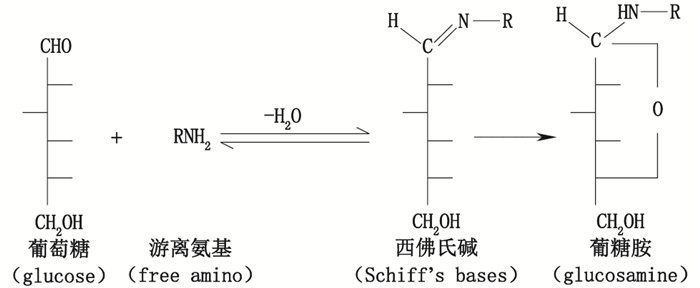
3.4 糖化糖化也是一种在重组蛋白药物中比较常见的修饰,它与糖基化不同,不需要蛋白酶的参与[57-58]。糖化的发生主要是由于蛋白质暴露于还原性的单糖中造成的,如葡萄糖、果糖等。葡萄糖的醛基可以与蛋白中的游离氨基(如N-末端氨基及侧链氨基)反应形成西佛氏碱,西佛氏碱作为该反应的中间体是不稳定的,它会迅速地通过Amadori重排转变为更加稳定的葡糖胺加成物(见图 4),整个反应过程也称为Maillard反应[59-60]。
|
图 4 蛋白中游离氨基糖化反应示意图 Figure 4 The schematic diagram of free aminoglycation reaction in protein |
重组蛋白药物在生产和贮存过程中很容易接触葡萄糖,葡萄糖作为培养基质的主要碳源和能量来源,在整个培养过程中均保持较高的浓度;另外,重组蛋白辅料中的蔗糖和海藻糖,也会降解生成葡萄糖,因此,重组蛋白药物发生糖化的可能性很高。赖氨酸侧链氨基发生糖化的敏感程度主要取决于其空间易接近性及其附近的化学环境,前者与蛋白的立体结构有关,后者则主要由蛋白的一级结构和二级结构决定[61]。
重组蛋白药物发生糖化后会影响其电荷分布及稳定性,有时还可能影响其生物学活性。有研究通过加速试验证实,某单抗制剂由于辅料中存在蔗糖,蔗糖在加速条件下水解为葡萄糖并造成单抗发生糖化,而糖化后的单抗聚集速度明显加快[62];单抗的糖化还会造成其抗原结合能力的下降[63]。糖尿病病人由于血糖水平较高,容易造成体内正常蛋白发生糖化,当胰岛素受体糖化后,可以抑制其与胰岛素的结合,造成胰岛素抵抗[64];当人血白蛋白糖化后,可以造成其部分三维结构发生变化,影响其与锌离子的相互作用,使锌的体内分布紊乱并进一步造成锌缺乏症[65]。
3.5 其他原因除以上常见原因外,还有一些因素可能导致制品相关蛋白的出现,比如肽键的断裂、N-末端封闭、C-末端赖氨酸的截除、二硫键错配、N-末端蛋氨酸的保留、N-末端乙酰化等等,有可能对蛋白的结构和功能产生不同的影响。
肽键的断裂常见于单抗制品的铰链区,可通过直接水解或β消除作用产生,前者在酸性或碱性环境时容易发生,后者在碱性环境时容易发生[66]。N-末端封闭及C-末端赖氨酸的截除也常见于单抗制品,前者在抗体的整个生命周期都可能形成,形成速度受pH的影响,中性条件下形成速度最慢,目前未发现N-端封闭对抗体活性的影响[67];C-末端赖氨酸的截除会引起抗体的电荷异质性,但对抗体的安全性和有效性没有影响[68]。
二硫键错配常见于通过包涵体方式表达后复性所得的重组蛋白制品,比如干扰素,正确二硫键的形成对干扰素生物学活性的发挥至关重要[69-71];关于N-末端蛋氨酸保留,原核细胞表达的蛋白一般会在后期加工修饰时将N-末端蛋氨酸切除,如未切除干净则会在制品中存在N-末端蛋氨酸保留现象,2015年版《中国药典》三部部分产品各论中允许N-末端蛋氨酸的存在;N-末端乙酰化在原核表达的蛋白中有被发现[72-73],有研究显示,干扰素α2b发生N-末端乙酰化后,生物学活性明显降低[74]。
4 制品相关蛋白分析方法举例制品相关蛋白的分析检测涉及2个关键的步骤:预期制品与制品相关蛋白的有效分离及制品相关蛋白的鉴定。分离可采用SDS-PAGE、毛细管电泳、高效液相色谱等方法,可以根据相关蛋白与预期蛋白制品在理化性质方面的差异选择合适的分离方法。有些氨基酸修饰对蛋白整体性质影响较小,很难在完整蛋白水平进行分离,可考虑在肽段水平进行分离定量。分离开的相关蛋白可通过相对分子质量的测定(如电泳、分子排阻色谱、多角度激光散射、质谱等)以及免疫化学方法(如免疫印迹)进行鉴定。下面列举几个对制品相关蛋白进行分析质控的实例。
4.1 蛋白聚集体的检测蛋白聚集体是指非预期的蛋白聚集产物,包括可溶性的聚集物以及不溶性微粒和可见异物[75],本部分重点介绍可溶性聚集物的检测。蛋白聚集物的分离主要依据其与预期蛋白相对分子质量的差别,方法包括变性及非变性分子排阻色谱、变性及非变性电泳(包括毛细管电泳),通过蛋白的保留时间、迁移率以及多角度激光散射、质谱等检测器所测得的相对分子质量可以快速地对蛋白聚集物进行鉴定[76]。分子排阻色谱是最常见的分析蛋白聚集物的方法,但是该法一个比较明显的缺点是填料对蛋白有吸附作用,导致实测聚集物的比例偏低,测定前需要对色谱柱进行充分的平衡[77-78]。有研究表明,流动相中添加精氨酸有助于降低蛋白的吸附,使测定结果更加准确[79-80]。电泳也是分析蛋白聚集物最常用的方法,有研究者通过电泳的方法分析了不同辅料对重组人干扰素α2b聚集速度的影响,结果表明:与磷酸钠缓冲液相比,柠檬酸钠缓冲液能抑制其聚集;EDTA比聚山梨酯能更有效地抑制聚集;铜离子、锌离子等金属离子则能促进聚集[81]。
4.2 毛细管区带电泳分析粒细胞集落刺激因子(G-CSF)的制品相关蛋白[82]毛细管区带电泳基于组分质荷比的差异将其分离,是毛细管电泳中最基本、应用最广泛的一种分离模式。该方法采用直径50 μm、长80.5 cm的石英毛细管柱;背景电解质为100 mmol·L-1的磷酸溶液(三乙醇胺调节pH至7.0);电压20 kV;温度25 ℃;检测波长200 nm。该方法可将G-CSF与6种制品相关蛋白(A~F)分离(见图 5)。研究者对该方法进行了验证,包括特异性(对相关蛋白谱敏感且能定量监测)、精密度(重复性及实验室间精密度)、稳定性(51 h内重复进样,检测结果一致)、耐用性(背景电解质浓度、温度、电压及检测波长的细微改变不影响检测结果)、线性范围(在蛋白浓度6~600 μg·mL-1范围内线性良好)、检测下限(LOD,0.6 μg·mL-1)以及定量下限(LOQ,2.0 μg·mL-1)。验证结果表明,该方法可用于G-CSF制品的相关蛋白分析。
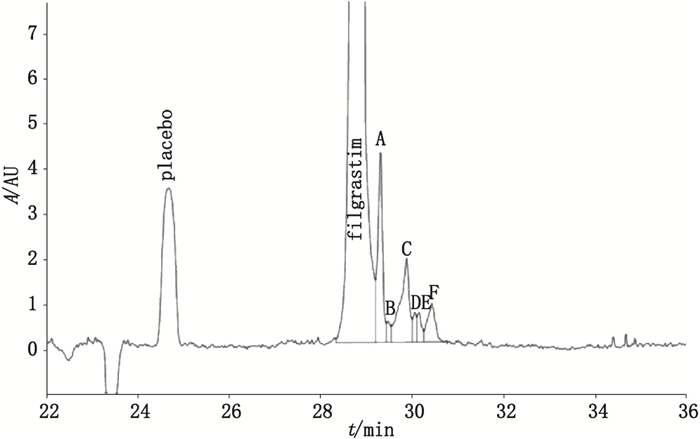
|
图 5 毛细管区带电泳分析G-CSF相关蛋白 Figure 5 Analysis of G-CSF related proteins by capillary zone electrophoresis |
检测G-CSF氧化型相关蛋白的方法主要分2种:肽段水平检测及完整蛋白水平检测。肽段水平检测的常规策略是首先将分析蛋白酶解成肽段,液相色谱分离氧化及未氧化的相关肽段,再通过紫外检测或质谱检测的信号强度,对氧化及未氧化的对应肽段进行含量比较[83-84]。对肽段进行绝对定量可通过酶解前添加标记蛋白[85]或酶解后添加标记肽段[86]的方式进行,质谱相对定量则基于氧化后的肽段与未氧化的肽段具有相同的离子化效率[87]。肽段水平的检测方法有2个缺点:一是仅能测定特定位点的修饰比例,不能分析多个位点的氧化变异体并进行定量;二是酶解过程可能引入新的修饰,使测定结果不准确[88]。有研究者通过用含18O的双氧水对样品进行充分氧化,避免了前处理引起的人为修饰,并能通过相对分子质量的差异区分样品中已有的修饰[89]。完整蛋白水平的检测可同时避免以上2个问题,但要对分离方法进行优化,使氧化产物能与预期制品有效分离,对分离开的氧化产物进行鉴定也具有一定的挑战性[90-91]。
4.4 通过共反应产物测定异天冬氨酸含量异天冬氨酸是天冬酰胺脱氨基或天冬氨酸分子重排的产物。当蛋白相对分子质量大且修饰复杂时(如单抗、Fc融合蛋白等),将该类相关蛋白与预期制品分离有一定的难度,这种情况下可考虑采用测定共反应产物的方法[92]。该方法的试剂盒中提供有蛋白L-异天门冬氨酰甲基转移酶(PIMT)及S-腺苷-L-甲硫氨酸(SAM),前者可将后者的甲基转移至蛋白样品中的异天冬氨酸上,并生成产物S-腺苷同型半胱氨酸(SAH),SAH相对分子质量小,可以很容易地通过反相高效液相色谱的方法进行分离定量,通过测定共反应产物SAH的量可以计算样品中异天冬氨酸的含量。
4.5 反相高效液相色谱分析重组人干扰素α2相关蛋白欧洲药典收录的方法即反相高效液相色谱法,采用250 mm×4.6 mm的C18色谱柱,以0.2%三氟乙酸-30%乙腈溶液和0.2%三氟乙酸-80%乙腈溶液分别作为A、B流动相,通过改变流动相中乙腈的比例将蛋白样品洗脱,同时将预期制品与氧化型干扰素分离。该方法下氧化性干扰素的保留时间约为主峰保留时间的0.9;方法的系统适用性标准是氧化型干扰素与干扰素的分离度不小于1.0;样品的可接受标准为任意相关蛋白峰的峰面积百分比不超过3.0%,相关蛋白的总峰面积百分比不超过5.0%。中国食品药品检定研究院与加拿大的研究者合作,对该类方法进行了优化,新建立的方法对相关蛋白的分离效果更好[93];另外,欧洲药典的方法作为常规放行方法,不能反映蛋白结构的变化,甚至一些一级结构的变化[94],所以在产品研发阶段应尽可能采用各种新方法、新技术,对产品的特性进行充分的鉴定。
5 问题与展望制品相关蛋白是在重组蛋白药物里广泛存在并应引起足够重视的一类物质,它们的存在可能与产品的安全性、有效性密切相关。随着分析检测技术的不断进步,人们对制品相关蛋白的分析和鉴定也更加充分,其中质谱技术凭借其良好的灵敏度和准确性,成为应用最广泛的相关蛋白鉴定技术。后续还应针对相关蛋白出现的原因,相关蛋白对制品安全性及有效性的影响作进一步的评估,以充分了解产品的特性,有针对性地设定合适的质量标准。另外,随着制药工业的发展,重组蛋白药物出现了一些新的药物形式和剂型,如聚乙二醇修饰蛋白、抗体偶联药物、缓释药物等,如何对这些药物中的制品相关蛋白进行界定和控制,也是值得讨论的问题。
经过20多年的发展,我国重组蛋白药物取得了巨大的成就,但在质量标准方面与世界发达国家相比,还存在一定差距,比如大多数重组蛋白药物在原液的纯度和杂质控制方面,还缺少相关蛋白的检测。其实在分析技术方面,我国与发达国家的差距并没有那么明显,如何通过分析技术的进步促进质量标准的提高,是值得思考的问题。课题“重组细胞因子类制品质量标准提高研究”的立项正是基于这一现实,集合药品监管部门及生产企业的力量,共同对重组细胞因子药物的制品相关蛋白进行分析检测,讨论制订相应的含量标准,时机成熟即可纳入新版《中国药典》,逐步提高我国重组蛋白药物的质量标准,使之与发达国家接轨,助力我国从制药大国向制药强国的转变。
| [1] |
饶春明. 我国重组药物质量控制技术体系的建立和应用研究[J]. 中国药学杂志, 2016, 51(13): 1058. RAO CM. Establishment and application of the quality control technology system for recombinant drugs in China:a review[J]. Chin Pharm J, 2016, 51(13): 1058. |
| [2] |
Wang W. Protein aggregation and its inhibition in biopharmaceutics[J]. Int J Pharm, 2005, 289(1-2): 1. DOI:10.1016/j.ijpharm.2004.11.014 |
| [3] |
Manning MC, Chou DK, Murphy BM, et al. Stability of protein pharmaceuticals:an update[J]. Pharm Res, 2010, 27(4): 544. |
| [4] |
Cromwell MEM, Hilario E, Jacobson F. Protein aggregation and bioprocessing[J]. AAPS J, 2006, 8(3): E572. DOI:10.1208/aapsj080366 |
| [5] |
Fathallah AM, Chiang M, Mishra A, et al. The effect of small oligomeric protein aggregates on the immunogenicity of intravenous and subcutaneous administered antibodies[J]. J Pharm Sci, 2015, 104(11): 3691. DOI:10.1002/jps.24592 |
| [6] |
Ahmadi M, Bryson CJ, Cloake EA, et al. Small amounts of sub-visible aggregates enhance the immunogenic potential of monoclonal antibody therapeutics[J]. Pharm Res, 2015, 32(4): 1383. |
| [7] |
Grushin K, Miller J, Dalm D, et al. Lack of recombinant factor Ⅷ B-domain induces phospholipid vesicle aggregation:implications for the immunogenicity of factor Ⅷ[J]. Haemophilia, 2014, 20(5): 723. DOI:10.1111/hae.2014.20.issue-5 |
| [8] |
Rombach-Riegraf V, Karle AC, Wolf B, et al. Aggregation of human recombinant monoclonal antibodies influences the capacity of dendritic cells to stimulate adaptive T-cell responses in vitro[J]. PLoS One, 2014, 9(1): e86322. DOI:10.1371/journal.pone.0086322 |
| [9] |
Ratanji KD, Derrick JP, Dearman RJ, et al. Immunogenicity of therapeutic proteins:influence of aggregation[J]. J Immunotoxicol, 2014, 11(2): 99. DOI:10.3109/1547691X.2013.821564 |
| [10] |
Bi V, Jawa V, Joubert MK, et al. Development of a human antibody tolerant mouse model to assess the immunogenicity risk due to aggregated biotherapeutics[J]. J Pharm Sci, 2013, 102(10): 3545. DOI:10.1002/jps.23663 |
| [11] |
Bessa J, Boeckle S, Beck H, et al. The immunogenicity of antibody aggregates in a novel transgenic mouse model[J]. Pharm Res, 2015, 32(7): 2344. DOI:10.1007/s11095-015-1627-0 |
| [12] |
Ryff JC. Clinical investigation of the immunogenicity of interferon-alpha 2a[J]. J Interferon Cytokine Res, 1997, 17(Suppl 1): S29. |
| [13] |
Torosantucci R, Sharov VS, van Beers M, et al. Identification of oxidation sites and covalent cross-links in metal catalyzed oxidized interferon Beta-1a:potential implications for protein aggregation and immunogenicity[J]. Mol Pharm, 2013, 10(6): 2311. DOI:10.1021/mp300665u |
| [14] |
Maa YF, Hsu CC. Protein denaturation by combined effect of shear and air-liquid interface[J]. Biotechnol Bioeng, 1997, 54(6): 503. DOI:10.1002/(ISSN)1097-0290 |
| [15] |
Biddlecombe JG, Smith G, Uddin S, et al. Factors influencing antibody stability at solid-liquid interfaces in a high shear environment[J]. Biotechnol Prog, 2009, 25(5): 1499. DOI:10.1002/btpr.211 |
| [16] |
Jenkins N, Murphy L, Tyther R. Post-translational modifications of recombinant proteins:significance for biopharmaceuticals[J]. Mol Biotechnol, 2008, 39(2): 113. |
| [17] |
Frei P, Benacerraf B, Thorbecke GJ. Phagocytosis of the antigen, a crucial step in the induction of the primary response[J]. Proc Natl Acad Sci USA, 1965, 53: 20. DOI:10.1073/pnas.53.1.20 |
| [18] |
Deehan M, Garces S, Kramer D, et al. Managing unwanted immunogenicity of biologicals[J]. Autoimmun Rev, 2015, 14(7): 569. DOI:10.1016/j.autrev.2015.02.007 |
| [19] |
Leader B, Baca QJ, Golan DE. Protein therapeutics:a summary and pharmacological classification[J]. Nat Rev Drug Discov, 2008, 7(1): 21. |
| [20] |
Frokjaer S, Otzen DE. Protein drug stability:a formulation challenge[J]. Nat Rev Drug Discov, 2005, 4(4): 298. DOI:10.1038/nrd1695 |
| [21] |
Mahjoubi N, Fazeli MR, Dinarvand R, et al. Preventing aggregation of recombinant interferon beta-1b in solution by additives:approach to an albumin free formulation[J]. Adv Pharm Bull, 2015, 5(4): 497. DOI:10.15171/apb.2015.068 |
| [22] |
Wang W. Instability, stabilization, and formulation of liquid protein pharmaceuticals[J]. Int J Pharm, 1999, 185(2): 129. DOI:10.1016/S0378-5173(99)00152-0 |
| [23] |
Chin J, Mustafi D, Poellmann MJ, et al. Amphiphilic copolymers reduce aggregation of unfolded lysozyme more effectively than polyethylene glycol[J]. Phys Biol, 2017, 14(1): 16003. DOI:10.1088/1478-3975/aa5788 |
| [24] |
Miyatake T, Yoshizawa S, Arakawa T, et al. Charge state of arginine as an additive on heat-induced protein aggregation[J]. Int J Biol Macromol, 2016, 87: 563. DOI:10.1016/j.ijbiomac.2016.03.015 |
| [25] |
Andya JD, Hsu CC, Shire SJ. Mechanisms of aggregate formation and carbohydrate excipient stabilization of lyophilized humanized monoclonal antibody formulations[J]. AAPS Pharm Sci, 2003, 5(2): E10. DOI:10.1208/ps050209 |
| [26] |
Dasnoy S, Dezutter N, Lemoine D, et al. High-throughput screening of excipients intended to prevent antigen aggregation at air-liquid interface[J]. Pharm Res, 2011, 28(7): 1591. DOI:10.1007/s11095-011-0393-x |
| [27] |
Silva MM, Lamarre B, Cerasoli E, et al. Physicochemical and biological assays for quality control of biopharmaceuticals:interferon alpha-2 case study[J]. Biologicals, 2008, 36(6): 383. DOI:10.1016/j.biologicals.2008.06.003 |
| [28] |
Skrlin A, Kosor Krnic E, Gosak D, et al. Correlation of liquid chromatographic and biological assay for potency assessment of filgrastim and related impurities[J]. J Pharm Biomed Anal, 2010, 53(3): 262. DOI:10.1016/j.jpba.2010.02.006 |
| [29] |
Gucinski AC, Boyne MT 2nd. Evaluation of intact mass spectrometry for the quantitative analysis of protein therapeutics[J]. Anal Chem, 2012, 84(18): 8045. DOI:10.1021/ac301949j |
| [30] |
Stadtman ER, Van Remmen H, Richardson A, et al. Methionine oxidation and aging[J]. Biochim Biophys Acta, 2005, 1703(2): 135. DOI:10.1016/j.bbapap.2004.08.010 |
| [31] |
Jenkins N. Modifications of therapeutic proteins:challenges and prospects[J]. Cytotechnology, 2007, 53(1-3): 121. DOI:10.1007/s10616-007-9075-2 |
| [32] |
Pan H, Chen K, Chu L, et al. Methionine oxidation in human IgG2 Fc decreases binding affinities to protein A and FcRn[J]. Protein Sci, 2009, 18(2): 424. DOI:10.1002/pro.v18:2 |
| [33] |
Gaza-Bulseco G, Faldu S, Hurkmans K, et al. Effect of methionine oxidation of a recombinant monoclonal antibody on the binding affinity to protein A and protein G[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2008, 870(1): 55. DOI:10.1016/j.jchromb.2008.05.045 |
| [34] |
Bertolotti-Ciarlet A, Wang W, Lownes R, et al. Impact of methionine oxidation on the binding of human IgG1 to FcRn and Fc gamma receptors[J]. Mol Immunol, 2009, 46(8-9): 1878. DOI:10.1016/j.molimm.2009.02.002 |
| [35] |
Mo J, Yan Q, So CK, et al. Understanding the impact of methionine oxidation on the biological functions of IgG1 antibodies using hydrogen/deuterium exchange mass spectrometry[J]. Anal Chem, 2016, 88(19): 9495. DOI:10.1021/acs.analchem.6b01958 |
| [36] |
Wang W, Vlasak J, Li Y, et al. Impact of methionine oxidation in human IgG1 Fc on serum half-life of monoclonal antibodies[J]. Mol Immunol, 2011, 48(6-7): 860. DOI:10.1016/j.molimm.2010.12.009 |
| [37] |
Kumar P, Batta R, Bine GL, et al. Stabilization of interferon alpha-2b in a topical cream[J]. Pharm Technol, 2009, 33(7): 80. |
| [38] |
Chou DK, Krishnamurthy R, Manning MC, et al. Effects of solution conditions on methionine oxidation in albinterferon alfa-2b and the role of oxidation in its conformation and aggregation[J]. J Pharm Sci, 2013, 102(2): 660. DOI:10.1002/jps.23401 |
| [39] |
Mulinacci F, Capelle MA, Gurny R, et al. Stability of human growth hormone:influence of methionine oxidation on thermal folding[J]. J Pharm Sci, 2011, 100(2): 451. DOI:10.1002/jps.22293 |
| [40] |
Mulinacci F, Poirier E, Capelle MA, et al. Influence of methionine oxidation on the aggregation of recombinant human growth hormone[J]. Eur J Pharm Biopharm, 2013, 85(1): 42. DOI:10.1016/j.ejpb.2013.03.015 |
| [41] |
Patel K, Borchardt RT. Chemical pathways of peptide degradation.Ⅲ.Effect of primary sequence on the pathways of deamidation of asparaginyl residues in hexapeptides[J]. Pharm Res, 1990, 7(8): 787. DOI:10.1023/A:1015999012852 |
| [42] |
Oliyai C, Borchardt RT. Chemical pathways of peptide degradation.Ⅳ.Pathways, kinetics, and mechanism of degradation of an aspartyl residue in a model hexapeptide[J]. Pharm Res, 1993, 10(1): 95. |
| [43] |
Liu H, Gaza-Bulseco G, Chumsae C. Glutamine deamidation of a recombinant monoclonal antibody[J]. Rapid Commun Mass Spectrom, 2008, 22(24): 4081. DOI:10.1002/rcm.v22:24 |
| [44] |
Robinson NE, Robinson ZW, Robinson BR, et al. Structure-dependent nonenzymatic deamidation of glutaminyl and asparaginyl pentapeptides[J]. J Pept Res, 2004, 63(5): 426. DOI:10.1111/jpp.2004.63.issue-5 |
| [45] |
Paranandi MV, Guzzetta AW, Hancock WS, et al. Deamidation and isoaspartate formation during in vitro aging of recombinant tissue plasminogen activator[J]. J Biol Chem, 1994, 269(1): 243. |
| [46] |
Kosky AA, Razzaq UO, Treuheit MJ, et al. The effects of alpha-helix on the stability of Asn residues:deamidation rates in peptides of varying helicity[J]. Protein Sci, 1999, 8(11): 2519. |
| [47] |
Wearne SJ, Creighton TE. Effect of protein conformation on rate of deamidation:ribonuclease A[J]. Proteins, 1989, 5(1): 8. |
| [48] |
Diepold K, Bomans K, Wiedmann M, et al. Simultaneous assessment of Asp isomerization and Asn deamidation in recombinant antibodies by LC-MS following incubation at elevated temperatures[J]. PLoS One, 2012, 7(1): e30295. DOI:10.1371/journal.pone.0030295 |
| [49] |
Capasso S, Mazzarella L, Zagari A. Deamidation via cyclic imide of asparaginyl peptides:dependence on salts, buffers and organic solvents[J]. Pept Res, 1991, 4(4): 234. |
| [50] |
Brennan TV, Clarke S. Spontaneous degradation of polypeptides at aspartyl and asparaginyl residues:effects of the solvent dielectric[J]. Protein Sci, 1993, 2(3): 331. |
| [51] |
Hsiao K, Alves J, Patel R, et al. A high-throughput bioluminescent assay to monitor the deamidation of asparagine and isomerization of aspartate residues in therapeutic proteins and antibodies[J]. J Pharm Sci, 2017, 106(6): 1528. DOI:10.1016/j.xphs.2017.02.022 |
| [52] |
Pace AL, Wong RL, Zhang YT, et al. Asparagine deamidation dependence on buffer type, pH, and temperature[J]. J Pharm Sci, 2013, 102(6): 1712. DOI:10.1002/jps.23529 |
| [53] |
Harris RJ, Kabakoff B, Macchi FD, et al. Identification of multiple sources of charge heterogeneity in a recombinant antibody[J]. J Chromatogr B Biomed Sci Appl, 2001, 752(2): 233. DOI:10.1016/S0378-4347(00)00548-X |
| [54] |
Yan B, Vallieree-Douglass J, Brdy L, et al. Analysis of post-translational modifications in recombinant monoclonal antibody IgG1 by reverse-phase liquid chromatography/mass spectrometry[J]. J Chromatogr A, 2007, 1164(1-2): 153. DOI:10.1016/j.chroma.2007.06.063 |
| [55] |
Mastrangeli R, Iozzino L, Lanzoni L, et al. Biological functions of interferon β-1a are enhanced by deamidation[J]. J Interferon Cytokine Res, 2016, 36(9): 534. DOI:10.1089/jir.2016.0025 |
| [56] |
Soulby AJ, Heal JW, Barrow MP, et al. Does deamidation cause protein unfolding? A top-down tandem mass spectrometry study[J]. Protein Sci, 2015, 24(5): 850. DOI:10.1002/pro.2659 |
| [57] |
Lapolla A, Tonani R, Fedele D, et al. Nonenzymatic glycation of IgG:an in vivo study[J]. Horm Metab Res, 2002, 34(5): 260. DOI:10.1055/s-2002-32140 |
| [58] |
Brancia FL, Bereszczak JZ, Lapolla A, et al. Comprehensive analysis of glycated human serum albumin tryptic peptides by off-line liquid chromatography followed by MALDI analysis on a timeof-flight/curved field reflectron tandem mass spectrometer[J]. J Mass Spectrom, 2006, 41(9): 1179. DOI:10.1002/(ISSN)1096-9888 |
| [59] |
Horvat S, Jakas A. Peptide and amino acid glycation:new insights into the Maillard reaction[J]. J Pept Sci, 2004, 10(3): 119. DOI:10.1002/(ISSN)1099-1387 |
| [60] |
Jakas A, Horvat S. Study of degradation pathways of Amadori compounds obtained by glycation of opioid pentapeptide and related smaller fragments:stability, reactions, and spectroscopic properties[J]. Biopolymers, 2003, 69(4): 421. DOI:10.1002/(ISSN)1097-0282 |
| [61] |
Gadgil HS, Bondarenko PV, Pipes G, et al. The LC/MS analysis of glycation of IgG molecules in sucrose containing formulations[J]. J Pharm Sci, 2007, 96(10): 2607. DOI:10.1002/jps.20966 |
| [62] |
Banks DD, Hambly DM, Scavezze JL, et al. The effect of sucrose hydrolysis on the stability of protein therapeutics during accelerated formulation studies[J]. J Pharm Sci, 2009, 98(12): 4501. DOI:10.1002/jps.21749 |
| [63] |
Mo J, Jin R, Yan Q, et al. Quantitative analysis of glycation and its impact on antigen binding[J]. MAbs, 2018, 10(3): 406. DOI:10.1080/19420862.2018.1438796 |
| [64] |
Rhinesmith T, Turkette T, Root-Bernstein R. Rapid non-enzymatic glycation of the insulin receptor under hyperglycemic conditions inhibits insulin binding in vitro:implications for insulin resistance[J]. Int J Mol Sci, 2017, 18(12): E2602. DOI:10.3390/ijms18122602 |
| [65] |
Iqbal S, Qais FA, Alam MM, et al. Effect of glycation on human serum albumin-zinc interaction:a biophysical study[J]. J Biol Inorg Chem, 2018, 23(3): 447. DOI:10.1007/s00775-018-1554-8 |
| [66] |
Gaza-Bulseco G, Liu H. Fragmentation of a recombinant monoclonal antibody at various pH[J]. Pharm Res, 2008, 25(8): 1881. DOI:10.1007/s11095-008-9606-3 |
| [67] |
张坤明, 潘勇兵, 张爱华. 人用重组单克隆抗体电荷异质性的研究进展[J]. 中国生物制品学杂志, 2016, 29(2): 206. ZHANG KM, PAN YB, ZHANG AH. Progress in research on charge heterogeneity of recombinant monoclonal antibodies for human use[J]. Chin J Biol, 2016, 29(2): 206. |
| [68] |
Khawli LA, Goswami S, Hutchinson R, et al. Charge variants in IgG1:isolation, characterization, in vitro binding properties and pharmacokinetics in rats[J]. MAbs, 2010, 2(6): 613. DOI:10.4161/mabs.2.6.13333 |
| [69] |
Morehead H, Johnston PD, Wetzel R. Roles of the 29-138 disulfide bond of subtype A of human alpha interferon in its antiviral activity and conformational stability[J]. Biochemistry, 1984, 23(11): 2500. DOI:10.1021/bi00306a028 |
| [70] |
Kontsek P. Human type Ⅰ interferons:structure and function[J]. Acta Virol, 1994, 38(6): 345. |
| [71] |
Liu YD, Zhang GF, Li JJ, et al. Identification of an oxidative refolding intermediate of recombinant consensus interferon from inclusion bodies and design of a two-stage strategy to promote correct disulfide-bond formation[J]. Biotechnol Appl Biochem, 2007, 48(Pt 4): 189. |
| [72] |
陶磊, 裴德宁, 韩春梅, 等. 液质联用进行干扰素理化对照品的一级结构鉴定及比对研究[J]. 药学学报, 2015, 50(1): 75. TAO L, PEI DN, HAN CM, et al. Characterization and comparison of interferon reference standards using UPLC-MS[J]. Acta Pharm Sin, 2015, 50(1): 75. DOI:10.3969/j.issn.1008-7303.2015.01.10 |
| [73] |
陶磊, 韩春梅, 饶春明, 等. 一种重组戊型肝炎疫苗抗原的一级结构分析[J]. 药物分析杂志, 2014, 34(10): 1746. TAO L, HAN CM, RAO CM, et al. Primary structure analysis of a recombinant antigen of HEV vaccine[J]. Chin Pharm J Anal, 2014, 34(10): 1746. |
| [74] |
Ahsan F, Arif A, Mahmood N, et al. Characterization and bioassay of post-translationally modified interferon α-2b expressed in Escherichia coli[J]. J Biotechnol, 2014, 184: 11. DOI:10.1016/j.jbiotec.2014.05.001 |
| [75] |
den Engelsman J, Garidel P, Smulders R, et al. Strategies for the assessment of protein aggregates in pharmaceutical biotech product development[J]. Pharm Res, 2011, 28(4): 920. DOI:10.1007/s11095-010-0297-1 |
| [76] |
Haberger M, Leiss M, Heidenreich AK, et al. Rapid characterization of biotherapeutic proteins by size-exclusion chromatography coupled to native mass spectrometry[J]. MAbs, 2016, 8(2): 331. DOI:10.1080/19420862.2015.1122150 |
| [77] |
Arakawa T, Ejima D, Li T, et al. The critical role of mobile phase composition in size exclusion chromatography of protein pharmaceuticals[J]. J Pharm Sci, 2010, 99(4): 1674. DOI:10.1002/jps.21974 |
| [78] |
Fekete S, Beck A, Veuthey JL, et al. Theory and practice of size exclusion chromatography for the analysis of protein aggregates[J]. J Pharm Biomed Anal, 2014, 101: 161. DOI:10.1016/j.jpba.2014.04.011 |
| [79] |
Yumioka R, Sato H, Tomizawa H, et al. Mobile phase containing arginine provides more reliable SEC condition for aggregation analysis[J]. J Pharm Sci, 2010, 99(2): 618. DOI:10.1002/jps.21857 |
| [80] |
Wang S, Raghani A. Arginine as an eluent for automated on-line Protein A/size exclusion chromatographic analysis of monoclonal antibody aggregates in cell culture[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2014, 945-946: 115. DOI:10.1016/j.jchromb.2013.11.027 |
| [81] |
Ruiz L, Aroche K, Reyes N. Aggregation of recombinant human interferon alpha 2b in solution:technical note[J]. AAPS Pharm Sci Tech, 2006, 7(4): 99. DOI:10.1208/pt070496 |
| [82] |
Benković G, Skrlin A, Madić T, et al. Purity assessment of recombinant human granulocyte colony-stimulating factor in finished drug product by capillary zone electrophoresis[J]. Electrophoresis, 2014, 35(18): 2608. DOI:10.1002/elps.v35.18 |
| [83] |
Zang L, Carlage T, Murphy D, et al. Residual metals cause variability in methionine oxidation measurements in protein pharmaceuticals using LC-UV/MS peptide mapping[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2012, 895-896: 71. DOI:10.1016/j.jchromb.2012.03.016 |
| [84] |
Sandra K, Vandenheede I, Sandra P. Modern chromatographic and mass spectrometric techniques for protein biopharmaceutical characterization[J]. J Chromatogr A, 2014, 1335: 81. DOI:10.1016/j.chroma.2013.11.057 |
| [85] |
Ji C, Sadagopan N, Zhang Y, et al. A universal strategy for development of a method for absolute quantification of therapeutic monoclonal antibodies in biological matrices using differential dimethyl labeling coupled with ultra performance liquid chromatography-tandem mass spectrometry[J]. Anal Chem, 2009, 81(22): 9321. DOI:10.1021/ac901800f |
| [86] |
Kirkpatrick DS, Gerber SA, Gygi SP. The absolute quantification strategy:a general procedure for the quantification of proteins and post-translational modifications[J]. Methods, 2005, 35(3): 265. DOI:10.1016/j.ymeth.2004.08.018 |
| [87] |
Houde D, Kauppinen P, Mhatre R, et al. Determination of protein oxidation by mass spectrometry and method transfer to quality control[J]. J Chromatogr A, 2006, 1123(2): 189. DOI:10.1016/j.chroma.2006.04.046 |
| [88] |
Perdivara I, Deterding LJ, Przybylski M, et al. Mass spectrometric identification of oxidative modifications of tryptophan residues in proteins:chemical artifact or post-translational modification[J]. J Am Soc Mass Spectrom, 2010, 21(7): 1114. DOI:10.1016/j.jasms.2010.02.016 |
| [89] |
Liu H, Ponniah G, Neill A, et al. Accurate determination of protein methionine oxidation by stable isotope labeling and LC-MS analysis[J]. Anal Chem, 2013, 85(24): 11705. DOI:10.1021/ac403072w |
| [90] |
Hausberger A, Lamanna WC, Hartinger M, et al. Identification of low-level product-related variants in filgrastim products presently available in highly regulated markets[J]. BioDrugs, 2016, 30(3): 233. DOI:10.1007/s40259-016-0169-2 |
| [91] |
Forstenlehner IC, Holzmann J, Toll H, et al. Site-specific characterization and absolute quantification of pegfilgrastim oxidation by top-down high-performance liquid chromatography-mass spectrometry[J]. Anal Chem, 2015, 87(18): 9336. DOI:10.1021/acs.analchem.5b02029 |
| [92] |
毕华, 韩春梅, 丁有学, 等. 重组人血管内皮生长因子抑制剂中异天门冬氨酸含量检测[J]. 药物分析杂志, 2015, 35(5): 879. BI H, HAN CM, DING YX, et al. Determination of isoaspartic acid in the recombinant human vascular endothelial growth factor inhibitor[J]. Chin Pharm J Anal, 2015, 35(5): 879. |
| [93] |
Li Yh, Rao Cm, Tao L, et al. Improved detection of variants in recombinant human interferon alpha-2a products by reverse-phase high-performance liquid chromatography on a core-shell stationary phase[J]. J Pharm Biomed Anal, 2014, 88: 123. DOI:10.1016/j.jpba.2013.08.011 |
| [94] |
Mark JK, Dionne S, Cyr TD, et al. Utility of standard pharmacopeial and nonpharmacopeial methods in distinguishing folded, unfolded, and process variant forms of interferon α-2[J]. J Pharm Sci, 2012, 101(10): 3672. DOI:10.1002/jps.23276 |
 2018, Vol. 38
2018, Vol. 38 
