2. 青岛市食品药品检验研究院, 青岛 266071;
3. 中国海洋大学 医药学院, 青岛 266003
2. Qingdao Institute for Food and Drug Control, Qingdao 266071, China;
3. School of Medicine and Pharmacy, Ocean University of China, Qingdao 266003, China
卡马西平(carbamazepine)是应用于临床30多年的有效抗癫痫药物之一,可用于缓解三叉神经痛和舌咽神经痛,预防或治疗躁狂抑郁症、心律失常、癫痫、中枢性部分性尿崩症[1]。虽然其应用广泛,但由于卡马西平属于典型的水溶性低的药物,固体溶解行为较为复杂,生物利用率受药物溶出速率的限制,需要通过大剂量用药来达到治疗效果[2]。氢氯噻嗪(hydrochlorothiazide),可用于治疗高血压、肾石症、水肿性疾病、尿崩症。同时由于氢氯噻嗪价格低廉,目前美国、欧洲国家以及中国都将其作为高血压降压治疗的一线药物[3]。但是,因为氢氯噻嗪较低的水溶性而导致其生物利用度较低[4]。卡马西平与氢氯噻嗪水溶性都较差,且氢氯噻嗪和卡马西平可联合用药用于治疗尿崩症[5]。
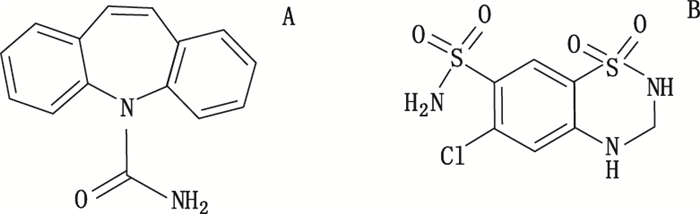
药物共晶是指通过氢键、π-π共轭等非共价键相互作用,形成的活性药物成分(active pharmaceutical ingredient,API)和共晶形成物(cocrystal former,CCF)的超分子复合物[6-8]。由于空间堆积方式的改变,药物活性分子在形成共晶后有些物理性质会发生相应的变化[9]。药物共晶可以改变药物的熔点和溶解度,还可以提高药物的稳定性、生物利用度、可压缩性以及流动性等许多重要参数[10-13]。氢氯噻嗪结构中包含磺胺基和仲胺结构(图 1),是氢键的良给体和良受体,较易形成共晶。比如Clarke等制备出氢氯噻嗪与异烟酰胺共晶的一水合物[14]。Hickey等人制备了氢氯噻嗪与烟酰胺的共晶[15]。氢氯噻嗪可与羧酸、酰胺类化合物形成共晶,卡马西平的分子结构中有1个带有酰胺官能团的氮杂环(图 1)。本文制备了氢氯噻嗪和卡马西平的药-药共晶,以期改变药物分子间的连接和堆积方式,达到改善药物理化性质的目的。
|
图 1 卡马西平(A)与氢氯噻嗪(B)结构式 Figure 1 The structures of carbamazepine(A) and hydrochlorothiazide(B) |
Thermo Scientific磁力搅拌仪;D8 FOCUS BRUKER X-射线衍射仪;Agilent Xcalibur单晶衍射仪;Perkin Elmer DSC 4000差式扫描量热仪;Perkin Elmer TGA 4000热重分析仪;Perkin Elmer Spevtvum 65红外分光光度计;Agilent 1200高效液相色谱仪;Agilent 708-DS溶出仪。
1.2 药品与试剂卡马西平原料药由北京诺华制药有限公司提供,氢氯噻嗪原料药由山西云鹏制药有限公司提供,纯度均大于98%;卡马西平对照品(批号100142-201105,含量99.7%)、氢氯噻嗪对照品(批号100309-201404,含量99.7%)购自中国食品药品检定研究院;甲醇、乙醇、乙腈、丙酮等均为色谱纯(Thermo Fisher Scientific公司)
2 方法 2.1 共晶的制备选用不同的溶剂(甲醇、乙醇、乙腈、丙酮)10 mL,将适量的卡马西平溶解并搅拌1 h,按照摩尔比1:1加入适量的氢氯噻嗪后继续搅拌1 h;过滤得澄清透明溶液,置于烧杯中静置培养,1~2 d后即得卡马西平-氢氯噻嗪晶体。
2.2 共晶的表征 2.2.1 X-射线单晶衍射(SCXRD)在培养的共晶中,挑选形状较为规则的单晶。采用X射线单晶衍射仪,Cu-Kα靶,波长为1.541 84 Å,温度为20 ℃,对得到的单晶进行扫描。
2.2.2 X-射线粉末衍射(PXRD)PXRD采用D8 FOCUS BRUKER X射线衍射仪,Cu-Kα靶,波长为1.540 562 Å,管压40 kV,管流40 mA,扫描速度0.5 °·min-1,扫描范围10°~40°2θ。将所得晶体研磨,过100目筛,进行测量。
2.2.3 热分析 2.2.3.1 差示扫描量热法(DSC)差示扫描量热法是在程序控制温度下,测量输入到试样和参比物的功率差(如以热的形式)与温度的关系。采用Perkin Elmer DSC 4000差式扫描量热仪[仪器用铟(156.6±0.2)℃的标准熔点校准)],考察卡马西平、氢氯噻嗪以及卡马西平与氢氯噻嗪共晶的热行为。将样品约5 mg置铝坩埚中,升温速率为10 ℃·min-1,测定的温度范围为20~300 ℃,氮气的流速为20 mL·min-1。
2.2.3.2 热重分析(TGA)采用Perkin Elmer TGA 4000热重分析仪,考察了共晶的热行为。样品量约为10 mg,升温速率为10 ℃·min-1,测定的温度范围为30~300 ℃。
2.2.4 红外光谱法(IR)分别将约2 mg卡马西平、氢氯噻嗪、卡马西平和氢氯噻嗪共晶与KBr压成薄片,采用Perkin Elmer Spevtvum 65红外分光光度计,在4 000~400 cm-1范围内扫描。
2.3 共晶性质的研究 2.3.1 高温、高湿、光照条件下的稳定性分别将适量的卡马西平、氢氯噻嗪以及共晶放置在高温(60 ℃)、高湿(75%、90%)、光照(4 500 lx)条件下5、10 d。然后用高效液相色谱法测定有效成分含量及生成的杂质含量[16-18]表征稳定性。同时,用电子天平测量吸湿增重来表征吸湿性。色谱条件:采用Agilent Zorbax SB-C18色谱柱(4.6 mm×250 mm,5 μm),以甲醇-水(50:50)为流动相,流速0.9 mL·min-1,柱温35 ℃,检测波长210 nm,进样量20 μL。
2.3.2 人工胃液、水中的稳定性 2.3.2.1 人工胃液中的稳定性取浓盐酸23.4 mL,加水至100 mL,得稀盐酸。取得到的稀盐酸1.64 mL,加水约80 mL和胃蛋白酶1 g,摇匀后,加水稀释至100 mL即得人工胃液。取10 mg卡马西平、相当于卡马西平10 mg的共晶分别置于25 mL量瓶中,用人工胃液溶解并稀释至刻度,然后再用人工胃液稀释10倍;取10 mg氢氯噻嗪、相当于氢氯噻嗪10 mg的共晶分别置于10 mL量瓶中,用人工胃液溶解并稀释至刻度,然后再用人工胃液稀释20倍。37 ℃水浴,分别在0、30、60、90、120 min时取样按“2.3.1”项中液相色谱条件测定,计算降解情况。
2.3.2.2 水中的稳定性取10 mg卡马西平、相当于卡马西平10 mg的共晶分别置于100 mL量瓶中,加水溶解并稀释至刻度,然后再用水稀释10倍;取氢氯噻嗪10 mg、相当于氢氯噻嗪10 mg的共晶分别置于100 mL量瓶中,加水溶解并稀释至刻度,然后再用水稀释2倍,分别在0、0.5、1、1.5、2、3、4、6、8、12、24 h时按“2.3.1”项中液相色谱条件测定,观察稳定性。
2.3.3 水中的溶解度精密称定过100目筛的卡马西平、氢氯噻嗪各约200 mg,及相当于氢氯噻嗪200 mg的共晶,分别置于100 mL溶出杯中,以100 mL水为溶出介质,转速为200 r·min-1,按《中华人民共和国药典》四部通则0931第三法进行操作;分别于5、10、20、30、45、60、90 min及2、4、6、8、12、16、18、24 h取样,按照“2.3.1”项下液相色谱条件测定。
3 结果与讨论 3.1 共晶的制备不同溶剂中制备共晶的结果见表 1。
|
|
表 1 不同溶剂培养共晶结果 Table 1 The results of prepared cocrystal with different solvents |
由表 1可知,在甲醇、乙醇、乙腈中都可以得到共晶,且甲醇、乙醇、乙腈中形成的共晶经过薄层色谱分析,均为卡马西平氢氯噻嗪共晶。实验中所用共晶均在乙腈中制备。
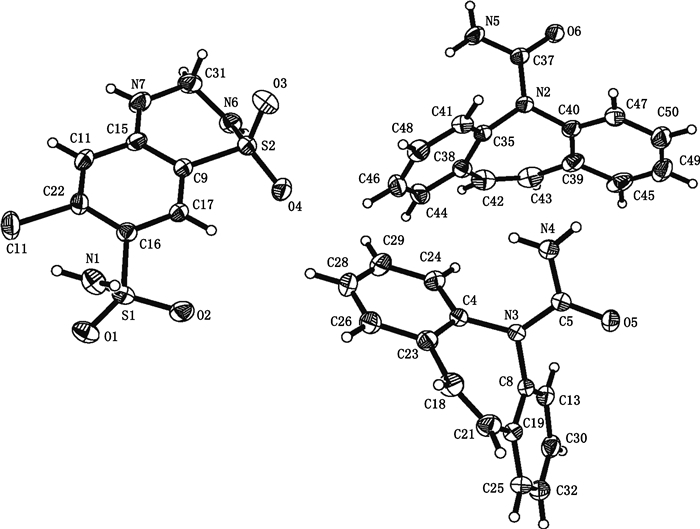
3.2 共晶的表征 3.2.1 X-射线单晶衍射(SCXRD)卡马西平-氢氯噻嗪的共晶结构属于三斜晶系P-1空间群,不对称单元中包括2个卡马西平分子和1个氢氯噻嗪分子(图 2),所示热椭球概率为30%。相关的晶体学参数见表 2,氢键在表 3中列出。氢氯噻嗪分子的头尾的亚胺基和氨基指向不同方向而采用椅式构象。
|
图 2 卡马西平-氢氯噻嗪晶体组成部分三维分子结构图 Figure 2 The three-dimensional molecular structure chart of carbamazepine-hydrochlorothiazide cocrystal's components |
|
|
表 2 卡马西平-氢氯噻嗪的晶体学和结构细化数据 Table 2 Crystallographic and structure refinement data for carbamazepine-hydrochlorothiazide |
|
|
表 3 卡马西平-氢氯噻嗪的部分氢键长度(Å)和角度(°) Table 3 Selected hydrogen bonds lengths(Å) and angles(°) for carbamazepine-hydrochlorothiazide |
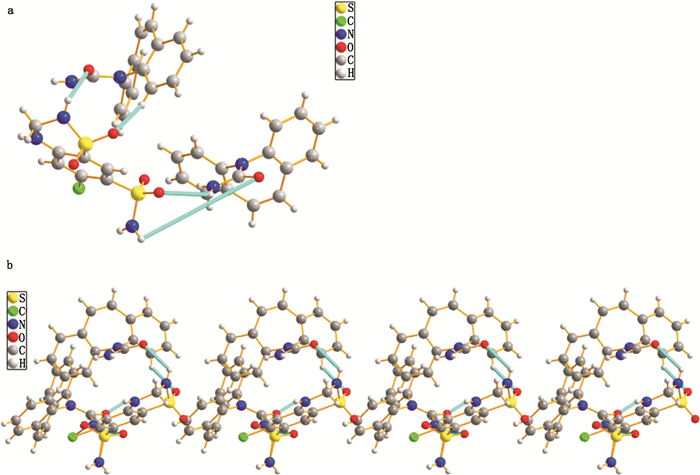
晶体结构堆积分析显示,1个卡马西平分子的亚甲基和酰胺基与氢氯噻嗪1个氧原子和亚胺基形成1个氢键N-H…O(2.412 Å,120.2°)和1个氢键C-H…O(2.47 Å,143.9°)(图 3-a),最后组成十圆环超分子单位。氢氯噻嗪分子中的磺酰胺基与卡马西平分子中的亚胺基NH形成分子间氢键N-H…O(2.38 Å,130.4°)(图 3-a)。氢氯噻嗪的磺酰胺基还参与N-H…O(2.89 Å,116.7°)氢键(图 3-a)。从C轴方向看,整个晶体结构通过氢氯噻嗪分子上述氢键扩展建造1个长城状的构型(图 3-b)。
|
a.六/十圆环图案(six/ ten rings pattern)b.环型图案的自组装扩展生成长城状构造(the self-assembly extension of the ring pattern generates) 氢键显示为蓝绿色(hydrogen bonds appear blue-green) 图 3 卡马西平-氢氯噻嗪晶体结构氢键构成的环型图案 Figure 3 Carbamazepine-hydrochlorothiazide crystal structure of the hydrogen bond consist of ring pattern |
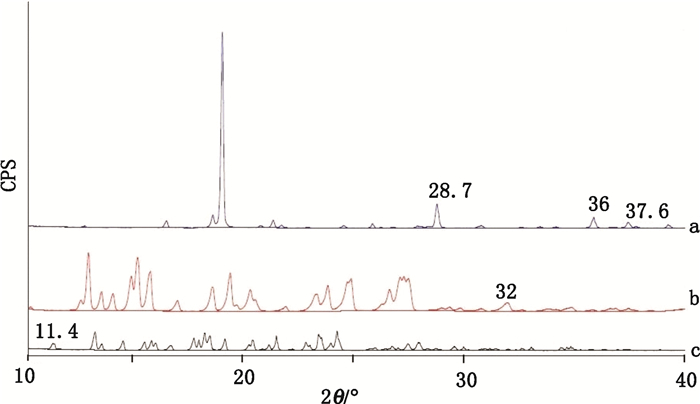
卡马西平、氢氯噻嗪以及其共晶的X-射线粉末衍射结果如图 4所示。
|
图 4 氢氯噻嗪(a)、卡马西平(b)、共晶(c)X-射线粉末衍射图谱 Figure 4 The map of X-ray powder diffraction for hydrochlorothiazide(a), carbamazepine (b), carbamazepine-hydrochlorothiazide cocrystal(c) |
由图 4可知,共晶的X-射线粉末衍射图谱并不是卡马西平与氢氯噻嗪图谱的简单叠加。共晶图谱中,原本归属于卡马西平的2θ=32.0°的特征峰,以及归属于氢氯噻嗪的2θ=28.7°、36.0°、37.6°的特征峰消失。而在2θ=11.4°出现了既不归属卡马西平又不归属氢氯噻嗪的新的衍射峰生成。证明卡马西平与氢氯噻嗪因为形成了共晶,而导致了衍射行为的改变。
3.2.3 热分析 3.2.3.1 差示扫描量热法(DSC)卡马西平、氢氯噻氢及共晶的差示扫描量热法分析结果如图 5所示。

|
图 5 卡马西平(a)、氢氯噻嗪(b)、卡马西平-氢氯噻嗪共晶(c)差示扫描量热法图谱 Figure 5 Differential scanning calorimetry thermograms for carbamazepine(a), hydrochlorothiazide(b), carbamazepine-hydrochlorothiazide cocrystal(c) |
由图 5可知,卡马西平在191.3 ℃有唯一的吸热峰,氢氯噻嗪的吸热峰在266.1 ℃,而卡马西平-氢氯噻嗪共晶在189.9 ℃吸热熔融。共晶的熔点既与卡马西平不同,又与氢氯噻嗪不同,说明由于卡马西平和氢氯噻嗪之间形成了新的氢键,改变了分子间的作用力与晶格能,进而导致了热行为的改变。进一步证明卡马西平和氢氯噻嗪形成了共晶。
3.2.3.2 热重分析(TGA)共晶的热重分析结果如图 6所示。
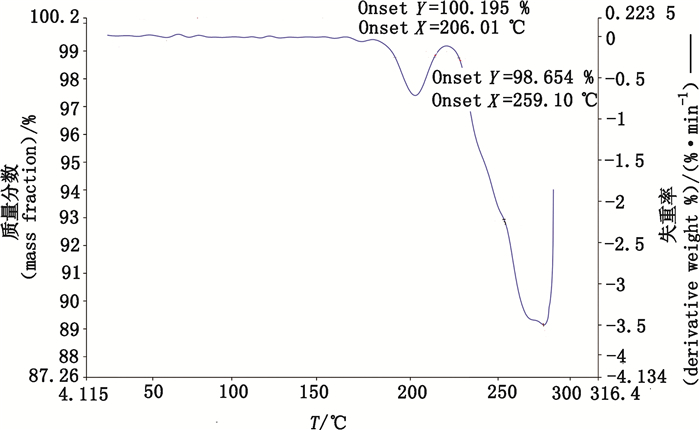
|
图 6 共晶的热重分析图谱 Figure 6 The map of thermogravimetric analysis about cocrystal |
综合分析图 6与差示扫描量热法测定结果,热重分析中在206.01 ℃之前没有失重行为,证明共晶为非溶剂化物[19]。由图 5、6可以看出,药物共晶卡马西平-氢氯噻嗪随着温度的升高,存在2步失重。第1步失重发生在206.01 ℃,与差示扫描量热法测定结果相比较,可知为卡马西平的分解;第2步失重发生在259.10 ℃处,对应为氢氯噻嗪的分解。表明实验中所得的晶体既含有氢氯噻嗪又含有卡马西平。
3.2.4 红外光谱法(IR)卡马西平、氢氯噻嗪及共晶的IR结果如图 7所示。
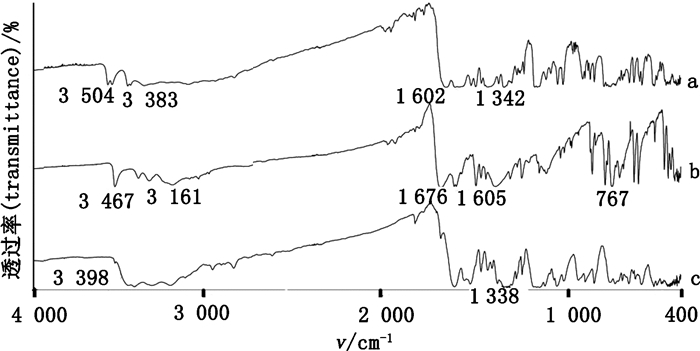
|
图 7 共晶(a)、卡马西平(b)及氢氯噻嗪(c)的傅里叶变换红外光谱图 Figure 7 Fourier transform infrared spectra diagrams of carbamazepine-hydrochlorothiazide cocrystal(a), carbamazepine(b), hydrochlorothiazide(c) |
由图 7可以看出,卡马西平的分子结构中N-H的特征峰在3 467 cm-1处,C=O的特征吸收峰在1 676 cm-1处,3 161、1 605、767 cm-1均为卡马西平分子结构中苯环的吸收峰;而形成共晶后,3 467 cm-1处的峰蓝移至3 504 cm-1,1 676 cm-1处的峰红移至1 602 cm-1处。氢氯噻嗪结构中的N-H吸收峰由3 398 cm-1红移至3 383 cm-1处,S=O的特征吸收峰由1 338 cm-1蓝移至1 342 cm-1处。表明卡马西平中的酰胺基与氢氯噻嗪中的磺酰胺基参与了共晶的氢键作用。
3.3 共晶性质的研究 3.3.1 高温、高湿、光照条件下的稳定性卡马西平与氢氯噻嗪对照品混合物液相色谱图如图 8所示。
|
图 8 卡马西平(a)及氢氯噻嗪(b)的液相色谱图 Figure 8 HPLC chromatogram of carbamazepine(a) and hydrochlorothiazide(b) |
高温、高湿、光照条件下的稳定性结果显示,共晶与原料药相比,在高温、高湿条件下稳定性没有发生变化,高湿条件下吸湿性结果如表 4所示,光照条件下稳定性结果如表 5所示。从表 4可以看出,卡马西平与氢氯噻嗪在形成共晶后,其吸湿性降低。从表 5可以看出,卡马西平、氢氯噻嗪在光照的条件下不稳定,但是两者结合形成共晶后,卡马西平与氢氯噻嗪的稳定性均有小幅度的提高。
|
|
表 4 高湿条件下的吸湿性 Table 4 The hygroscopicity under the high-humidity condition |
|
|
表 5 光照条件下的稳定性 Table 5 The stability under light conditions |
液相色谱测定结果显示:原料药卡马西平、氢氯噻嗪以及结合成共晶的卡马西平、氢氯噻嗪在人工胃液中都很稳定。在120 min后,几乎都没有降解。即结合形成共晶之后,并没有降低两者在人工胃液中的稳定性。
3.3.2.2 水中的稳定性水溶液检测结果显示:卡马西平、共晶中卡马西平、氢氯噻嗪、共晶中氢氯噻嗪在11个取样点色谱峰面积的RSD分别为1.3%、1.3%、0.88%、0.77%,说明卡马西平、氢氯噻嗪原料药与共晶在水溶液中24 h稳定,可以进行水溶液中溶解曲线的测定。
3.3.3 水中的溶解度卡马西平、氢氯噻嗪、共晶在水中溶解度结果如图 9所示。
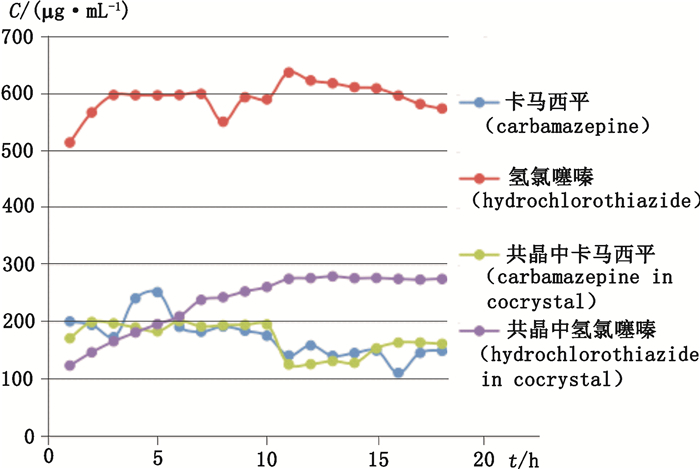
|
图 9 卡马西平、氢氯噻嗪、共晶在水中的溶解度曲线 Figure 9 The solubility curve of carbamazepine, hydrochlorothiazide and carbamazepine-hydrochlorothiazide cocrystal |
由图 9可知,卡马西平及共晶中的卡马西平在实验中的溶解度相近,卡马西平在45 min时,达到最大质量浓度为0.25 mg·mL-1;共晶中的卡马西平在60 min时达到最大质量浓度为0.20 mg·mL-1。氢氯噻嗪在8 h时达到最大质量浓度为0.64 mg·mL-1,共晶中的氢氯噻嗪在12 h时达到最大质量浓度为0.28 mg·mL-1。氢氯噻嗪形成共晶以后,溶解度大约相当于原料药氢氯噻嗪的1/2。但是,实验中是把原料药卡马西平与原料药氢氯噻嗪分别溶解于100 mL水中,
而相当于氢氯噻嗪原料药质量的共晶仅溶解于100 mL水中。所以,相当于卡马西平与氢氯噻嗪形成共晶以后,提高了卡马西平在水中的溶解度。
4 总结本文中通过溶液结晶法制备了卡马西平-氢氯噻嗪共晶。并通过X-射线单晶衍射法、X-射线粉末衍射法、差示扫描量热法、热重分析、红外光谱法对共晶进行表征,证明了共晶的存在。通过对共晶性质的研究,发现卡马西平与氢氯噻嗪形成共晶以后,可以降低原料药在高湿条件下的吸湿性,同时对药物在光照条件下稳定性有小幅度的提高以及提高了卡马西平在水中的溶解度。
| [1] |
CHILDS SL, WOOD PA, RODRIGUEZHORNEDO N, et al. Analysis of 50 crystal structures containing carbamazepine using the materials module of mercury CSD[J]. Cryst Growth Des, 2009, 9(4): 1869. DOI:10.1021/cg801056c |
| [2] |
许慎敏.卡马西平-丁二酸共晶热力学研究及溶液络合机理的探索[D].天津: 天津大学, 2011 XU SM.Thermodynamic Studies on the Cocrystals of Carbamazepine-Succinic Acid and the Solution Complexation Mechanism[D].Tianjin: Tianjin University, 2011 |
| [3] |
叶婵娟.吡嗪酰胺和氢氯噻嗪的共晶研究[D].南昌: 南昌大学, 2014 YE CJ.Co-crystals of Pyrazinamide and Hydrochlorothiazide[D].Nanchang: Nanchang University, 2014 |
| [4] |
CHILDS SL, CHYALL LJ, DUNLAP JT, et al. Crystal engineering approach to forming cocrystals of amine hydrochlorides with organic acids[J]. J Am Chem Soc, 2004, 126(41): 13335. DOI:10.1021/ja048114o |
| [5] |
张矫, 樊江波. 联合应用垂体后叶素氢氯噻嗪卡马西平治疗尿崩症[J]. 实用医技, 2001, 8(9): 706. ZHANG J, FAN JB. Combined with piturin hidrochlorothazide carbamazepine to treat diabetes insipidus[J]. J Pract Med Technol, 2001, 8(9): 706. |
| [6] |
CHILDS SL, STAHLY GP, PARK A, et al. The salt-cocrystal continuum:the influence of crystal structure on ionization state[J]. Mol Pharm, 2007, 4(3): 323. DOI:10.1021/mp0601345 |
| [7] |
FLEISCHMAN SG, KUDUVA SS, MCMAHON JA, et al. Crystal engineering of the composition of pharmaceutical phases:multiple-component crystalline solids involving carbamazepine[J]. Cryst Growth Des, 2003, 3(6): 909. DOI:10.1021/cg034035x |
| [8] |
CHRISTER BA, DEBRA JS. Building co-crystals with molecular sense and supramolecular sensibility[J]. Cryst Eng Comm, 2005, 7(72): 439. DOI:10.1039/b505883j |
| [9] |
王小兵, 黄世铭, 廖静怡, 等. 氢氯噻嗪药物共晶的制备、表征及量化计算[J]. 江西师范大学学报(自然科学版), 2015, 39(3): 240. WANG XB, HUANG SM, LIAO JY, et al. The synthesis, characterization and quantum calculations of cocrystals based on hydrochlorothiazide[J]. J Jiangxi Norm Univ(Nat Sci), 2015, 39(3): 240. |
| [10] |
MCNAMARA D, CHILDS S, GIORDANO J, et al. Use of a glutaric acid cocrystal to improve oral bioavailability of a low solubility API[J]. Pharm Res, 2006, 23(8): 1888. DOI:10.1007/s11095-006-9032-3 |
| [11] |
GOOD DJ, RODRIGUEZHORNEDO N. Solubility advantage of pharmaceutical cocrystals[J]. Cryst Growth Des, 2009, 9(5): 2252. DOI:10.1021/cg801039j |
| [12] |
YAN Y, CHEN JM, GENG N, et al. Improving the solubility of agomelatine via cocrystals[J]. Cryst Growth Des, 2012, 12(5): 2226. DOI:10.1021/cg201423q |
| [13] |
CAIRA MR, DEKKER TG, LIEBENBERG W. Structure of a 1:1 complex between the anthelmintic drug mebendazole and propionic acid[J]. J Chem Crystallogr, 1998, 28(1): 11. DOI:10.1023/A:1021766300133 |
| [14] |
CLARKER HD, ARORA KK, BASS H, et al. Structure-stability relationships in cocrystal hydrates:does the promiscuity of water make crystalline hydrates the nemesis of crystal engineering?[J]. Cryst Growth Des, 2010, 10(5): 2152. DOI:10.1021/cg901345u |
| [15] |
ALMARSSON O, HICKEY MB, MOULTON B, et al.Pharmaceutical Co-crystal Compositions of Drugs, Such as Carbamazepine, Celecoxib, Olanzapine, Itraconazole, Topiramate, Modafinil, 5-Fluorouracil, Hydrochlorothiazide, Acetaminophen, Aspirin, Flurbiprofen, Phenytoin and Ibuprofen: USA, WO/2004/078163[P].2004-02-26
|
| [16] |
周青, 余江平, 范渝蓉. 反相高效液相色谱法测定卡马西平的血药浓度[J]. 中国药业, 2007, 16(14): 27. ZHOU Q, YU JP, FAN YR. Determination of carbamazepine concentration in blood by RP-HPLC[J]. China Pharm, 2007, 16(14): 27. DOI:10.3969/j.issn.1006-4931.2007.14.022 |
| [17] |
朱光辉, 王增寿. 高效液相色谱法测定苯巴比妥、苯妥英、卡马西平的血药浓度[J]. 中国临床药学杂志, 2001, 10(1): 21. ZHU GH, WANG ZS. Determination of phenobarbital, phenytoin, carbamazepine in serum by HPLC[J]. Chin J Clin Pharm, 2001, 10(1): 21. DOI:10.3969/j.issn.1007-4406.2001.01.009 |
| [18] |
中华人民共和国药典2015年版.一部[S].2015: 182 ChP 2015.Vol Ⅰ[S].2015: 182 |
| [19] |
SOWA M, SLEPOKURA K, MATCZAKJON E. Improving solubility of fisetin by cocrystallization[J]. Cryst Eng Comm, 2014, 16(46): 10592. DOI:10.1039/C4CE01713G |
 2018, Vol. 38
2018, Vol. 38 
