胆汁酸是哺乳动物胆固醇的最终代谢产物,在生物体的糖、脂质和能量代谢过程中发挥着重要的调节作用[1]。胆汁酸在肝脏中合成,肠道是其主要的代谢场所,其含量异常变化通常与肝脏、肠道等疾病有关,因此,准确检测胆汁酸含量,对于疾病的诊断和治疗有着重要的意义。
胆汁酸的检测方法经历了从总含量检测到单一种类定性、定量的发展,精确度和准确度逐渐增高。主要方法为液相色谱法、气相色谱-质谱联用法(GC-MS)和液相色谱-串联质谱联用法(LC-MS/MS)等,而LC-MS/MS的灵敏度、精密度最高,且样品无需衍生化处理,是研究中最为常用的检测手段。用于胆汁酸检测的常见样本包括生物血浆[2]、血清[3]、胆[4]或胆汁[5]以及胆汁酸类药材[6-8]等,沈淑娇等[9]建立了检测小鼠肝脏中10种胆汁酸的方法,邓阳等[10]建立了检测大鼠血浆中16种胆汁酸的LC-MS/MS方法。本实验采用高效液相色谱-串联质谱(HPLC-MS/MS),同时检测了大鼠血浆中26种胆汁酸并进行了方法学验证,相比于其他方法,该方法操作简便,检测种类多,可为其他生物基质中的胆汁酸检测提供参考。
1 仪器与试剂 1.1 仪器LC-20AD型HPLC(岛津公司),ABSCIEX4000Q TRAP质谱仪(AB Sciex公司),Analyst 1.6.1数据系统(AB Sciex公司),VORTEX-GENE 2型涡旋混合器(Scientific Industries公司),Multifuge X3R型高速冷冻离心机(赛默飞世尔有限公司),MS105DU型十万分之一电子天平(梅特勒-托利多仪器有限公司)。
1.2 试剂本实验中共有26种胆汁酸对照品,分别为胆酸(CA,批号C1960-000)、鹅去氧胆酸(CDCA,批号C0985-000)、熊去氧胆酸(UDCA,批号C1020-000)、去氧胆酸(DCA,批号C1150-000)、甘氨胆酸钠(GCA-Na,批号C1927-000)、猪胆酸(HCA,批号C1850-000)、甘氨脱氧胆酸钠(GDCA-Na,批号C0867-000)、牛磺胆酸钠(TCA-Na,批号C1967-000)、牛磺脱氧胆酸钠(TDCA-Na,批号C0892-000)、猪去氧胆酸(HDCA,批号C0860-000)、脱氢胆酸(DHCA,批号C2000-000)、β-鼠胆酸(β-MCA,批号C1895-000)、石胆酸(LCA,批号C1420-000)、甘氨石胆酸(GLCA,批号C1435-000)、甘氨猪胆酸钠(GHCA-Na,批号C1860-000)、甘氨脱氢胆酸钠(GDHCA-Na,批号C2020-000)、甘氨猪去氧胆酸钠(GHDCA-Na,批号C0867-000)、甘氨熊去氧胆酸(GUDCA,批号C1025-000)、甘氨鹅去氧胆酸钠(GCDCA-Na,批号C0962-000)、牛磺猪胆酸钠(THCA-Na,批号C1887-000)、牛磺石胆酸(TLCA,批号C1470-000)、牛磺猪去氧胆酸(THDCA,批号C0890-000)、牛磺熊去氧胆酸钠(TUDCA-Na,批号C1052-000)、牛磺鹅去氧胆酸钠(TCDCA-Na,批号C0992-000)、牛磺脱氢胆酸钠(TDHCA-Na,批号C2047-000)、牛磺β-鼠胆酸(Tβ-MCA,批号C1899-000),均购自Steraloids公司;内标为d4-甘氨鹅去氧胆酸(d4-GCDCA,批号ZZS17080403),购自Isoreag公司;甲醇、乙腈、甲酸均为色谱纯(Fisher公司);HPLC用水为PURELAB flex纯水系统(ELGA公司)所制超纯水。
2 实验方法与结果 2.1 色谱和质谱条件采用Waters Symmetry C18色谱柱(2.1 mm×150 mm,3.5 μm),流动相A为含0.1%甲酸和10 mmol·L-1乙酸铵的水溶液,流动相B为含0.1%甲酸和10 mmol·L-1乙酸铵的甲醇溶液,梯度洗脱(0~2 min,60%B;2~40 min,60%B→90%B;40~45 min,90%B;45~50 min,60%B),流速0.15 mL·min-1,进样体积10 μL,柱温40 ℃,自动进样器:4 ℃。
质谱条件为电喷雾离子源(ESI),负离子模式(-),多离子反应监测(MRM)。工作参数:气帘气为137.9 kPa;离子源电压为-4.5 kV;离子源温度为300 ℃;GS1为275.8 kPa;GS2为275.8 kPa;Interface Heater:on;EP为-10 V;CXP为-13 V。监测离子对及其他最优参数见表 1。
|
|
表 1 26种胆汁酸及内标的质谱参数 Table 1 MS parameters of 26 bile acids and internal standards |
精密称取各胆汁酸对照品,置100 mL量瓶中,加甲醇溶解,根据大鼠血浆中胆汁酸浓度估算方法学考察浓度范围,配制HDCA、CDCA、DCA、CA、Tβ-MCA、GCA、UDCA、GHDCA、GCDCA、GDCA、β-MCA、THDCA、TDCA、TCA、GUDCA、HCA、TUDCA、TCDCA、THCA、GHCA、LCA、GDHCA、DHCA、TLCA、GLCA、TDHCA的浓度分别为120.22、120.13、120.04、120.07、120.17、120.09、20.25、20.18、20.14、20.27、20.11、20.08、20.17、20.06、2.51、2.52、2.50、2.51、2.50、2.53、2.51、2.55、2.53、2.51、2.51、2.50 μmol·L-1的溶液,4 ℃冰箱中储存备用。
2.2.2 内标溶液精密称取内标d4-GCDCA,加乙腈溶解定容,配制成浓度为5.0 μmol·L-1的溶液(乙腈作为蛋白沉淀剂),4 ℃冰箱中储存备用。
2.3 血浆样品预处理 2.3.1 血浆样品的处理血浆样品选择蛋白沉淀法处理[2, 10-12]。将大鼠血浆样品取出解冻,涡旋1 min,精密吸取50 μL,加入内标溶液200 μL,涡旋10 min,12 000 r·min-1离心10 min,取上清液200 μL,氮气吹干,100 μL甲醇复溶,涡旋3 min后进样分析。
2.3.2 空白基质的制备取大鼠血浆10 mL,加入活性炭0.53 g,涡旋5 h,12 000 r·min-1离心1 h,取上清液,即得空白基质。-20 ℃储存备用。将所得空白基质按“2.3.1”项下方法处理后进样分析,结果表明(图 1-A),活性炭可显著地去除内源性胆汁酸,经活性炭处理得到的空白基质无内源性胆汁酸和杂质的干扰。
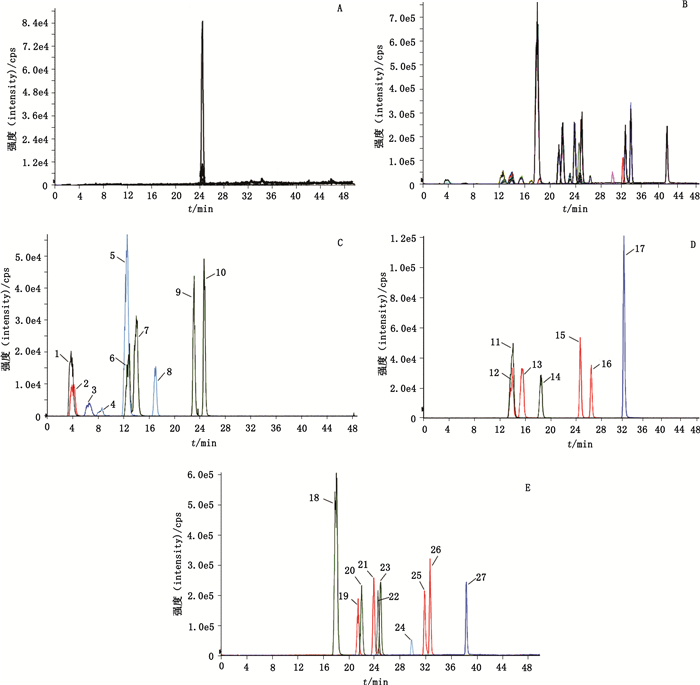
|
A.空白基质+内标(matrix+internal standard)B.空白基质+26种胆汁酸对照品+内标(matrix+26 bile acids+ internal standard)C~E. 26种胆汁酸及内标(26 bile acids and internal standard in B) 1. TDHCA 2. GDHCA 3. DHCA 4. TβMCA 5. THCA 6. TUDCA 7. THDCA 8. CA 9. TCDCA 10. TDCA 11. GUDCA 12. GHCA13. GDHCA 14. GCA 15. GCDCA 16. GDCA 17. GLCA 18. βMCA 19. UDCA 20. HCA 21. HDCA 22. d4-GCDCA 23. CA 24. TLCA25. CDCA 26. DCA 27. LCA 图 1 大鼠血浆中26种胆汁酸对照品及内标MRM提取离子流图 Figure 1 MRM chromatograms of 26 bile acids and internal standard in rat plasma |
取“2.3.2”项下空白基质,分别加入内标溶液和胆汁酸对照品储备液,按“2.3.1”项下方法处理后进样分析,分别获得相应离子流色谱图。26种胆汁酸及内标的离子流色谱图见图 1。内标d4-GCDCA的保留时间为24.53 min,其他26种胆汁酸的保留时间见表 2。
|
|
表 2 26种胆汁酸的回归方程、相关系数、线性范围、检测下限(LOD)及保留时间 Table 2 Regression equation, correlation coefficient, linear range, the limit of detection(LOD) and retention time of 26 bile acids |
本实验中检测的26种胆汁酸包含6组构像异构体,分别为:(1)HDCA、CDCA、DCA、UDCA;(2)GHDCA、GCDCA、GDCA、GUDCA;(3)THDCA、TCDCA、TDCA、TUDCA;(4)CA、β-MCA、HCA;(5)TCA、Tβ-MCA、THCA;(6)GCA、GHCA。这6组胆汁酸中每组的检测离子对相同,因此,必须在保留时间内完全分离才能定性和定量。由表 2可以看出,6组构像异构体均实现了完全分离。
2.4.2 标准曲线、线性范围及定量下限用空白基质将胆汁酸对照品储备液稀释成不同浓度梯度,按“2.3.1”项下方法处理后进样测定,以胆汁酸峰面积与内标峰面积之比对浓度(权重1/X2)进行线性回归,结果见表 2。
2.4.3 精密度与回收率取空白基质和胆汁酸对照品储备液,分别配制定量下限(LOQ)、低、中、高4种浓度的质量控制(QC)样品,每一浓度平行操作5份,按“2.3.1”项下方法处理后进样,分析并计算胆汁酸浓度,得日内精密度和回收率。配制3批QC样品并进样检测,得日间精密度和回收率。在该方法下,26种胆汁酸的日内、日间回收率均在85.9%~113.8%之间,日内、日间精密度均在2.0%~13.3%之间,符合2015年版《中华人民共和国药典》(以下简称《中国药典》)生物样本质控标准。
2.4.4 基质效应和提取回收率分别配制低、中、高3种浓度的溶液,分为3套,编号为S1、S2、S3。S1为空白基质稀释的胆汁酸对照品储备液,按“2.3.1”项下方法处理;S2为甲醇稀释的对照品储备液加内标溶液;S3为空白基质加入乙腈(沉淀剂)后取上清液挥干复溶,再加入对照品储备液和内标溶液。将3套溶液分别进样分析,得到相应胆汁酸的峰面积。基质效应=AS3/AS2×100%,提取回收率=AS1/AS3×100%。26种待测胆汁酸中,TDHCA受基质影响大,其他种类的基质效应(85.2%~111.5%)均在2015年版《中国药典》标准范围之内,胆汁酸的提取回收率在65.7%~104.5%之间。
2.4.5 稳定性考察取空白基质和胆汁酸对照品储备液,分别配制低、中、高3种浓度的QC样品。每一浓度平行操作3份,按“2.3.1”项下方法处理,分别经过-80 ℃反复冻融3次、-80 ℃长期冻存和4 ℃自动进样器内放置24 h后进样分析。结果RSD均在0.24%~10.6%之间,表明供试溶液在本文实验条件下均能保持稳定。
2.5 健康SD大鼠血浆中胆汁酸含量的测定将健康SD大鼠血浆在该方法下进行检测,26种待测胆汁酸中17种含量在线性范围内,浓度范围为0.019 2~2.83 μmol·L-1。其中HDCA、DCA、CA、GCA、β-MCA和GDCA含量较高,是SD大鼠血浆中胆汁酸的主要成分;TLCA和GLCA含量低于检测下限,表明其在SD大鼠血浆中含量极低,在大量检测样本时可适当尝试更低的定量下限。此外,TUDCA、THCA、GHCA、LCA、GDHCA、DHCA和TDHCA共7种胆汁酸未检测出,其中TUDCA和LCA在大鼠肝脏合成时含量很低[13-14],而血浆中含量甚微,其他5种在SD大鼠血浆内没有分布。具体结果如图 2所示。
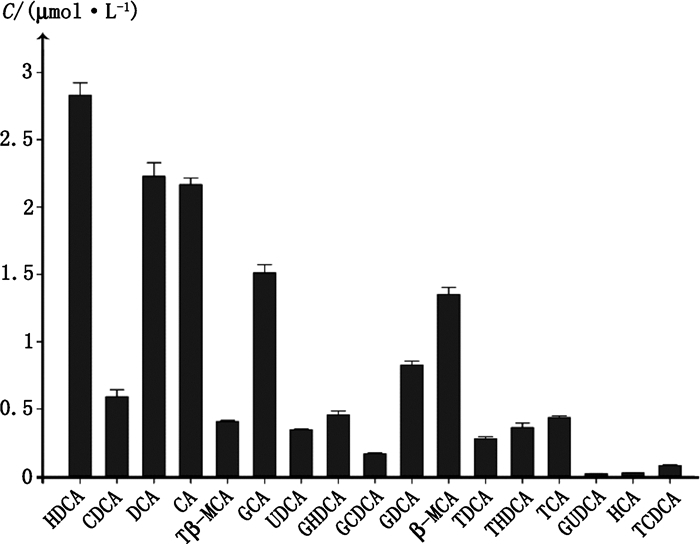
|
图 2 健康SD大鼠血浆胆汁酸含量(n=3) Figure 2 Concentration of bile acid in healthy SD rat plasma samples |
胆汁酸是内源性物质,在方法学考察的过程中会对实验结果造成影响。本实验采用血浆加活性炭长时间振摇,以吸附内源性胆汁酸和其他杂质,制备空白基质[10, 15],结果活性炭可以高效吸附内源性胆汁酸和其他杂质,且对检测无影响,标准曲线更准确。
血浆是胆汁酸研究中常见的生物基质,目前研究中对血浆的处理多采用蛋白沉淀法[16],该方法简单快速,所需要的溶剂和样本量少。本实验采用乙腈作为沉淀剂,经处理后可得干净的供试溶液,适合直接进样。基质效应是生物样本检测的重要影响因素,可能会对色谱峰的峰形、峰高等产生影响[17]。如图 1:CA在血浆基质中峰形发生改变,在目标峰旁出现1个小峰,但该小峰的峰面积与浓度成正比,在定量时并未造成影响,CA的相关系数(r)可达到0.993 9;此外,TDHCA受基质效应影响较大,因此在推广该方法至其他生物基质或其他物种的样本时,需要多次验证TDHCA。
3.2 流动相的选择和分离效果本实验检测的26种胆汁酸中包含离子对相同的构像异构体,构像异构体的分离是该方法的检测难点。参考国内外文献[10, 18]以及根据实验条件,有机相分别尝试了乙腈、甲醇、甲醇-乙腈(50:50),同时证实,加入甲酸和乙酸铵能增加胆汁酸信号强度。结果表明:尽管在通常条件下,乙腈具有更好的洗脱能力,但在该实验中使目标物出峰过早,集中在3 min左右,分离效果差,且柱压高,对色谱柱影响较大,出峰时间不稳定;甲醇-乙腈(50:50)虽能够得到保留时间较好的色谱峰,但对于性质相似的异构体同样没有分离能力;甲醇则能够在保持较低柱压的同时分离构像异构体(图 1),且峰形互不干扰,表现出较好的分离效果。
3.3 胆汁酸检测种类的选择本实验检测的26种胆汁酸中包含CA、CDCA等常见种类,也存在如β-MCA、Tβ-MCA、THDCA、GHDCA、DHCA及其结合型产物等较少被检测的种类,其中大部分胆汁酸可作为疾病或代谢过程中的标志性胆汁酸。尽管部分胆汁酸如TUDCA未能检测出,但在特定疾病状态或者药物治疗干预下,血浆中的含量会达到其检测下限[10],因此,检测方法的建立可为进一步对此类成分进行研究奠定基础。
β-MCA是鼠类的主要初级胆汁酸[11],其牛磺酸结合产物Tβ-MCA在血浆中含量较高,为0.408 μmol·L-1,监测这2种胆汁酸有利于大鼠胆汁酸谱的建立;β-MCA也是妊娠期糖尿病患者血清中的重要标志胆汁酸[19],对其含量监测有重要的临床意义。THDCA和GHDCA的含量改变可作为肝脏疾病中标志物[20-21],TUDCA在胆汁淤积类疾病中会显著上升[22],而本方法即可检测这些疾病的动物模型的胆汁酸。此外,该方法还可推广到人类血浆或其他生物基质的胆汁酸的测定中,LCA、DHCA等是人类重要的次级胆汁酸,对这些胆汁酸及其甘氨酸和牛磺酸结合产物的监测,对于今后其他研究具有参考意义。
4 结论本实验应用HPLC-MS/MS,建立了大鼠血浆中26种胆汁酸的定量测定方法,该方法的特异性、灵敏度、精密度、准确度和稳定性均良好,适用于同时定量血浆中多种胆汁酸,是目前国内检测血浆胆汁酸种类最多的方法。该方法可应用于肝胆、肠道等疾病和药物治疗的大鼠模型血浆胆汁酸的测定,同时可推广为其他物种血浆胆汁酸的定量方法,对其他生物基质中的胆汁酸定量方法的建立也有重要参考意义。
| [1] |
LI T, CHIANG JY. Bile acid signaling in metabolic disease and drug therapy[J]. Pharmacol Rev, 2014, 66(4): 948. DOI:10.1124/pr.113.008201 |
| [2] |
彭灿, 王敏, 吕蒙莹, 等. 大鼠血浆中胆汁酸、胆红素及牛磺酸的LC-MS/MS分析[J]. 中国药科大学学报, 2013, 44(4): 343. PENG C, WANG M, LÜ MY, et al. Determination of bile acids bilirubin and taurine in rat plasma by LC-MS/MS[J]. J China Pharm Univ, 2013, 44(4): 343. |
| [3] |
韩建华, 苏薇, 崔巍, 等. 超高效液相色谱-串联质谱联用检测血清胆汁酸谱方法的建立及初步临床应用[J]. 中华检验医学杂志, 2012, 35(3): 253. HAN J, SU W, CUI W, et al. Establishment and preliminary clinical application of serum bile acid spectrum analysis by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Lab Med, 2012, 35(3): 253. DOI:10.3760/cma.j.issn.1009-9158.2012.03.013 |
| [4] |
张穗, 黄宇声, 石朝周. RP-HPLC梯度法测定8种蛇胆中结合型胆汁酸的含量[J]. 药物分析杂志, 2006, 26(6): 826. ZHANG S, HUANG YS, SHI CZ. RP-HPLC determination of eight conjugate bile acids in snake gall of gradient elution method[J]. Chin J Pharm Anal, 2006, 26(6): 826. |
| [5] |
斯日古楞, 刘小玲, 李冬梅, 等. 超高效液相色谱快速分析不同哺乳动物胆汁中胆汁酸[J]. 分析化学, 2015, 43(5): 675. SIRIGULENG, LIU XL, LI DM, et al. Rapid determination of bile acids in bile from various mammals by ultra-fast liquid chromatography[J]. Chin J Anal Chem, 2015, 43(5): 675. |
| [6] |
石岩, 魏锋, 林瑞超, 等. 熊胆粉中主要胆汁酸类成分的测定及分析[J]. 中国药学杂志, 2016, 51(22): 1958. SHI Y, WEI F, LIN RC, et al. Quantification of the major bile acids in bear bile powder by HPLC-ELSD[J]. Chin Pharm J, 2016, 51(22): 1958. |
| [7] |
王一博, 王春雨, 曲范娜, 等. 高效液相色谱-电雾式检测器同时测定猪、牛、羊、熊胆粉中5种胆汁酸的含量[J]. 分析化学, 2014, 42(1): 109. WANG YB, WANG CY, QU FN, et al. Simultaneous determination of five bile acids in Pulvis Fellis Suis, Pulvis Billis Bovis, Pulvis Fellis Caprinus and Pulvis Fellis Galli by high performance liquid chromatography-charged aerosol detector[J]. Chin J Anal Chem, 2014, 42(1): 109. |
| [8] |
熊婧, 郑天骄, 石岩, 等. 人工牛黄甲硝唑胶囊中主要胆汁酸类成分的HPLC-ELSD法测定研究[J]. 药物分析杂志, 2015, 35(6): 1067. XIONG J, ZHENG TJ, SHI Y, et al. Study on simultaneous determination of major bile acids from artificial bezoar and metronidazole capsules by HPLC-ELSD[J]. Chin J Pharm Anal, 2015, 35(6): 1067. |
| [9] |
沈淑娇, 张志荣, 曾金, 等. LC-MS/MS测定小鼠肝脏中10种胆汁酸浓度的方法与应用[J]. 肝脏, 2015, 20(4): 285. SHEN SJ, ZHANG ZR, ZENG J, et al. Determination method of ten kinds of bile acids and its application in mice liver by LC-MS/MS[J]. Chin Hepatol, 2015, 20(4): 285. DOI:10.3969/j.issn.1008-1704.2015.04.006 |
| [10] |
邓阳, 张毕奎, 颜苗, 等. LC-MS/MS测定大鼠血浆中16种胆汁酸及在甘草减毒研究中的应用[J]. 中国药学杂志, 2015, 50(3): 263. DENG Y, ZHANG BK, YAN M, et al. LC-MS/MS method for determination of sixteen bile acids in rat plasma and its application in liquorice detoxification research[J]. Chin Pharm J, 2015, 50(3): 263. |
| [11] |
JOHN C, WERNER P, WORTHMANN A, et al. A liquid chromatography-tandem mass spectrometry-based method for the simultaneous determination of hydroxy sterols and bile acids[J]. J Chromatogr A, 2014, 1371: 184. DOI:10.1016/j.chroma.2014.10.064 |
| [12] |
JÄNTTI SE, KIVILOMPOLO M, ÖHRNBERG L, et al. Quantitative profiling of bile acids in blood, adipose tissue, intestine, and gall bladder samples using ultra high performance liquid chromatography-tandem mass spectrometry[J]. Anal Bioanal Chem, 2014, 406(30): 7799. DOI:10.1007/s00216-014-8230-9 |
| [13] |
SAKAKURA H, KIMURA N, TAKEDA H, et al. Simultaneous determination of bile acids in rat liver tissue by high-performance liquid chromatography[J]. J Chromatogr B Biomed Sci Appl, 1998, 718(1): 33. DOI:10.1016/S0378-4347(98)00342-9 |
| [14] |
TAGUCHI K, FUKUSAKI E, BAMBA T. Simultaneous and rapid analysis of bile acids including conjugates by supercritical fluid chromatography coupled to tandem mass spectrometry[J]. J Chromatogr A, 2013, 1299: 103. DOI:10.1016/j.chroma.2013.05.043 |
| [15] |
BATHENA SPR, MUKHERJEE S, OLIVERA M, et al. The profile of bile acids and their sulfate metabolites in human urine and serum[J]. J Chromatogr B, 2013, 942-943: 53. DOI:10.1016/j.jchromb.2013.10.019 |
| [16] |
HUANG J, BATHENA SPR, CSANAKY IL, et al. Simultaneous characterization of bile acids and their sulfate metabolites in mouse liver, plasma, bile, and urine using LC-MS/MS[J]. J Pharm Biomed, 2011, 55(5): 1111. DOI:10.1016/j.jpba.2011.03.035 |
| [17] |
FANG N, YU S, RONIS MJ, et al. Matrix effects break the LC behavior rule for analytes in LC-MS/MS analysis of biological samples[J]. Exp Biol Med, 2015, 240(4): 488. DOI:10.1177/1535370214554545 |
| [18] |
SARAFIAN MH, LEWIS MR, PECHLIVANIS A, et al. Bile acid profiling and quantification in biofluids using ultra-performance liquid chromatography tandem mass spectrometry[J]. Anal Chem, 2015, 87(19): 9662. DOI:10.1021/acs.analchem.5b01556 |
| [19] |
BELLAMY L, CASAS JP, HINGORANI AD, et al. Type 2 diabetes mellitus after gestational diabetes:a systematic review and meta-analysis[J]. Lancet, 2009, 373(9677): 1773. DOI:10.1016/S0140-6736(09)60731-5 |
| [20] |
SARAFIAN MH, LEWIS MR, PECHLIVANIS A, et al. Bile acid profiling and quantification in biofluids using ultra-performance liquid chromatography tandem mass spectrometry[J]. Anal Chem, 2015, 87(19): 9662. DOI:10.1021/acs.analchem.5b01556 |
| [21] |
YANG F, TANG X, DING L, et al. Curcumin protects ANIT-induced cholestasis through signaling pathway of FXR-regulated bile acid and inflammation[J]. Sci Rep, 2016, 6: 33052. DOI:10.1038/srep33052 |
| [22] |
CHEN J, DENG W, WANG J, et al. Primary bile acids as potential biomarkers for the clinical grading of intrahepatic cholestasis of pregnancy[J]. Int J Gynecol Obstet, 2013, 122(1): 5. DOI:10.1016/j.ijgo.2013.02.015 |
 2018, Vol. 38
2018, Vol. 38 
