2. 中国食品药品检定研究院医疗器械检定所, 北京 102629
2. Institute for Medical Devices Control, National Institutes for Food and Drug Control, Beijing 102629, China
近年来,随着纳米技术的发展,氧化铁纳米颗粒(iron oxide nanoparticles,IONPs)的癌症靶向性和核磁共振造影(magnetic resonance imaging,MRI)增强剂特性决定了它在癌症诊断和治疗上的应用优势。1996年美国FDA首先批准了静注IONPs应用于肝损伤和肿瘤的MRI诊断。IONPs具有潜在靶向蓄积在中枢神经系统胶质瘤的特性,使其在准确和长期诊断方面与传统MRI造影剂相比优势凸显[1-2]。脑胶质瘤是原发性脑癌中最常见的恶性肿瘤。由于胶质瘤侵染性强和对传统放化疗抵抗等特点,使其成为预后最差且治疗费用最昂贵的脑肿瘤。开发新的脑胶质瘤准确诊断和有效治疗的新方法迫在眉睫[3]。1997年,体外研究首次发现IONPs可通过诱导局部发热从而杀死胶质瘤细胞,大鼠体内实验又进一步证明IONPs可以有效抑制胶质瘤[4]。1997年之后,大量实验证明了IONPs通过交变电场发热和诱导氧化应激等不同机制,具有潜在治疗胶质瘤的能力[5]。与此同时,越来越多的研究发现,IONPs的不同表面修饰对其中枢神经系统分布和抑制胶质瘤效应影响巨大[6]。因此,研究不同表面修饰的IONPs诱导胶质瘤凋亡的作用机制,可为推动IONPs未来的药物研发和胶质瘤治疗应用奠定基础。
已有报道活性氧簇(ROS)介导自噬在人胶质瘤细胞U-87 MG中诱导自噬性死亡[7]。临床研究证明,溶瘤腺病毒和替莫唑胺(TMZ)联用诱导细胞自噬可以有效抑制肿瘤生长,延长胶质瘤病人的生存率[8];许多临床应用的传统化疗药如治疗胶质瘤的丙戊酸等都诱导细胞自噬[9];同时也有研究显示细胞自噬起到抑制胶质瘤细胞凋亡的效果[10]。越来越多的证据表明自噬对细胞的生存或死亡存在双向调控机制[11]。因此,深入阐明IONPs如何影响胶质瘤自噬水平是开发其用于抗胶质瘤治疗需要解决的关键问题。
本实验利用人脑胶质瘤细胞(U87)结合高内涵实验、流式凋亡实验等方法,研究3种不同表面修饰的IONPs诱导U87自噬的差异,并进一步深入研究自噬在调控IONPs诱导凋亡中的调控作用。
1 材料 1.1 细胞U87由中国医学科学院基础医学研究所基础医学细胞中心提供。
1.2 试剂聚乙二醇表面修饰的氧化铁纳米颗粒(PEG-IONPs,Sigma-Aldrich公司,生产批号MKBR4497V,直径5 nm);氨基表面修饰的氧化铁纳米颗粒(Amine-IONPs,Sigma-Aldrich公司,生产批号MKBR2641V,直径5 nm);氧化铁纳米颗粒(IONPs,Sigma-Aldrich公司,生产批号MKBQ3992V,直径5 nm);1640高糖培养基(Hyclone公司);胎牛血清(Biological Industries公司);CellTiter-Glo® Luminescent细胞生长试剂盒(Promega公司,试剂盒含CellTiter-Glo®底物冻干粉和CellTiter-Glo®缓冲液);PE-Annexin V流式凋亡试剂盒[BD公司,试剂盒内含染料FITC Annexin V和Propidium Iodide(PI)及10X Binding Buffer];0.5%Trypsin-EDTA和细胞冻存液(Gibco公司);3-甲基腺嘌呤(3-MA,Sigma-Aldrich公司);Cyto-ID细胞自噬检测试剂盒(Enzo公司,试剂盒包含染料Hoechst33342和Cyto-id green及1X Assay Buffer);0.25%胰蛋白酶(Gibco公司);磷酸盐缓冲液(PBS,Hyclone公司)。
1.3 仪器BD流式细胞仪(BD公司);In cell 2000型高内涵系统(GE公司);VICTOR X5酶标仪(PerkinElmer公司);Malvern Zeta Sizer Nano ZS(Malvern公司)。
2 方法 2.1 动态光散射(dynamic light scattering,DLS)测定IONPs的粒径分布和表面电性用1640细胞培养液将IONPs、PEG-IONPs和Amine-IONPs分别稀释至1 μg·m L-1后,用Malvern Zeta Sizer Nano ZS测定颗粒在细胞培养液中的颗粒分布和表面带电性。
2.2 细胞培养将U87置于常规培养皿内,以高糖1640培养基(含10%胎牛血清)在37 ℃,5%CO2和相对湿度90%的培养箱内培养,培养基隔天更换,2~3 d达到融合。本实验所用U87为110~120代。
2.3 IONPs对U87生长抑制实验及自噬对生长抑制的影响U87细胞悬液接种于96孔培养板(每孔5×103个细胞)过夜。分设对照组、不同浓度(1、5、10、50、100、300和500 μg·m L-1)IONPs组(经过预实验,选择从无毒剂量1 μg·m L-1到可稀释的最大剂量500 μg·m L-1)及加入3-甲基腺嘌呤(3-MA,5 mmol·L-1)和不同浓度IONPs组(浓度同上)。在37 ℃,5% CO2(以下孵育条件相同)条件下孵育24 h,用细胞培养液孵育24 h(总共孵育48 h),再加入相同体积的CellTiter-Glo® Reagent,震荡2 min,室温孵育10 min。用酶标仪检测各孔的化学发光,并计算细胞存活率=(化学发光强度给药组/化学发光强度对照组)×100%。
2.4 IONPs诱导U87产生自噬试验U87悬液接种于96孔培养板(每孔5×103个细胞)过夜。分设对照组、阳性对照组[0.5 μmol·L-1雷帕霉素(RAP),10 μmol·L-1氯喹(CLQ)或0.5 μmol·L-1雷帕霉素+10 μmol·L-1氯喹]、不同浓度(10、50和200 μg·m L-1)IONPs组。在37 ℃,5% CO2(以下孵育条件相同)条件下孵育24 h后,吸出上清液并每孔加100 μL 1X Assay Buffer清洗2次,然后每孔加入含有2个荧光标记的溶液100 μmol·L-1[Hoechst33342(1 000倍稀释),cyto-id green 20 μmol·L-1(500倍稀释)]。避光37 ℃培养30 min后,用200 μL 1X Assay Buffer清洗染料2次,然后每孔加100 μL 1X Assay buffer尽快用荧光酶标仪读板。Cyto-id green用固定扫描激发波长480 nm,发射波长530 nm,Hoechst 33342用激发波长340 nm,发射波长480 nm。
2.5 Annexin V/PI双染流式细胞术测定细胞凋亡率及自噬对细胞凋亡的影响U87悬液接种于6孔培养板(每孔1×106个细胞)过夜。在37 ℃,5% CO2(以下孵育条件相同)条件下,10、50和200 μg·m L-1的IONPs、PEG-IONPs、Amine-IONPs孵育24 h组(根据IONPs生长抑制曲线选择无明显抑制低剂量、中度抑制剂量和引起较多生长抑制的高剂量),加入自噬诱导剂雷帕霉素0.5 μmol·L-1的10、50和200 μg·m L-1的IONPs、PEG-IONPs、Amine-IONPs孵育24 h,研究氧化应激对细胞凋亡的影响,每个浓度3个复孔,0.25%胰蛋白酶消化细胞并收集于流式管中,用PBS将U87洗2遍,加入100 μL binding buffer分散细胞后,分别加入FITC-Annexin V及碘化丙啶(propidium iodide,PI)染料各5 μL,室温下避光染色15 min,于1 h内用流式细胞仪进行检测,每个样品采集1×104个细胞。在正常细胞中,磷脂酰丝氨酸只分布在细胞膜脂质双层的内侧,细胞发生凋亡最早期,膜磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧,AnnexinV与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合;因此AnnexinV被作为检测细胞早期凋亡的灵敏指标之一。PI是一种核酸染料,它不能透过完整的细胞膜,但凋亡中晚期的细胞和死细胞由于细胞膜通透性的增加,PI能够透过细胞膜而使细胞核染红;因此将Annexin V与PI匹配使用,就可以将处于不同凋亡时期的细胞区分开来。使用FACSDiva 4软件对结果进行分析。细胞凋亡率=凋亡细胞数/总细胞数×100%。
2.6 数据处理试验数据均以x±s表示。采用GraphPad Prism 6软件,对2组数据采用t检验进行比较,对3组及以上数据采用单因素方差分析,琼脂克隆数据用Fisher’s exact test分析各组差异,P < 0.05为差异有统计学意义。
3 试验结果 3.1 IONPs大小分布和表面电性动态光散射测定3种IONPs在细胞培养液中的颗粒分布和表面带电性见本实验室以往研究报道[12]。IONPs平均分布为(5.1±0.3)nm,表面带电为-30 mV;PEG-IONP平均分布为(5.6±0.4)nm,表面带电为-2 mV;Amine-IONPs平均分布为(5.3±0.7)nm,表面带电为+13 mV。3种不同表面修饰的5 nm IONPs在细胞培养液中均匀分布,无明显聚集。
3.2 3种不同的IONPs对U87的生长抑制实验结果表明,3种IONPs均可以抑制U87的增殖,并呈明显的剂量依赖性(如图 1所示)。当孵育质量浓度为50 μg·m L-1时,3种IONPs都出现了一定程度的生长抑制,其中对U87生长抑制从大到小排序分布为Amine-IONPs、PEG-IONPs、IONPs。加入自噬抑制剂3-MA之后,不同表面修饰的IONPs对生长抑制表现出明显的差异。抑制自噬,对PEG-IONPs诱导生长抑制并无明显影响。IONP的生长抑制在不同剂量均稍有加强,但并无显著性差异。抑制自噬后,Amine-IONPs诱导凋亡的能力显著性降低,IC50从112 μg·m L-1降低到92μg·m L-1,且在高剂量更为明显(见图 1)。该结果显示,自噬对不同表面修饰和表面带电的IONPs对不同纳米材料诱导细胞凋亡的作用也存在差异,下一步用高内涵实验验证3种IONPs诱导U87自噬的特点。
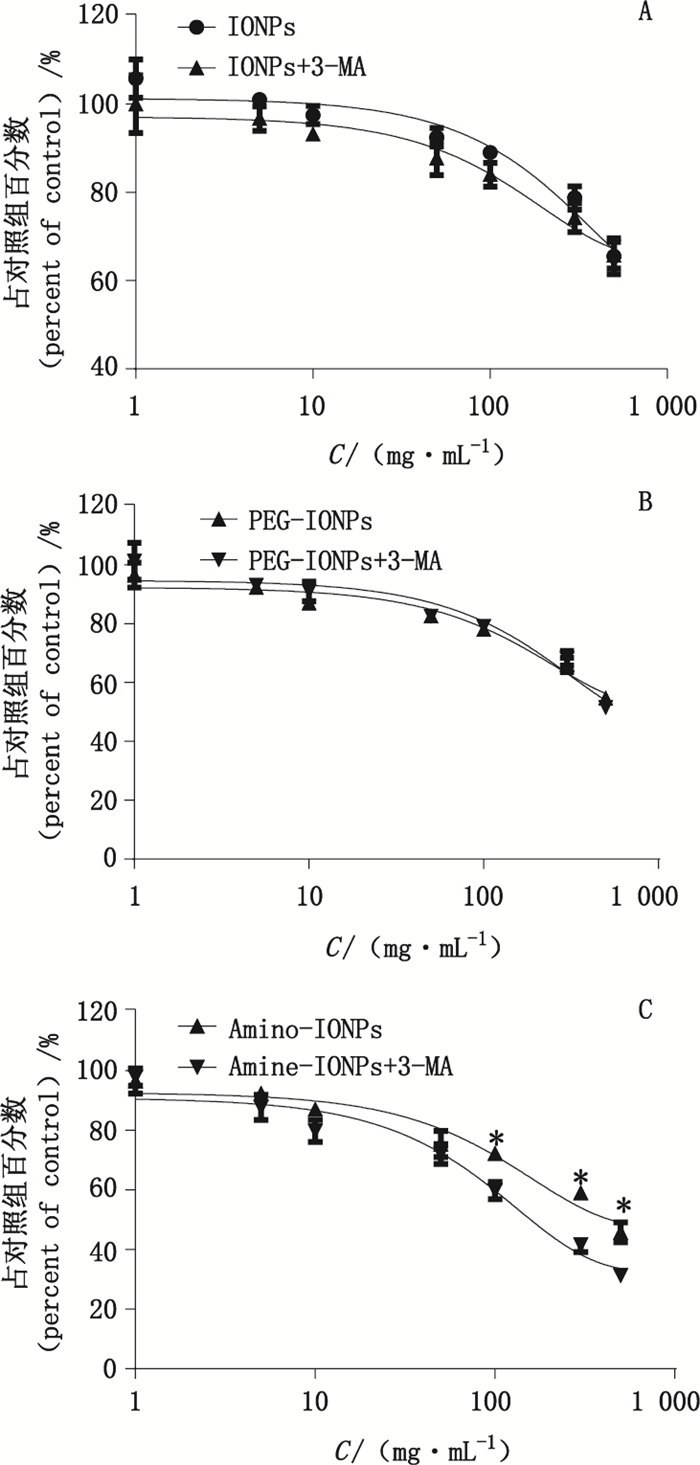
|
图 1 IONPs(A)、PEG-IONPs(B)和Amine-IONPs(C)对U87生长抑制作用和用3-MA抑制自噬后细胞生长抑制的变化(*P < 0.05) Figure 1 The growth inhibition of IONPs(A), PEG-IONPs(B) and Amine-IONPs(C) on U87 and the effect of 3-MA(autophagy inhibition)on U87 cell viability(*P < 0.05) |
本实验研究了Amine-IONPs、PEG-IONPs和IONPs在不同浓度下对U87诱导自噬作用。如图 2-A所示,Amine-IONPs、PEG-IONPs和IONPs在低剂量都能够诱导少量自噬,且Amino-IONPs的诱导自噬能力略高于PEG-IONP和IONP。如图 2-B所示,Amine-IONPs、PEG-IONPs和IONPs在中剂量都能够诱导较高的自噬,且Amino-IONP的诱导自噬能力显著性高于PEG-IONPs和IONPs(黑色柱状图)。如图 2-C所示,Amine-IONPs、PEG-IONPs和IONPs在中高剂量诱导自噬的能力显著增加,且Amino-IONP的诱导自噬能力显著性高于PEG-IONPs和IONPs(黑色柱状图)。综合以上结果可以看出,中、高剂量3种不同表面修饰的IONPs都可以显著性诱导自噬,且Amino-IONPs诱导自噬能力最强。

|
A.10 μg·m L-1 B.50 μg·m L-1 C.200 μg·m L-1 图 2 不同浓度Amine-IONPs、PEG-IONPs和IONPs诱导U87自噬(*P < 0.05) Figure 2 Autophagy induction by different concentrations of Amine-IONPs, PEG-IONPs and IONPs on U87(*P < 0.05) |
U87经IONPs、PEG-IONPs和Amine-IONPs(10、50和200 μg·m L-1)孵育24 h后,分别利用流式细胞方法测定其诱导细胞凋亡的情况,包括早期凋亡和晚期凋亡。U87诱导总凋亡量结果显示,Amine-IONPs诱导U87凋亡的能力在低、中、高3个剂量都显著性高于IONPs和PEG-IONPs;PEG-IONPs在中剂量诱导凋亡显著性高于IONPs(见图 3)。在低剂量加入自噬抑制剂后,进一步观察IONPs、PEG-IONPs和Amine-IONPs诱导凋亡显著性增高,说明自噬在低剂量起到保护的作用。与此同时,加入自噬诱导剂可以显著性降低Amine-IONPs诱导的凋亡,说明低剂量时自噬、凋亡的调控关系(见图 3-A)。在中剂量加入自噬抑制剂后,IONPs、PEG-IONPs和Amine-IONPs诱导凋亡都有所降低,但没有显著性变化,说明自噬在中剂量起促进凋亡作用,与其在低剂量作用相反。该结果在加入自噬诱导剂组得到进一步验证,结果显示诱导自噬可以显著性促进IONP和Amine-IONPs诱导凋亡的能力(见图 3-B)。在高剂量加入自噬抑制剂之后对3种IONPs作用不尽相同,Amine-IONPs诱导凋亡能力显著性降低,而IONPs和PEG-IONPs诱导凋亡能力变化不大。该结果说明高剂量自噬在不同表面修饰的IONPs调控凋亡作用存在差异。该结果在加入自噬诱导剂组做了进一步验证,结果显示,Amine-IONPs和IONPs诱导凋亡的能力显著性增高(见图 3-C)。

|
图 3 抑制自噬、诱导自噬对不同剂量IONPs、PEG-IONPs和Amine-IONPs在诱导U87的总凋亡量的影响(*表示与其他3组有显著性差异,#显著性低于200 μg·m L-1 Amino-IONPs组和200 μg·m L-1 Amino-IONPs+ RAP组,*# P < 0.05) Figure 3 The effect of autophagy induction and inhibition on U87 apoptosis induced by IONPs、PEG-IONPs and Amine-IONPs(*significantly different among three groups, #significantly lower than 200 μg·m L-1 Amino-IONPs group and 200 μg·m L-1 Amino-IONPs +RAP组, *# P < 0.05) |
研究表明,颗粒的物理性质、化学性质、表面结构、表面修饰、表面电荷分布都能直接影响其与细胞的交互作用[13]。本文深入研究了3种不同表面修饰的IONPs对胶质瘤的抑制杀伤作用差异以及自噬对凋亡的调控作用。首先研究发现3种IONPs均可抑制U87的增殖,并呈明显的剂量相关性,然后利用自噬抑制剂研究自噬对3种IONPs诱导凋亡的影响;进一步利用自噬检测试剂盒结合高内涵研究发现3种IONPs都可以在中高剂量诱导自噬;最后用流式细胞仪深入分析了3种IONPs诱导U87凋亡和自噬在不同剂量调控凋亡的差异。结果发现Amine-IONPs抑制细胞生长的作用最明显,诱导凋亡杀伤细胞的能力最强。在低剂量时,自噬可以起到保护作用,有效降低IONPs诱导的细胞凋亡,然而在高剂量时,自噬反而可以促进Amine-IONPs诱导凋亡。自噬在Amine-IONPs诱导凋亡中起到了双向调节作用,其对Amine-IONPs诱导凋亡在不同剂量也体现出了不同的双向调节作用。自噬在中、高剂量对PEG-IONPs诱导的凋亡影响不大。该结果表明IONPs对U87的抑制杀伤作用与其表面修饰密切相关。
Stern等提出了纳米颗粒诱导自噬中枢神经系统的作用机制与纳米颗粒暴露时间关系的假说[14]。纳米颗粒高水平长时间暴露会诱导激活氧化应激和炎症反应,引起损坏性自噬,诱导中枢神经系统细胞死亡[14]。最新研究表明纳米晶体富勒烯在低浓度诱导ROS介导的保护性胶质瘤细胞自噬,当暴露浓度增高时则诱导细胞死亡[15]。以往研究发现纳米颗粒诱导自噬对细胞凋亡有双向调节作用,与本研究结果相互印证。在低剂量,自噬起到保护作用,抑制IONPs诱导的U87凋亡,然而在高剂量,自噬促进IONPs诱导的U87凋亡,其中氨基修饰的IONPs作用最为明显。
氨基修饰的IONPs对于诱导U87的凋亡在3种颗粒中最强,其中Amine-IONPs诱导的凋亡受自噬调节最为显著。该结果与细胞生长抑制结果相互印证,表明Amine-IONPs在诱导U87凋亡方面及其自噬对凋亡影响比其他2种IONPs更为显著。颗粒表面的化学性质对纳米颗粒与细胞接触时两者间的吸附起主导作用[16-18]。由于细胞膜表面呈负电性,而Amine-IONP携带正电荷,带正电的纳米颗粒通常可以获得更高的摄入效率[16, 19-20]。Amine-IONPs表面带小量正电与IONPs和PEG-IONPs相比更容易与U87表面相互作用从而进入细胞内起到诱导自噬和杀伤细胞的效果。聚乙二醇表面修饰会降低IONPs颗粒聚集和细胞识别,从而降低其对自噬的诱导和杀伤细胞的能力。
综上所述,3种不同表面修饰的IONPs均可以有效地杀死U87,自噬在诱导细胞凋亡中起到了重要作用。其中,氨基修饰的纳米颗粒对细胞杀伤能力最强,且自噬在低高剂量调节Amine-IONPs诱导的细胞杀伤上有双向调节作用。该实验结果为未来合理设计纳米颗粒表面修饰,有效提高IONPs对胶质瘤杀伤能力提供了理论基础。
| [1] |
JIANG W, XIE H, GHOORAH D, et al. Conjugation of functionalized SPIONs with transferrin for targeting and imaging brain glial tumors in rat model[J]. PLoS One, 2012, 7(5): e37376. DOI:10.1371/journal.pone.0037376 |
| [2] |
XIE H, ZHU YH, JIANG WL, et al. Lactoferrin-conjugated superparamagnetic iron oxide nanoparticles as a specific MRI contrast agent for detection of brain glioma in vivo[J]. Biomaterials, 2011, 32(2): 495. DOI:10.1016/j.biomaterials.2010.09.024 |
| [3] |
IACOB G, DINCA EB. Current data and strategy in glioblastoma multiforme[J]. J Med Life, 2009, 2(4): 386. |
| [4] |
YANASE M, SHINKAI M, HONDA H, et al. Intracellular hyperthermia for cancer using magnetite cationic liposomes:ex vivo study[J]. Jpn J Cancer Res, 1997, 88(7): 630. DOI:10.1111/cas.1997.88.issue-7 |
| [5] |
SILVA AC, OLIVEIRA TR, MAMANI JB, et al. Application of hyperthermia induced by superparamagnetic iron oxide nanoparticles in glioma treatment[J]. Inter J Nanomed, 2011, 6(1): 591. |
| [6] |
MCCARTHY JR, WEISSLEDER R. Multifunctional magnetic nanoparticles for targeted imaging and therapy[J]. Adv Drug Deliv Rev, 2008, 60(11): 1241. DOI:10.1016/j.addr.2008.03.014 |
| [7] |
CHEN YB, EILEEN MW, KONG JM, et al. Mitochondrial electron-transport-chain inhibitors of complexes Ⅰ and Ⅱ induce autophagic cell death mediated by reactive oxygen species[J]. J Cell Sci, 2007, 120(Pt 23): 4155. |
| [8] |
LIIKANEN I, AHTIAINEN L, HIRVINEN ML, et al. Oncolytic adenovirus with temozolomide induces autophagy and antitumor immune responses in cancer patients[J]. Mol Ther, 2013, 21(6): 1212. DOI:10.1038/mt.2013.51 |
| [9] |
AZAD MB, CHEN Y, GIBSON SB. Regulation of autophagy by reactive oxygen species(ROS):implications for cancer progression and treatment[J]. Antioxid Redox Signal, 2009, 11(4): 777. DOI:10.1089/ars.2008.2270 |
| [10] |
LIN CJ, LEE CC, SHIH CM, et al. Resveratrol enhances the therapeutic effect of temozolomide against malignant glioma in vitro and in vivo by inhibiting autophagy[J]. Free Radic Biol Med, 2012, 52(2): 377. DOI:10.1016/j.freeradbiomed.2011.10.487 |
| [11] |
LI L, ISHDORJ G, GIBSON SB. Reactive oxygen species regulation of autophagy in cancer:implications for cancer treatment[J]. Free Radic Biol Med, 2012, 53(7): 1399. DOI:10.1016/j.freeradbiomed.2012.07.011 |
| [12] |
淡墨, 赵继云, 齐乃松, 等. 不同表面修饰的纳米氧化铁颗粒诱导胶质瘤细胞凋亡的差异[J]. 中国新药杂志, 2016, 25(24): 2887. DAN M, ZHAO JY, QI NS, et al. Iron oxide nanoparticles with different surface modifications induce apoptosis of glioma cells differently[J]. Chin J New Drugs, 2016, 25(24): 2887. |
| [13] |
王九令, 孙佳姝, 施兴华. 纳米颗粒与细胞的交互作用[J]. 科学通报, 2015, 60(21): 1976. WANG JL, SUN JS, SHI XH. Nannoparticle and cell interaction[J]. Chin Sci Bull, 2015, 60(21): 1976. |
| [14] |
STERN ST, JOHNSON DN. Role for nanomaterial-autophagy interaction in neurodegenerative disease[J]. Autophagy, 2008, 4(8): 1097. DOI:10.4161/auto.7142 |
| [15] |
LI ZS, SHI KJ, GUAN L, et al. ROS leads to MnSOD upregulation through ERK2 translocation and p53 activation in selenite-induced apoptosis of NB4 cells[J]. FEBS Lett, 2010, 584(11): 2291. DOI:10.1016/j.febslet.2010.03.040 |
| [16] |
VERMA A, STELLACCI F. Effect of surface properties on nanoparticle-cell interactions[J]. Small, 2010, 6(1): 12. DOI:10.1002/smll.v6:1 |
| [17] |
NEL AE, MADLER L, VELEGOL D, et al. Understanding biophysicochemical interactions at the nano-bio interface[J]. Nat Mater, 2009, 8(7): 543. DOI:10.1038/nmat2442 |
| [18] |
CHEN B. Probing the effect of random adhesion energy on receptor-mediated endocytosis with a semistochastic model[J]. J Appl Mech, 2014, 81(8): 081013. DOI:10.1115/1.4027739 |
| [19] |
CHO EC, XIE JW, WURM PA, et al. Understanding the role of surface charges in cellular adsorption versus internalization by selectively removing gold nanoparticles on the cell surface with a I2/KI etchant[J]. Nano Lett, 2009, 9(3): 1080. DOI:10.1021/nl803487r |
| [20] |
LI Y, GU N. Thermodynamics of charged nanoparticle adsorption on charge-neutral membranes:a simulation study[J]. J Phys Chem B, 2010, 114(8): 2749. DOI:10.1021/jp904550b |
 2018, Vol. 38
2018, Vol. 38 
