单抗高度的特异性优势使其成为发展最为迅速的治疗性蛋白药物。单抗类制品的多种翻译后修饰可导致其电荷异质性,而某些电荷异质性由于对单抗稳定性及其生物学功能的发挥具有重要影响而成为关键质量属性(CQA)[1-5]。
单抗电荷异质性的检测技术包括离子色谱、区带电泳以及等电聚焦等。等电聚焦技术按发明时间顺序包括平板等电聚焦电泳(Isoelectric focusing,IEF)、毛细管等电聚焦电泳(capillary isoelectric focusing,CIEF)和成像毛细管等电聚焦电泳(imaging capillary isoelectric focusing electrophoresis,iCIEF)。IEF、CIEF、iCIEF都可以作为表征蛋白质电荷异质性的工具。最早出现的IEF由于存在操作复杂,时间长以及分辨率相对较低等缺点,已逐渐被新技术所替代;CIEF在聚焦完成后需要1个额外的移动过程来把毛细管内聚焦完成的蛋白推到检测器窗口,对于电荷异质性较为复杂的样品类型,这个移动过程可能造成样品谱带展宽,变型,出现裂峰,从而影响到样品的重现性;iCIEF可对整个毛细管柱进行实时扫描,克服了常规毛细管聚焦电泳技术谱带展宽变形的问题。该技术使等电聚焦时间显著缩短,分析结果重复性改善,已成为蛋白质药物开发领域中产品鉴别、稳定性监测和表征的工具方法[6-9],该技术也是治疗性单抗电荷异质性方面主要的分析方法之一[10-14]。单抗的主峰、酸性变异体、碱性变异体的等电点不同,iCIEF可通过测定不同变异体的等电点来评价其电荷异质性。
单抗的实测等电点一般与理论值有一定的差异,单抗等电点的测定值是基于所使用等电点标记物的回归计算;另外尿素为常用的添加剂,可增加蛋白溶解性,以避免聚焦过程中蛋白的凝聚沉淀;聚焦时间也为本技术的重要参数。
本研究利用iCIEF技术分析了常用添加剂(尿素)、聚焦时间对所选单抗等电点赋值结果,并比较了采用2个/6个pI标记物对抗HER2单抗、抗VEGF单抗主峰等电点赋值结果差异情况,为生物药研发企业对单抗等电点的标准制定及质量控制提供参考。
1 仪器与试剂 1.1 仪器配备有自动进样器的毛细管等电点聚焦分析仪(iCE280 Analyzer),购自Protein Simple;FC涂层cIEF柱(5 cm×100 μm,货号101701)购自ProteinSimple;自动进样玻璃瓶(250 μL)和自动进样瓶(4 mL)购自ProteinSimple。
1.2 单抗及主要试剂单抗为抗HER2单抗、抗VEGF单抗,实验室留样;尿素(货号JT4206-1)购自JT Baker;载体两性电解质Pharmalyte 3-10(货号17-0456-01)购自GE Healthcare;pI标记物4.22(货号102350)、5.12(货号102224)、6.14(货号102220)、7.05(货号102226)、9.50(货号101996)、9.77(货号102219),1%甲基纤维素(MC)溶液(货号101876),0.5%甲基纤维素(MC)溶液(货号102505),电解液套件(货号102506),iCE系统适用性套件(货号102093),均购自Protein Simple。
2 实验方法 2.1 抗HER2单抗等电点影响因素分析 2.1.1 单抗处理将单抗用超纯水稀释至1 mg·mL-1。
2.1.2 供试品溶液制备 2.1.2.1 含尿素的供试品溶液将50 μL抗体与70 μL的1%甲基纤维素,各1 μL的pI标记物4.22、pI标记物5.12、pI标记物6.14、pI标记物7.05、pI标记物9.50、pI标记物9.77,8 μL的Pharmalytes 3-10,50 μL的8 mol·L-1尿素和16 μL超纯水混匀,12 000 r·min-1离心5 min,即得。
2.1.2.2 不含尿素的供试品溶液将50 μL抗体与70 μL的1%甲基纤维素,各1 μL的pI标记物4.22、pI标记物5.12、pI标记物6.14、pI标记物7.05、pI标记物9.50、pI标记物9.77,8 μL的Pharmalytes 3-10,66 μL超纯水混匀,12 000 r·min-1离心5 min,即得。
2.2 抗VEGF单抗等电点影响因素分析 2.2.1 单抗处理同“2.1.1”项。
2.2.2 供试品溶液制备同“2.1.2”项。
2.3 成像毛细管等电聚焦电泳分析条件预聚焦电压1.5 kV,持续1 min;聚焦电压3 kV,持续6 min/8 min/10 min,样品管理器温度设置为8 ℃。
3 结果 3.1 抗HER2单抗等电点影响因素分析结果 3.1.1 聚焦时间对等电点赋值的影响利用6个pI标记物像素值做线性回归(R2≥0.990),计算不同聚焦时间对单抗主峰pI的影响,结果见表 1,聚焦时间分别为6、8、10 min,等电点测定结果差异≤0.05 pI单位,对等电点最终赋值结果影响较小。
|
|
表 1 不同聚焦时间的抗HER2单抗主峰pI值(n=3) Table 1 Main peak pI value of anti-HER2 mab by different focusing time |
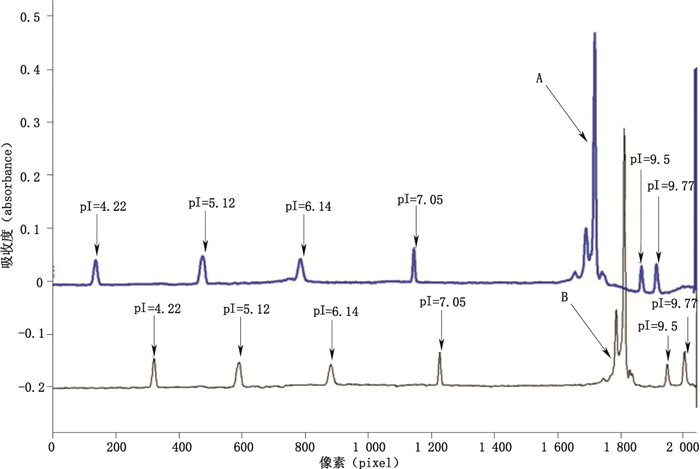
以280 nm下吸收值为纵坐标,以像素值为横坐标,抗HER2单抗叠加含尿素/不含尿素,聚焦10 min的成像毛细管等电聚焦图谱见图 1,谱图基本一致。
|
A.含尿素(with urea,2 mol·L-1),6个pI标记物(six pI markers),聚焦电压(focusing voltage)3 kV,聚焦时间(focusing time)10 min B.无尿素(without urea),6个pI标记物(six pI markers),聚焦电压(focusing voltage)3 kV,聚焦时间(focusing time)10 min 图 1 抗HER2单抗添加尿素/不添加尿素, 在聚焦10 min时的成像毛细管等电聚焦叠加图谱 Figure 1 Anti-HER2 mab with/without urea, iCIEF overlapping map focusing on 10 min |
添加2 mol·L-1尿素,10 min聚焦,不同的pI标记物组合所测得的抗HER2单抗的等电点最小为9.00,最大为9.14,差异达到0.14;无尿素添加,10 min聚焦,不同的pI标记物组合所测得的抗HER2单抗的等电点最小为9.04,最大为9.17,差异达到0.13。见表 2。
|
|
表 2 不同pI标记物组合计算抗HER2单抗主峰pI值(n=3) Table 2 Calculate pI value of anti-HER2 mab main peak by combination of different pI markers |
利用6个pI标记物像素值做线性回归(R2≥0.990),计算不同聚焦时间对单抗主峰pI的影响,结果见表 3,聚焦时间分别为6、8、10 min,等电点测定结果差异≤0.05 pI单位,对等电点最终赋值结果影响较小。
|
|
表 3 不同聚焦时间的抗VEGF单抗主峰pI值(n=3) Table 3 Main peak pI value of anti-VEGF mab at different focusing time |
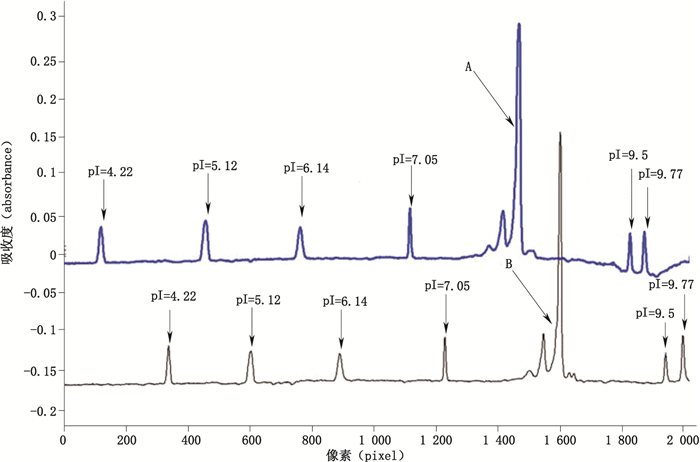
以280 nm下吸收值为纵坐标,以像素值为横坐标,抗VEGF单抗叠加含尿素/不含尿素,聚焦10 min的成像毛细管等电聚焦图谱见图 2,可见谱图峰形基本一致。
|
A.含尿素(with urea,2 mol·L-1),6个pI标记物(six pI markers),聚焦电压(focusing voltage)3 kV,聚焦时间(focusing time)10 min B.无尿素(without urea),6个pI标记物(six pI markers),聚焦电压(focusing voltage)3 kV,聚焦时间(focusing time)10 min 图 2 抗VEGF单抗添加尿素/不添加尿素,在聚焦10 min时的成像毛细管等电聚焦叠加图谱 Figure 2 Anti-VEGF mab with/without urea, iCIEF overlapping map focusing on 10 min |
添加2 mol·L-1尿素,10 min聚焦,不同的pI标记物组合所测得的抗VEGF单抗的等电点最小为8.26,最大为8.48,差异达到0.22;无尿素添加,10 min聚焦,不同的pI标记物组合所测得的抗VEGF单抗的等电点最小为8.34,最大为8.49,差异达到0.15。见表 4。
|
|
表 4 不同pI标记物组合计算抗VEGF单抗主峰pI值(n=3) Table 4 Calculate pI value of anti-VEGF mab main peak by combination of different pI markers |
蛋白质的等电点是其内在属性之一,其定义为蛋白质带电荷为零时的pH。一级序列的各氨基酸的pKa值为蛋白质理论等电点的计算基础,所以要计算其理论等电点,应知晓其氨基酸序列。由于蛋白质理论计算的等电点首先假设蛋白质为无规则卷曲结构,不能反映氨基酸间的空间结构关系,同时,氨基酸的pKa值也取决于其周围环境,如疏水性等,所以实测的等电点与理论计算值是有差异的。
蛋白质绝对等电点的实测方法有多种,如利用阳离子去垢剂可沉淀带负电荷的蛋白质,但是这些方法操作烦琐,而且不能反映蛋白质的电荷异质性全景图。质控中所应用的IEF、CIEF、iCIEF方法,蛋白质等电点的计算依赖于2个或多个pI标记物的回归计算,所以所测得的等电点依赖于所用的pI标记物所标注等电点的准确性,在本研究中,2个不同的pI标记物组合所测得的抗HER2单抗的等电点差异最大为0.14,而对于抗VEGF单抗,其差异达到最大为0.22。虽然针对文中所用的6个pI标记物组合所做的回归曲线相关系数良好,但是不同的2个pI标记物组合所测得的等电点相差还是比较大,可见所实测的蛋白质等电点仍为相对于pI标记物的pI值。因此,应用iCIEF评价同一个抗体制品的等电点,在方法开发、批间一致性评价、放行等阶段应采用相同的pI标记物组合。
在等电聚焦过程中蛋白质的沉淀为常见现象,这是由于在蛋白质等电聚焦过程中蛋白质的高度浓缩易使蛋白质发生聚集,可导致谱图异常和不可重复。尿素为常见的非离子型去垢剂,在≤4 mol·L-1的浓度下,可有效解离蛋白质的非共价键连接,从而防止蛋白质的聚集和沉淀。本文中所研究的2个单抗对象在未加尿素的情况下并未产生聚集和谱图异常,所以是研究尿素添加对等电点影响的良好实例。本研究结果表明,对于文中所述的2个单抗研究对象,添加尿素对实测的等电点数值影响并不大。
聚焦时间也是iCIEF实验过程中的重要参数之一,聚焦为动态过程,理论上蛋白质到达其等电点位置不再移动,谱图表现为峰形固定。本研究中比较了6 min(峰形已固定)、8 min、10 min对于等电点测定的影响,结果表明三者相差很小,证明对文中的抗HER2单抗与抗VEGF单抗来说,6 min即已完成异构体的聚焦分离,延长聚焦时间对等电点计算并没有显著影响。同时需要注意,因聚焦过程是在高电压条件下,过度延长聚焦时间将加大样品凝聚沉淀的可能性。因此,聚焦时间的确定以峰形不再发生变化为准,峰形固定后可判定完成了电荷异构体的分离并可进行相对等电点的计算。
综上所述,利用iCIEF所测得的单抗等电点为相对值,依赖于所采用的实验系统(iCIEF检测仪器;pI标记物组合的选择;两性电解质等其他试剂),尤其是所采用的pI标记物,并不能十分准确地反映其理论值或者真实值,所以应充分理解通过iCIEF所测得pI值的含义。在单抗的放行检测中,由于参比品经过充分的表征,作者认为在同一体系和序列中,用iCIEF所测得的样品与参比品等电点差值评价二者的差异更合理,若二者差异在所制定的合理范围内,并且谱图一致,可认为样品与参比品一致。生物类似药的等电点鉴别也是如此,因并不知道原研药采用的实验系统,所以更不能直接使用其质量标准中的等电点值。
由于单抗制品高度复杂的异质性,其质控需要组合多种理化分析技术对其进行检测。iCIEF为单抗制品的电荷异质性分析提供了一个快速、灵敏的选择,对保证单抗类生物技术药物生产工艺的稳定性及控制其质量和提高质量标准均具有重要意义[15]。对于其结果的判定应认识到,其等电点的测定为相对值,对质量标准的设定和判定标准应有科学理性的认识。
| [1] |
CHRISTIANSEN J, RAJASEKARAN AK. Biological impediments to monoclonal antibody-based cancer immunotherapy[J]. Mol Cancer Ther, 2004, 3(11): 1493. |
| [2] |
KÖHLER G, MILSTEIN C. Continuous cultures of fused cells secreting antibody of predefined specificity[J]. Nature, 1975, 256(5517): 495. DOI:10.1038/256495a0 |
| [3] |
BREEN ED, CURLEY JG, OVERCASHIER DE, et al. Effect of moisture on the stability of a lyophilized humanized monoclonal antibody formulation[J]. Pharm Res, 2001, 18(9): 1345. DOI:10.1023/A:1013054431517 |
| [4] |
BECK A, WURCH T, BAILLY C, et al. Strategies and challenges for the next generation of therapeutic antibodies[J]. Nat Rev Immunol, 2010, 10(5): 345. DOI:10.1038/nri2747 |
| [5] |
FEKETE S, GUILLARME D, SANDRA P, et al. Chromatographic, electrophoretic, and mass spectrometric methods for the analytical characterization of protein biopharmaceuticals[J]. Anal Chem, 2016, 88(1): 480. DOI:10.1021/acs.analchem.5b04561 |
| [6] |
RUSTANDI RR, PEKLANSKY B, ANDERSON CL. Use of imaged capillary isoelectric focusing technique in development of diphtheria toxin mutant CRM197[J]. Electrophoresis, 2014, 35(7): 1065. DOI:10.1002/elps.v35.7 |
| [7] |
SOSIC Z, HOUDE D, BLUM A, et al. Application of imaging capillary IEF for characterization and quantitative analysis of recombinant protein charge heterogeneity[J]. Electrophoresis, 2008, 29(21): 4368. DOI:10.1002/elps.v29:21 |
| [8] |
ANDERSON CL, WANG Y, RUSTANDI RR. Applications of imaged capillary isoelectric focusing technique in development of biopharmaceutical glycoprotein-based products[J]. Electrophoresis, 2012, 33(11): 1538. DOI:10.1002/elps.201100611 |
| [9] |
SALAS-SOLANO O, KENNEL B, PARK SS, et al. Robustness of iCIEF methodology for the analysis of monoclonal antibodies:an inter laboratory study[J]. J Sep Sci, 2012, 35(22): 3124. DOI:10.1002/jssc.201200633 |
| [10] |
RUSTANDI RR, ANDERSON C, HAMM M, et al. Application of capillary electrophoresis in glycoprotein analysis[J]. Methods Mol Biol, 2013, 988: 181. DOI:10.1007/978-1-62703-327-5 |
| [11] |
GOYON A, EXCOFFIER M, JANIN-BUSSAT MC, et al. Determination of isoelectric points and relative charge variants of 23 therapeutic monoclonal antibodies[J]. J Chromatogr B, 2017, 1065-1066: 119. DOI:10.1016/j.jchromb.2017.09.033 |
| [12] |
JANINI G, SAPTHARISHI N, WASELUS M, et al. Element of a validation method for MU-B3 monoclonal antibody using an imaging capillary isoelectric focusing system[J]. Electrophoresis, 2002, 23(11): 1605. DOI:10.1002/1522-2683(200206)23:11<1605::AID-ELPS1605>3.0.CO;2-O |
| [13] |
SALAS-SOLANO O, KENNEL B, PARK SS, et al. Intercompany study to evaluate the robustness of capillary isoelectric focusing technology for the analysis of monoclonal antibodies[J]. Methods Mol Biol, 2011, 73: 1137. |
| [14] |
WU J, WU XZ, HUANG T, et al. Analysis of proteins by CE, CIEF, and microfluidic devices with whole-column-imaging detection[J]. Methods Mol Biol, 2004, 276: 229. |
| [15] |
于传飞, 郭玮, 王兰, 等. 成像毛细管等点聚焦电泳法对单抗制品的电荷异质性分析[J]. 药物分析杂志, 2014, 34(7): 1212. YU CF, GUO W, WANG L, et al. Charge heterogeneity analysis of monoclonal antibody products with imaging capillary isoelectric focusing electrophoresis[J]. Chin J Pharm Anal, 2014, 34(7): 1212. |
 2018, Vol. 38
2018, Vol. 38 
