2. 中国食品药品检定研究院国家药物安全评价监测中心, 药物非临床安全评价研究北京市重点实验室, 北京 100176;
3. 中国食品药品检定研究院中药民族药检定所, 北京 100050
2. National Center for Safety Evaluation of Drugs, National Institutes for Food and Drug Control, Key Laboratory of Beijing for Nonclinical Safety Evaluation Research of Drugs, Beijing 100176, China;
3. Institute for Control of Chinese Traditional Medicine and Ethnic Medicine, National Institutes for Food and Drug Control, Beijing 100050, China
蓼科何首乌(Polygonum multiflorum Thunb.)为多年生藤本植物,具有补益精血,乌须发,强筋骨,补肝肾等功效,与人参、灵芝、冬虫夏草并称为“四大仙草”,是常见的贵细中药材[1]。自2004年起,逐渐出现关于何首乌的临床肝损伤的案例报道[2-3],何首乌的用药安全性问题受到社会高度关注。大黄蒽醌类(anthraquinones,AQs),包括大黄素、大黄素甲醚、大黄酚、芦荟大黄素、大黄素甲醚-8-β-D-(6’-O-乙酰基)-葡萄糖苷和大黄素-3-甲醚-8-O-β-D-葡萄糖苷等[4-5],是何首乌的主要成分,前期研究提示游离蒽醌与何首乌肝毒性有关[6]并有学者提出“蒽醌致毒”的概念。此外,大黄蒽醌类化合物结构中存在的蒽醌环为遗传毒性可疑结构,体外遗传毒性研究也提示其可能存在诱导DNA断裂和染色体损伤作用[7]。
目前针对大黄素类单体的肝毒性研究多使用体外培养细胞,而体内肝脏研究较少。大黄素甲醚是何首乌的主要成分(何首乌药材中大黄素甲醚含量范围约为0.11~0.62 mg·g-1[8]),也是蒽醌类化合物主要体内代谢产物之一[9-10]。本研究通过连续14 d经口灌胃给予SD大鼠大黄素甲醚,观察动物临床症状并分析体质量、血清生化指标、肝脏质量及病理学指标,对大黄素甲醚的整体毒性和潜在肝毒性进行评价。研究同时联合开展肝细胞和骨髓微核试验及肝细胞和外周血彗星试验,从而综合体内整体毒性、肝脏毒性和其潜在肝细胞染色体损伤和DNA断裂效应3个不同层面,对大黄素甲醚的潜在体内毒性进行评估。
1 仪器与材料 1.1 实验仪器H500FR台式高速冷冻离心机(Kokusan公司);MINI AM4290尿分析仪(京都Aution公司);ADVIA120血液分析仪和Rapidchem744电解质分析仪(拜耳公司);MICROX SPINNER离心涂片机(Onron公司);CA-1500血凝分析仪(Sysmex公司);7180型全自动生化分析仪(日本日立公司);樱花TEC5EMJ-2型自动包埋机和DRS-2000自动染色机及封片机(Sakura公司);显微镜(Olympus公司);DYCP-31F型电泳仪和DYY-6C电泳仪电源(北京市六一仪器厂);NTS-1300恒温振荡水槽(东京理化器械株式会社);Komet 6.0图像分析系统(英国安道尔科技有限公司);Nikon eclipse 80i荧光显微镜(尼康公司)。
1.2 材料与试剂大黄素甲醚对照品(批号110758-201616,含量99.0%,中国食品药品检定研究院)。阴性对照品:羧甲基纤维素钠(CMC-Na)溶液,由MilliQ-A10超纯水机生产的超纯水与羧甲基纤维素钠(Sigma)配制而成;遗传毒性阳性剂:甲磺酸乙酯(ethyl methanesulphonate,EMS,Sigma);Trevigen Comet Assay® Kit彗星检测试剂盒(Trevigen);EDTA-2Na(Sigma);HBSS(Cellgro);PBS(Cellgro);无水乙酸、无水甲醇(国药集团化学试剂有限公司);胎牛血清(Gibco);SYBR Green I Nuclei Acid Gel Stain(Invitrogen);Giemsa染料(Sigma),染色前用1/15 mol·L-1磷酸盐缓冲液(pH 6.8)配制成5% Giemsa应用液;吖啶橙(Fluka),染色时将0.1%吖啶橙染液与1/15 mol·L-1磷酸盐缓冲液(pH 6.8)按1:15的比例配制成应用液;血清生化检测试剂(北京中生生物工程公司)。
1.3 动物来源、饲养条件20只SPF级雄性SD大鼠(给药时约6周龄),购自北京维通利华实验动物技术有限公司,实验动物许可证号SCXK(京)SCXK(京)2016-0006。大鼠在屏障系统内PC聚碳酸酯鼠盒饲养(北京科澳协力饲料有限公司),提供60钴放射灭菌鼠全价颗粒饲料,自由摄取。饲养环境保持温度20~26 ℃,湿度40%~70%,每小时换气15次以上,照明时间每天12 h。试验方案通过国家药物安全评价监测中心实验动物福利伦理委员会的伦理审查。
2 实验方法 2.1 动物分组及给药所有动物在检疫期结束后,根据体质量随机分为0.5% CMC-Na溶媒对照组、6.5 mg·kg-1剂量组、65 mg·kg-1剂量组、650 mg·kg-1剂量组和EMS阳性剂组。本研究为对大黄素甲醚体内毒性的初步探索,考虑试验动物使用“减少、替代和优化”的3R原则(Reduction,Replacement and Refinement),每组设4只用于统计分析。分组时动物体质量约200 g,个体体质量差异小于平均体质量的±20%。溶媒对照组和大黄素甲醚各剂量组连续14 d经口灌胃给药,给药体积为15 mL·kg-1;EMS阳性对照组(200 mg·kg-1)给药方式为连续3 d经口灌胃,给药体积为10 mL·kg-1。EMS阳性对照组动物仅用作遗传毒性试验对照。
2.2 口服给药剂量何首乌人临床每日最大用量约为每人100 g生药[11],即1.7 g·kg-1(以生药计)。其中大黄素甲醚在生药中含量以0.62 mg·kg-1计,为1.05 mg·kg-1。根据大鼠与人体表面积系数(6.17)折算,相当于6.5 mg·kg-1。以该剂量为最低剂量,分别设置6.5、65和650 mg·kg-1剂量组,约为人最大拟用剂量的1倍、10倍和100倍。
2.3 一般毒性及肝毒性检测溶媒对照组和大黄素甲醚各剂量组动物在给药期间每天观察动物临床症状,每周测定体质量2次。末次给药后动物禁食过夜,给药结束时所有动物以CO2吸入法麻醉,从腹腔后大静脉取血用于血清生化检测和彗星试验,采血量约1 mL·只-1。血清生化检测指标包括丙氨酸氨基转换酶(ALT)、天门冬氨酸氨基转换酶(AST)、碱性磷酸酶(ALP)、肌酸磷酸激酶(CK)、乳酸脱氢酶(LDH)、总胆红素(TBIL),采用Hitachi 7180型全自动生化仪检测。之后使用60 mL注射器缓慢推注0.9%氯化钠注射液进行肝脏灌流至肝脏膨起且颜色呈土黄色为止。动物完全放血处死后解剖,剖检时详细记录大体病理学的发现。对动物肝脏分离后称量,并使用10%甲醛固定组织标本。固定后的组织经修块取材,逐级酒精脱水,石蜡包埋,滑动切片机切片(厚约3 μm)。标本经苏木精-伊红(HE)染色后,在光镜下进行组织病理学检查。
2.4 遗传毒性试验 2.4.1 外周血及骨髓微核试验动物处死后取单侧股骨,剪断两端开放骨髓腔;吸取胎牛血清约1~2 mL,使用注射器针头冲洗骨髓至试管中,并反复抽吸针头数次吹打制成骨髓细胞悬液。样本经1 000 r·min-1离心5 min后,弃去大部分上清液,将骨髓细胞沉淀吹打均匀。吸取适量骨髓悬液滴于洁净玻片上推片,标本置于室温下干燥。玻片经甲醇固定15 min后晾干待检。每只动物骨髓样本计数200个总红细胞(erythrocyte,RBC)中嗜多染红细胞(polychromatic erythrocyte,PCE)和正染红细胞(normochromatic erythrocyte,NCE)的数目,以及2 000个嗜多染红细胞(PCE)中微核细胞(MN-PCE)的数目,分别计算嗜多染红细胞占总红细胞的百分率以及嗜多染红细胞的微核率。
取动物肝左叶约5 mm3大小组织,用刀片切成2~3 mm3小块,加入含0.05%胶原酶的HBSS溶液。样本在37 ℃水浴中震摇孵育1 h,每30 min人工用力震摇1次。使用移液器反复吹打消化后的细胞悬液50次,再经40 μm细胞筛过滤后,加入10%甲醛溶液3 mL固定,并以800 r·min-1离心1 min。弃上清,再次加入10%甲醛3 mL并重悬,样本于4 ℃条件保存待检。镜检前取细胞悬液10~20 μL,加入等体积的吖啶橙-DAPI溶液(吖啶橙:0.5 mg·mL-1;DAPI:10 μg·mL-1)进行荧光染色;取10~20 μL混合液滴片后加盖玻片,并在荧光显微镜下进行观察。每只动物的肝细胞样本中计数1 000个肝细胞中微核细胞率。
2.4.2 外周血与肝脏彗星试验采集大鼠外周血约50 μL备用。肝组织样本是采集肝左叶约2~3 mm3的组织,置于3 mL切碎液(含20 mmol·L-1 EDTA-2Na和10%DMSO的HBSS溶液)中,使用剪刀剪碎组织以释放细胞,并经40 μm滤膜过滤后置冰上备用。样本经制片、裂解、解旋、电泳、中和、脱水等步骤后制备成单细胞凝胶标本[12]。所有标本使用SYBR Green I(1:10 000)染色,并在放大倍数为200至400倍的荧光显微镜下拍照。使用Komet 6.0(Andor Technology)彗星图像分析软件进行分析,每只动物至少分析100个彗星细胞的细胞核彗星拖尾情况。计算每组动物尾DNA百分含量和Olive尾距的中位数平均值。
2.5 统计及数据分析各组动物体质量、脏器质量、血清生化指标、微核和彗星试验结果以平均值±标准差(SD)的形式列出。动物数表示为“n”。动物质重、肝脏质量、血清生化和彗星试验结果采用单因素方差分析对组间数据进行检验;微核试验结果采用卡方检验分析;P < 0.05时认为差异有统计学意义。病理学观察结果仅列出,不进行统计分析。数据图与统计结果经GraphPad Prism 7(Graphpad Software)软件处理生成。
3 实验结果 3.1 整体毒性分析试验期间,各组动物临床症状未见与给予受试物大黄素甲醚相关的明显异常改变。体质量变化是反映受试物毒性的一个重要指标。与对照组比较,大黄素甲醚各剂量组动物在不同时期的平均体质量(图 1)及脏器质量(表 1)未见显著性差异,结果提示在当前给药剂量和给药条件下,所有受试物均未对动物整体产生严重的毒性作用。
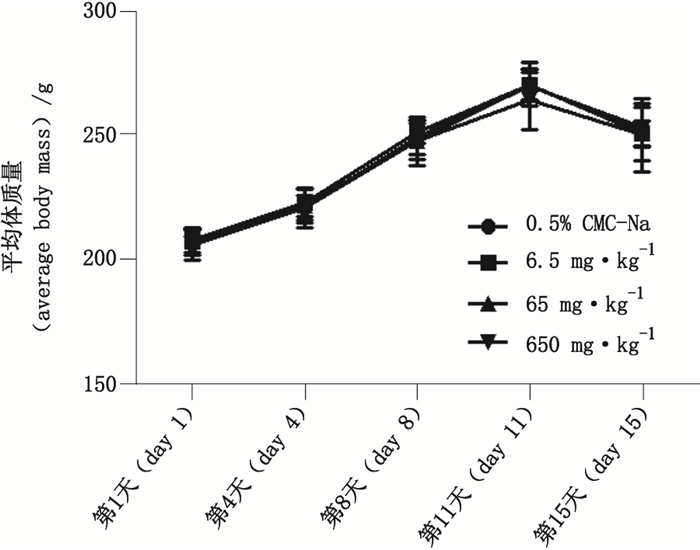
|
图 1 大黄素甲醚对SD大鼠体质量的影响 Figure 1 Effects of physcion on the body mass of SD rats |
|
|
表 1 连续给予大黄素甲醚后SD大鼠肝脏平均绝对质量及相对系数(平均值±SD,n=4) Table 1 Averaged absolute and relative liver mass of SD rats with repeated doses of physcion (mean±SD, n=4) |
给药结束后受试物大黄素甲醚对动物肝脏血清生化指标的影响见表 2,各给药组动物平均ALT、AST、ALP和TBIL浓度数值与对照组动物相应指标的均值比较均未见显著性改变;6.5、65和650 mg·kg-1剂量组动物平均CK浓度数值以及65和650 mg·kg-1剂量组动物平均LDH浓度数值与对照组动物相应指标比较,有所降低,但不提示为毒性反应。因此考虑连续14 d给予SD大鼠大黄素甲醚对与肝脏功能有关的主要血清生化指标无明显毒理学影响。组织病理学检查结果可见各剂量组动物散在存在肝脏极轻度小肉芽肿和极轻度汇管区单核细胞浸润,但未见剂量相关性,不提示上述病理学变化与大黄素甲醚作用有关。650 mg·kg-1剂量组1/4只动物肝脏见肝细胞大片中度弥散性变性坏死,因该病变发生率低,暂时无法确定与给予大黄素甲醚有关。
|
|
表 2 连续给予大黄素甲醚后大鼠与肝脏功能有关的血清生化指标数值(平均值±SD,n=4) Table 2 Serum biochemical data related to liver function in rats with repeated doses of physcion (mean±SD, n=4). |
大黄素甲醚的潜在致断裂性分别通过彗星试验和微核试验进行评价。分别以尾DNA百分含量和Olive尾距为指标,评价大黄素甲醚是否可诱导肝细胞DNA断裂,结果显示(表 3和图 2),与溶媒对照组比较[尾DNA百分含量为(2.23±0.55)%],连续给予大黄素甲醚14 d,大鼠肝细胞未产生DNA断裂[6.5、65和650 mg·kg-1剂量组尾DNA百分含量分别为(2.56±1.91)%、(3.12±1.36)%和(3.05±1.59)%,P > 0.05)。此外,外周血淋巴细胞的彗星试验结果也为阴性,大黄素甲醚未对细胞核的完整性产生影响,与肝细胞结果基本一致。肝细胞微核试验结果(表 4)提示,当前试验条件下,大黄素甲醚未诱导肝细胞出现显著染色体损伤(P > 0.05),对照组和6.5、65和650 mg·kg-1剂量组微核率分别为(0.13±0.13)%、(0.30±0.08)%、(0.23±0.15)%和(0.28±0.17)%。该结果与动物骨髓微核试验结果相符。
|
|
表 3 大鼠肝细胞和淋巴细胞彗星试验结果比较(平均值±SD,n=4) Table 3 Comparison of hepatocyte and lymphocyte comet assay data in rats (mean±SD, n=4) |
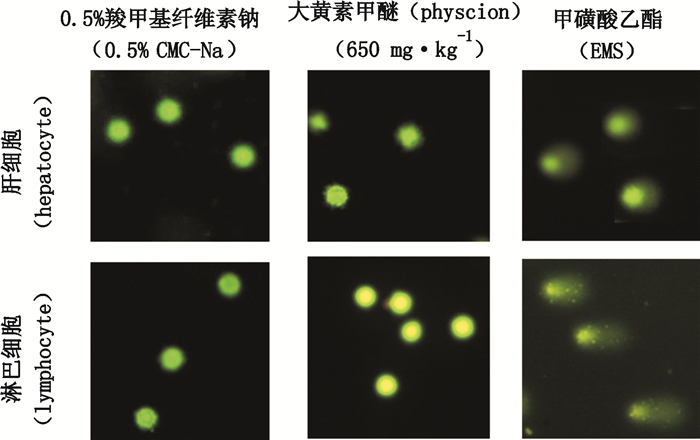
|
图 2 大鼠彗星试验肝细胞和淋巴细胞示意图 Figure 2 Representative images of hepatocyte and lymphocyte in comet assay in rats |
|
|
表 4 大鼠肝细胞和骨髓细胞微核试验结果比较(平均值±SD,n=4) Table 4 Comparison of hepatocyte and lymphocyte micronucleus test data in rats (mean±SD, n=4) |
根据前期研究数据,当单次给药剂量范围为26.4~105.6 mg·kg-1时,大鼠血浆中大黄素甲醚Cmax约为0.29~0.49μg·mL-1,Tmax约为1 h,AUC为1.9~3.3 μg·mL-1[13]。肝脏是大黄素甲醚体内主要靶器官,大鼠单次经口给予大黄素甲醚后肝脏中含量最高,其次为肾脏、脑、肺脏和心脏[14]。大黄素、大黄酚、3-羟甲基-1,6,8-三羟基蒽醌、3-甲酰基-1,6,8-三羟基蒽醌、3-羧基-1,6,8-三羟基蒽醌、3-羧基-6-甲氧基-1,8-二羟基蒽醌等游离蒽醌是其在尿液中的主要代谢产物[15]。当前针对何首乌不同提取部位及大黄素、大黄素甲醚等游离单体的体外毒理和药理作用研究较多,关于其潜在体内毒性的研究寥寥。而有关何首乌和大黄蒽醌类化合物体内研究的给药剂量设置往往较低,未能充分暴露其毒性。本研究以文献报道[11]的人体每日何首乌最大服用量100 g折算大黄素甲醚的给药量,给予大鼠的最大给药剂量约为人最大拟用剂量的100倍,动物连续给药14 d,可基本满足毒性暴露需要。
何首乌长期给药的肝毒性主要表现为肝细胞急性凋亡、坏死、变性、谷丙转氨酶及谷草转氨酶的升高[16],且前者升高幅度远高于后者,其病理学改变可包括炎细胞浸润、肝血窦充血、枯否氏细胞增生活跃等[17]。文献报道大黄素甲醚等蒽醌类化合物是何首乌主要毒性成分[18],Yu等[19]研究发现大黄素甲醚可通过诱导LDH漏出和转氨酶升高等肝细胞损伤。何首乌的毒性可能是大黄素甲醚等多种大黄蒽醌类单体协同作用的结果[20],且蒽醌类化合物的类肾上腺皮质激素样作用是何首乌主要毒性机制之一[21]。上述研究研究数据大多基于如正常人肝细胞L02或大鼠原代肝细胞等细胞毒性和转氨酶等功能检测。然而体外条件下培养的肝细胞的关键代谢酶和药物转运蛋白的表达有限,无法充分反映药物体内肝脏代谢过程。对于体外研究中发现的潜在毒性成分,有必要开展体内研究对其毒性进行验证。虽然大鼠的肝脏代谢过程与人体有差异,但体内研究的优势是可更为全面地反映药物的毒性效应。本研究连续14 d经口灌胃给予大鼠6.5、65和650 mg·kg-1的大黄素甲醚,未见动物出现异常临床症状,且未见给药对动物体重产生影响,提示当前给药条件对动物无明显整体毒性作用。试验期间动物肝脏功能相关的血清生化指标、肝脏质量未见显著性改变,未发现明确的与给予大黄素甲醚有关的组织病理学变化。当前剂量设计条件下,大黄素甲醚未见毒副反应剂量(no observable adverse effect level,NOAEL)为650 mg·kg-1。本研究针对大黄素甲醚潜在肝毒性进行了初期的探索,建议今后延长给药时间并增加动物数量,以进一步明确其体内毒性及作用机制。
大黄蒽醌类化合物存在遗传毒性可疑结构,该结构或可与DNA链作用并诱导DNA链发生断裂[22],其潜在遗传毒性也是研究关注点之一。然而其体外和体内研究结果存在一定差异,大黄蒽醌类化合物是否存在遗传毒性和潜在致癌性尚不明确。如研究提示大黄素可诱导DNA断裂和细菌回复性突变[23],但大鼠2年致癌试验结果显示大黄素并不诱导肝癌的产生[24]。大黄素甲醚在代谢活化条件下可诱导伤寒沙门氏菌TA1537和TA102的回复性突变率显著性升高[25],且与其代谢产物有关。本研究条件下,未见大黄素甲醚存在诱导SD大鼠肝细胞染色体损伤DNA断裂的作用。今后可通过开展Pig-a基因突变试验[26]或利用BigBlue®等啮齿类转基因动物模型对其体内致突变潜力作进一步评价和验证。
重复给药毒性试验与多终点遗传毒性评价方法相结合,可综合动物的一般毒性、脏器毒性和多器官的遗传毒性进行综合评价[27]。遗传毒性指导原则[28]指出,低毒性化合物给药时间不超过14 d时的推荐最高给药剂量为2 000 mg·kg-1·d-1,给药时间超过14 d时为1 000 mg·kg-1·d-1。本研究中最高给药剂量为650 mg·kg-1,却已达到大黄素甲醚可溶解条件下(高剂量配制浓度为43.3 mg·kg-1)及动物可耐受给药体积条件下(15 mL·kg-1,连续14 d)的最高给药剂量,即药物实际可给予的最高剂量。肝脏为药物主要的代谢器官,在传统的外周血和骨髓之外,以肝脏为检测对象进行遗传毒性评价可与重复给药毒性研究相结合,更为直接地观察到药物对靶器官的影响,并兼顾肝脏代谢对毒性的影响[29],尤其适合对中药等有蓄积性肝毒性或肝脏代谢可能对毒性产生影响的药物进行评价。该领域已逐渐引起重视,当前国际上已完成肝细胞彗星试验和肝细胞微核试验实验室间联合验证工作[30-31]。本研究遵照国际联合验证的试验方法开展相应彗星试验和微核试验,为在我国推广上述方法积累经验。
| [1] |
中华人民共和国药典2015年版.一部[S]. 2015: 175 ChP 2015.Vol Ⅰ[S].2015: 175 |
| [2] |
徐静, 汪茂荣, 何长伦, 等. 口服何首乌致肝损害40例临床分析[J]. 东南国防医药, 2009, 11(3): 209. XU J, WANG MR, HE CL, et al. Clinical analysis of 40 cases of liver damage caused by Radix Polygoni Multiflori[J]. Mil Med J Southeast China, 2009, 11(3): 209. |
| [3] |
英国MHRA警告何首乌的肝损害不良反应[J].中国药物警戒, 2006, 3(5): 313 British MHRA's warning of liver damage adverse reactions of Polygonum multiflorum[J].Chin J Pharmacovigil, 2006, 3(5): 313 http://www.cqvip.com/Main/Detail.aspx?id=22753861 |
| [4] |
李续娥, 刘金珠, 廖森泰, 等. 何首乌的酚类成分研究[J]. 热带亚热带植物学报, 2009, 17(6): 617. LI XE, LIU JZ, LIAO ST, et al. Study on phenols in Polygonum multiflorum[J]. J Trop Subtrop Bot, 2009, 17(6): 617. DOI:10.3969/j.issn.1005-3395.2009.06.018 |
| [5] |
王文静, 薛咏梅, 赵荣华, 等. 何首乌的化学成分和药理作用研究进展[J]. 云南中医学院学报, 2007, 30(3): 60. WANG WJ, XUE YM, ZHAO RH, et al. Research progress in chemical composition and pharmacology of Polygonum multiflorum[J]. J Yunnan Coll Tradit Chin Med, 2007, 30(3): 60. DOI:10.3969/j.issn.1000-2723.2007.03.023 |
| [6] |
王清秀, 吴纯启, 廖明阳. 大黄及其主要成分的毒性毒理研究[J]. 毒理学杂志, 2007, 21(4): 301. WANG QX, WU CQ, LIAO MY. Toxicity and toxicology of rhubarb and its main components[J]. J Toxicol, 2007, 21(4): 301. |
| [7] |
文海若, 毛志慧, 耿兴超, 等. 人源HepaRG肝细胞毒性与遗传毒性高通量筛选方法的初步建立[J]. 药物评价研究, 2017, 40(11): 1550. WEN HR, MAO ZH, GENG XC, et al. Preliminary establishment of a high-throughput screening method for HepaRG hepatocellular toxicity and genotoxicity in humans[J]. Drug Eval Res, 2017, 40(11): 1550. |
| [8] |
王志伟, 闫慧娇, 陈跃, 等. 氢核磁共振法测定何首乌中大黄素和大黄素甲醚的含量[J]. 药物分析杂志, 2016, 36(12): 2163. WANG ZW, YAN HJ, CHEN Y, et al. Determination of emodin and emodin in Radix Polygoni Multiflori by hydrogen nuclear magnetic resonance spectroscopy[J]. Chin J Pharm Anal, 2016, 36(12): 2163. |
| [9] |
孙阳, 陈琼华. 大黄素和大黄素甲醚在大鼠及小鼠体内的代谢转化[J]. 中国药科大学学报, 1985(1): 72. SUN Y, CHEN QH. Metabolism of emodin and rhein in rats and mice[J]. J China Pharm Univ, 1985(1): 72. DOI:10.3321/j.issn:1000-5048.1985.01.016 |
| [10] |
马红玉.蒽醌类成分的体内外检测研究[D].贵阳: 贵州大学, 2015 MA HY. In vitro and in vivo Detection of Terpenoids[D]. Guiyang: Guizhou University, 2015 |
| [11] |
胡锡琴, 李敏, 杨红莲, 等. 何首乌中鞣质与二苯乙烯苷不同配比对大鼠肝功能指标的影响[J]. 上海中医药杂志, 2011, 45(4): 56. HU XQ, LI M, YANG HL, et al. Effects of different ratios of tannin and stilbene glucoside from Polygonum multiflorum on liver biochemical indexes in rats[J]. Shanghai J Tradit Chin Med, 2011, 45(4): 56. |
| [12] |
文海若, 毛志慧, 陈高峰, 等. SD大鼠连续灌胃给药对碱性彗星电泳和骨髓微核的影响[J]. 药物分析杂志, 2017, 37(6): 1063. WEN HR, MAO ZH, CHEN GF, et al. Effects of continuous intragastric administration of SD rats on alkaline comet electrophoresis and bone marrow micronucleus[J]. Chin J Pharm Anal, 2017, 37(6): 1063. |
| [13] |
冯素香, 张蕾, 郝蕊, 等. 固相萃取-高效液相色谱法测定大鼠血浆中大黄素甲醚及其药动学研究[J]. 暨南大学学报(自然科学与医学版), 2017, 38(2): 109. FENG SX, ZHANG L, HAO R, et al. Determination of physcion in plasma by SPE-HPLC and its pharmacokinetic study in rats[J]. J Jinan Univ(Nat Sci Med Ed), 2017, 38(2): 109. |
| [14] |
孙阳, 王玉霞, 陈琼华. 中药大黄的生化学研究ⅩⅩ.大黄素甲醚在大鼠体内的吸收、分布和排泄[J]. 中国药科大学学报, 1988, 19(3): 179. SUN Y, WANG YX, CHEN QH. Biochemical study of rhubarb ⅩⅩ. Absorption, distribution and excretion of rhubarb in rats[J]. J China Pharm Univ, 1988, 19(3): 179. DOI:10.3321/j.issn:1000-5048.1988.03.005 |
| [15] |
孙阳, 陈琼华. 中药大黄的生化学研究-ⅩⅥ.大黄素甲醚在动物体代谢产物的分离和鉴定[J]. 药学学报, 1986, 21(10): 748. SUN Y, CHEN QH. The biochemical study of Chinese rhubarb ⅩⅥ. The separation and identification of metabolites from rhubarb methyl ether in animal body[J]. Acta Pharm Sin, 1986, 21(10): 748. |
| [16] |
楼招欢, 吕圭源, 俞静静. 何首乌成分、药理及毒副作用相关的研究进展[J]. 浙江中医药大学学报, 2014(4): 495. LOU ZH, LÜ GY, YU JJ. Research progress in the components, pharmacology and toxic and side effects of Polygonum multiflorum[J]. J Zhejiang Univ Chin Med, 2014(4): 495. |
| [17] |
胡锡琴, 耿增岩, 李巧兰, 等. 制何首乌不同剂量与大鼠肝损伤程度的实验研究[J]. 陕西中医, 2007, 28(10): 1420. HU XQ, GENG ZY, LI QL, et al. Experimental study of different doses of Polygonum multiflorum and liver injury in rats[J]. Shaanxi J Tradit Chin Med, 2007, 28(10): 1420. DOI:10.3969/j.issn.1000-7369.2007.10.105 |
| [18] |
LI H, WANG X, LIU Y, et al. Hepatoprotection and hepatotoxicity of Heshouwu, a Chinese medicinal herb:context of the paradoxical effect[J]. Food Chem Toxicol Int J, 2016, 108(Pt B): 407. |
| [19] |
YU J, XIE J, MAO XJ, et al. Hepatoxicity of major constituents and extractions of Radix Polygoni Multiflori and Radix Polygoni Multiflori Praeparata[J]. J Ethnopharmacol, 2011, 137(3): 1291. DOI:10.1016/j.jep.2011.07.055 |
| [20] |
LV GP, MENG LZ, HAN DQ, et al. Effect of sample preparation on components and liver toxicity of Polygonum multiflorum[J]. J Pharm Biomed Anal, 2015, 109: 105. DOI:10.1016/j.jpba.2015.02.029 |
| [21] |
杨乐, 郭晓昕, 宋海波. 养血生发胶囊相关肝损害风险分析[J]. 中国药物警戒, 2013, 10(6): 362. YANG L, GUO XX, SONG HB. Risk analysis of liver damage associated with Yangxueshengfa capsules[J]. Chin J Pharmacovigil, 2013, 10(6): 362. DOI:10.3969/j.issn.1672-8629.2013.06.013 |
| [22] |
LI Y, LUAN Y, QI X, et al. Emodin triggers DNA double-strand breaks by stabilizing topoisomerase Ⅱ-DNA cleavage complexes and by inhibiting ATP hydrolysis of topoisomerase Ⅱ[J]. Toxicolog Sci, 2010, 118(2): 435. DOI:10.1093/toxsci/kfq282 |
| [23] |
GO SY, KWON KJ, PARK SN, et al. Genetic toxicity test of emodin by ames, micronucleus, comet assays and microarray analysis showing differential result[J]. J Appl Pharmacol, 2007, 15(3): 192. |
| [24] |
National Toxicology Program. NTP Toxicology and Carcinogenesis Studies of Emodin (CAS NO. 518-82-1) Feed Studies in F344/N Rats and B6C3F1 Mice[J]. Natl Toxicol Program Tech Rep Ser, 2001, 493: 1. |
| [25] |
KRIVOBOK S, SEIGLE-MURANDI F, STEIMAN R, et al. Mutagenicity of substituted anthraquinones in the Ames/Salmonella microsome system[J]. Mutat Res, 1992, 279(1): 1. DOI:10.1016/0165-1218(92)90259-3 |
| [26] |
KIMOTO T, HORIBATA K, MIURA D, et al. The PIGRET assay, a method for measuring Pig-a gene mutation in reticulocytes, is reliable as a short-term in vivo genotoxicity test:summary of the MMS/JEMS-collaborative study across 16 laboratories using 24 chemicals[J]. Mutat Res, 2016, 811: 3. DOI:10.1016/j.mrgentox.2016.10.003 |
| [27] |
ROTHFUSS A, HONMA M, CZICH A, et al. Improvement of in vivo genotoxicity assessment:combination of acute tests and integration into standard toxicity testing[J]. Mutat Res, 2011, 723(2): 108. DOI:10.1016/j.mrgentox.2010.12.005 |
| [28] |
OECD Guideline for the Testing of Chemicals TG474, Mammalian Erythrocyte Micronucleus Test[S]. 2014
|
| [29] |
文海若, 宋捷, 陈高峰, 等. 体外与体内肝细胞微核检测方法研究[J]. 中国新药杂志, 2016, 25(7): 787. WEN HR, SONG J, CHEN GF, et al. Study on in vitro and in vivo micronucleus detection of hepatocytes[J]. Chin J New Drugs, 2016, 25(7): 787. |
| [30] |
SUZUKI H, TAKASAWA H, KOBAYASHI K, et al. Evaluation of a liver micronucleus assay with 12 chemicals using young rats (Ⅱ):a study by the Collaborative Study Group for the Micronucleus Test/Japanese Environmental Mutagen Society-Mammalian Mutagenicity Study Group[J]. Mutagenesis, 2009, 24(1): 9. |
| [31] |
UNO Y, KOJIMA H, HAYASHI M. The JaCVAM-organized international validation study of the in vivo rodent alkaline comet assay[J]. Mutat Res Genet Toxicol Environ Mutagen, 2015, 786-788: 2. DOI:10.1016/j.mrgentox.2015.05.003 |
 2018, Vol. 38
2018, Vol. 38 
