2. 吉林农业大学中药材学院, 长春 130118
2. Chinese Medicinal Materials College, Jilin Agricultural University, Changchun 130118, China
《中华人民共和国药典》(以下简称《中国药典》)2015年版一部中收载的鹿相关药材包括鹿科动物梅花鹿Cervus nippon Temminck和马鹿Cervus elaphus Linnaeus的鹿茸、鹿角、鹿角胶和鹿角霜[1]。因入药部位的不同,上述药材的功效也有所差别。在鹿相关的药材中,鹿茸为未骨化的软骨组织,鹿角、鹿角脱盘为已骨化的软骨组织,鹿角胶、鹿角霜由鹿角制备而来[2-5]。硫酸软骨素为软骨组织中特有的生物活性成分,具有抗关节炎、抗骨质疏松和抗肿瘤等活性[6-12]。对鹿相关药材中硫酸软骨素含量开展研究,有利于鹿相关药材的深开发和利用。
硫酸软骨素(chondroitin sulfate,CS)是广泛存在于高等动物软骨组织中的酸性粘多糖[13],在分子结构上是由D-葡萄糖醛酸和N-乙酰半乳糖胺以1,3糖苷键连接形成重复二糖,二糖单位之间以β-1,4糖苷键连接形成糖链。其中硫酸软骨素A、B、C是3种典型的硫酸软骨素,硫酸软骨素A、B、C的差别在于二糖组成单位中乙酰半乳糖胺上硫酸化的位点不同(如图 1),若4位硫酸化,为4-硫酸化软骨素二糖,作为重复双糖单位构成硫酸软骨素A;若6位硫酸酯化,为6-硫酸酯化软骨素二糖,构成硫酸软骨素C;若没有硫酸酯化位点,为软骨素二糖,构成硫酸软骨素B[14]。
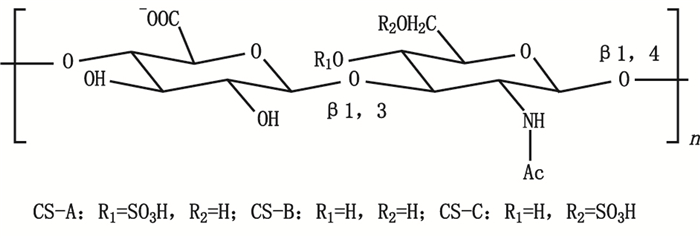
|
图 1 硫酸软骨素的结构 Figure 1 Structure of chondroitin sulfate |
根据硫酸软骨素的结构特点,硫酸软骨素的含量测定方法均以其分子上某一种特定化学成分为指标,进而转化为硫酸软骨素含量。目前采用的测定指标有软骨素二糖、氨基己酸、葡萄糖醛酸、硫酸基和阴性基团等几类,其中以软骨素二糖与硫酸软骨素的关联性最高[13]。
本实验采用稀碱-浓盐提取法,酶解液相色谱法测定鹿相关药材中硫酸软骨素的含量,为鹿相关药材中硫酸软骨素的综合利用提供理论依据。
1 材料 1.1 仪器LC-16高效液相色谱仪(岛津仪器(苏州)有限公司);MS204S电子分析天平(瑞士Mettler Toledo公司);524G恒温磁力搅拌器(上海梅颖浦仪器有限公司);CPA 225D电热恒温水浴锅(北京市永光明医疗仪器厂);FE20 Plus实验室pH计(梅特勒-托利多仪器(上海)有限公司);WP-UP-WF-40微量分析型超纯水机(四川沃特尔水处理设备有限公司);DHG-9447A低速大容量离心机(上海菲恰尔分析仪器有限公司);TGL-16G实验室台式离心机(上海安亭科学仪器厂);DHG-9123A电热恒温鼓风干燥箱(上海精宏实验设备有限公司);DLF-6090真空干燥箱(上海精宏实验设备有限公司);0.45 μm水系针头式过滤器(天津市津腾实验设备有限公司)。
1.2 试剂4-硫酸化软骨素二糖(硫酸软骨素A二糖重复单元,批号1001919990)、软骨素二糖(硫酸软骨素B二糖重复单元,批号1002367738)、6-硫酸化软骨素二糖(硫酸软骨素C二糖重复单元,批号1001842493),纯度 > 99%,均购自Sigma-Aldrich公司。硫酸软骨素ABC酶(批号S28J8I38812),5 U,购自上海源叶生物科技有限公司。盐酸、氢氧化钠、三羟甲基氨基甲烷、氯化钠、醋酸钠、无水乙醇,分析纯,均为北京化工厂生产。超纯水,电阻率≥18.25 MΩ,由实验室超纯水机制备。
1.3 药材鲜梅花鹿茸6副、鲜马鹿茸6副;梅花鹿鹿角6副、马鹿角6副;梅花鹿角脱盘数枚、马鹿角脱盘数枚,均购于吉林省长春市双阳区鹿乡镇,经中国农业科学院特产研究所李春义研究员鉴定为梅花鹿Cervus nippon Temminck的茸角(二杠)、鹿角、鹿角脱盘和马鹿Cervus elaphus Linnaeus的茸角(三岔)、鹿角、鹿角脱盘。参照文献方法[15],对鲜梅花鹿茸和鲜马鹿茸采取带血煮炸加工;鹿角和鹿角脱盘粉碎,按2015年版《中国药典》方法[1]熬制鹿角胶、制备鹿角霜。将加工好的样品分别进行粉碎、过筛、装袋、标记,样品编号见表 1。
|
|
表 1 鹿相关样品名称和来源 Table 1 Deer related sample number and source |
称取样品粉末5.0 g,每个样品3份,精密称定,分别置于50 mL锥形瓶中,加3 mol·L-1氯化钠溶液30 mL,用50%氢氧化钠溶液调节pH至12,室温下搅拌提取12 h,过滤;滤渣重复提取1次,合并提取液。提取液用2 mol·L-1盐酸调pH至7,升温至80 ℃,保温20 min,冷却后过滤;用2 mol·L-1盐酸将滤液调pH至2,搅拌10 min,静置后再滤至澄清,滤液用50%氢氧化钠溶液调pH至6.5,加2倍超纯水调整溶液中的氯化钠浓度为1 mol·L-1左右。提取液中加无水乙醇,使乙醇含量为60%,沉淀过夜。收集沉淀,用乙醇脱水,60 ℃真空干燥,得硫酸软骨素粗品。
2.2 供试品溶液的制备称取按“2.1”项下方法制备的硫酸软骨素粗品约0.10 g,精密称定,置于10 mL量瓶中,加超纯水溶解并定容至刻度,摇匀,用0.45 μm滤膜过滤,精密量取100 μL,置1.5 mL离心管中,加Tris缓冲溶液(取三羟甲基氨基甲烷6.06 g与醋酸钠8.17 g,加超纯水900 mL使溶解,用稀盐酸调节pH至8.0,用超纯水稀释至1 000 mL)800 μL,充分混匀,再加入硫酸软骨素ABC酶液(每100 μL中含有0.1 U的硫酸软骨素ABC酶)100 μL,摇匀,置37 ℃水浴中反应1 h,取出,在100 ℃加热5 min,用冷水冷却至室温;以10 000 r·min–1离心20 min,取上清液,用0.45 μm滤膜滤过,取续滤液作为供试品溶液。
2.3 对照品储备液的制备精密称取4-硫酸化软骨素二糖、软骨素二糖、6-硫酸化软骨素二糖的对照品于10 mL量瓶中,以超纯水定容至刻度,配成质量浓度分别为194、186、192 mg·L-1的混合对照品储备液,4 ℃低温保存。
2.4 色谱条件采用强阴离子硅胶为填料的Hypersil SAX色谱柱(4.6 mm×250 mm,5 μm),流动相A为水溶液(盐酸调pH至3.5),流动相B为2 mol·L-1的氯化钠溶液(盐酸调pH至3.5),梯度洗脱(0~4 min,0%B;4~45 min,0%B→50%B),流速1.0 mL·min-1,检测波长232 nm,柱温40 ℃,进样量20 μL。
2.5 方法学考察 2.5.1 线性关系考察精密吸取4-硫酸化软骨素二糖、软骨素二糖、6-硫酸化软骨素二糖的混合对照品储备液0.5、1.0、2.0、3.0、5.0 mL,分别置100 mL量瓶中,以超纯水稀释定容,得一系列浓度的混合对照品溶液,按“2.4”项下的色谱条件对各成分的峰面积进行测定,每个浓度平行进样3次,以峰面积平均值(Y)为纵坐标,质量浓度(X)为横坐标,进行线性回归,结果见表 2。
|
|
表 2 3个硫酸软骨素的标准曲线及线性范围 Table 2 The standard curve and the linear range of 3 chondroitin sulfate |
将“2.3”项下的对照品储备液用超纯水逐级稀释后,按信噪比(S/N)为3测得的对照品溶液浓度为检测下限(LOD),以信噪比(S/N)为10测得的对照品溶液浓度为定量下限(LOQ),结果见表 2。
2.5.3 精密度试验精密吸取4-硫酸化软骨素二糖、软骨素二糖、6-硫酸化软骨素二糖混合对照品溶液20 μL,按“2.4”项下色谱条件连续进样5次进行分析,测定峰面积,计算各成分的RSD,结果4-硫酸化软骨素二糖、软骨素二糖和6-硫酸化软骨素二糖峰面积的RSD分别为3.7%,2.6%和3.5%,均小于5%,表明仪器精密度良好。
2.5.4 重复性试验称取同一鹿源药材(梅花鹿鹿茸)样品6份,每份5.0 g,精密称定,分别按“2.1”项下方法制备硫酸软骨素粗品,按“2.2”项下方法制备供试品溶液,分别按“2.4”项下色谱条件进样分析,测定峰面积,计算各组分的含量,结果硫酸软骨素A、B、C平均含量分别为1.08、0.19和0.84 g·kg-1,RSD分别为3.2%、2.1%和2.8%,表明重复性良好。
2.5.5 稳定性试验精密吸取“2.2”项下同一样品的供试品溶液20 μL,分别在0、2、4、8、16和24 h按“2.4”项下色谱条件进样分析,测定峰面积,结果4-硫酸化软骨素二糖、软骨素二糖、6-硫酸化软骨素二糖峰面积的RSD分别为2.4%、1.3%和1.9%,表明在24 h内稳定性良好。
2.5.6 回收率试验精密称取9份已知含量的鹿源药材(梅花鹿鹿茸)样品粉末2.5 g,分别加入一定量的对照品,按“2.1”及“2.2”项下方法操作,制备供试溶液,进样测定峰面积,分别测定待测成分的量,计算平均回收率及RSD,结果见表 3。
|
|
表 3 加样回收率试验(n=3) Table 3 Results of recoveries. |
精密称取鹿相关药材5.0 g,每个3份,分别按“2.1”和“2.2”项下方法制备供试品溶液,按“2.4”项下色谱条件进样分析,将测得的峰面积代入回归方程,分别计算硫酸软骨素A、B、C和总硫酸软骨素(硫酸软骨素A、B、C的加和)的含量,结果见表 4,色谱图见图 2。
|
|
表 4 《中国药典》2015版一部中鹿源药材硫酸软骨素含量比较 Table 4 Comparison of chondroitin sulfate content of deer related medicine in Chinese Pharmacopoeia 2015 |
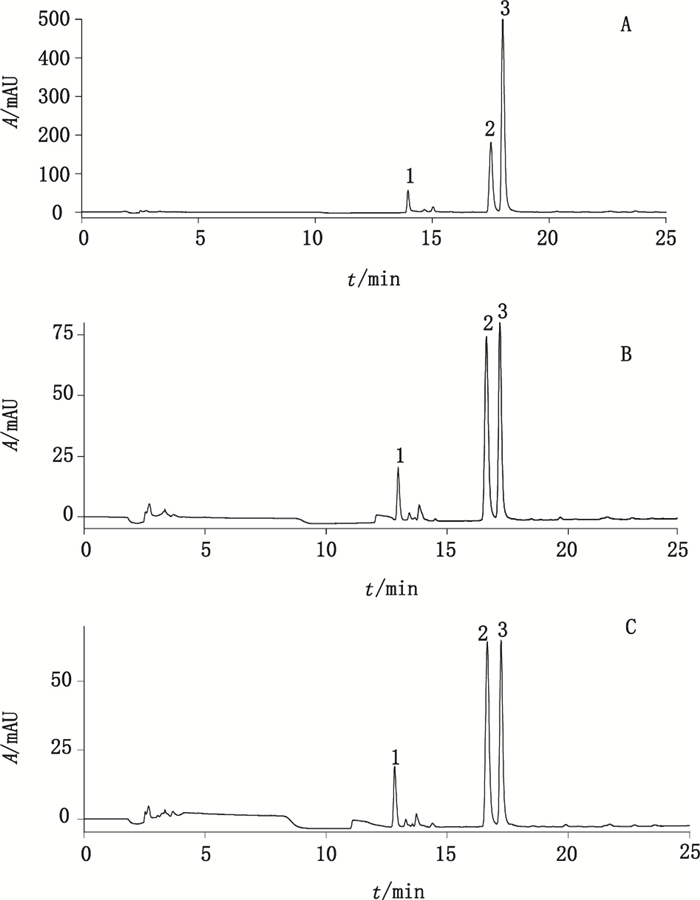
|
1.软骨素二糖(chondroitin disaccharide Δdi-0S sodium salt)2. 6-硫酸化软骨素二糖(chondroitin disaccharide Δdi-6S sodium salt)3. 4-硫酸化软骨素二糖(chondroitin disaccharide Δdi-4S sodium salt) 图 2 硫酸软骨素对照品(A)、梅花鹿鹿茸样品(B)、梅花鹿鹿角胶(C)的HPLC图 Figure 2 HPLC chromatograms of chondroitin sulfate reference substances (A), Cervi Cornu Pantotrichum (B) and Cervi Cornu Degelatinatum (C) of Cervus nippon Temminck |
由表 4可知,梅花鹿茸和马鹿茸中总硫酸软骨素的含量分别为2.06和1.83 g·kg–1。梅花鹿茸和马鹿茸中的硫酸软骨素均存在硫酸软骨素A、B、C 3种形式,其中以硫酸软骨素A含量最高,硫酸软骨素C次之,硫酸软骨素B最少。
鹿角胶由鹿角熬制而成,鹿角包括鹿角和鹿角脱盘,熬制鹿角胶剩余的残渣干燥后便得鹿角霜[1]。由表 4可知,梅花鹿鹿角(鹿角脱盘)、鹿角胶(鹿角脱盘胶)、鹿角霜(鹿角脱盘霜)中总硫酸软骨素含量分别为0.46(0.42)、0.93(1.10)、0.22(0.17)g·kg-1;马鹿鹿角(鹿角脱盘)、鹿角胶(鹿角脱盘胶)、鹿角霜(鹿角脱盘霜)中总硫酸软骨素含量分别为0.41(0.34)、0.91(0.87)、0.19(0.15)g·kg-1。鹿角、鹿角胶和鹿角霜中总硫酸软骨素的含量均显著低于鹿茸中的含量(P < 0.05)。鹿角、鹿角胶和鹿角霜中的硫酸软骨素也存在硫酸软骨素A、B、C 3种形式。但鹿角、鹿角胶和鹿角霜中呈现出硫酸软骨素A含量最高,硫酸软骨素B含量次之,硫酸软骨素C最少的规律,这与鹿茸有所差别。
在鹿角胶的熬制过程中,鹿角的出胶率约为20%。通过比较鹿角、鹿角胶和鹿角霜中硫酸软骨素的含量发现,鹿角胶中硫酸软骨素的含量约为鹿角和鹿角霜中含量差值的五倍,这与炮制过程中的变化相吻合,表明鹿角胶在熬制过程中鲜有硫酸软骨素的损失。
将鹿相关药材样品中的硫酸软骨素A、B、C和总硫酸软骨素含量用SPSS 22.0统计软件进行系统聚类分析,结果见图 3。梅花鹿茸和马鹿茸被聚为一大类,梅花鹿和马鹿的鹿角、鹿角胶和鹿角霜被聚为一大类。在鹿角、鹿角胶和鹿角霜这一类中,梅花鹿角胶、梅花鹿角脱盘胶、马鹿角胶和马鹿角脱盘胶聚为一类;梅花鹿和马鹿的鹿角、鹿角脱盘、鹿角霜和鹿角脱盘霜聚为一类。

|
图 3 2015年版《中国药典》中鹿源药材聚类结果 Figure 3 Cluster results of deer related medicine in Chinese Pharmacopoeia 2015 |
硫酸软骨素的提取方法有多种,其中稀碱-酶解法、稀碱-浓盐法是最经典的2种方法[16-18],但未见上述2种方法用于提取鹿茸中硫酸软骨素的报道。通过前期实验比较稀碱-酶解法和稀碱-浓盐法提取鹿茸中的硫酸软骨素发现:稀碱-浓盐法相对于稀碱-酶解法明显缩短约45%的处理时间(24 h),具有操作简单、试剂耗材少、提取率高等特点,且提取过程中无酶制剂的使用,不易受温度、pH等因素的影响。故本实验采用此方法提取硫酸软骨素。
3.2 硫酸软骨素测定方法采用硫酸软骨素ABC酶酶解、液相色谱法测定硫酸软骨素含量[14],该方法已被2015年版《中国药典》[19]收载,用于硫酸软骨素钠、硫酸软骨素钠片及硫酸软骨素胶囊中硫酸软骨素的含量测定。本实验在此基础上,按外标法以对照品4-硫酸化软骨素二糖、软骨素二糖、6-硫酸化软骨素二糖的峰面积与浓度的关系绘制标准曲线,分别测得硫酸软骨素A、B、C的含量,该方法具有专属性强、灵敏度高和重现性好的优点。
3.3 鹿源药材中硫酸软骨素含量曹译等[20]曾对鹿茸中的硫酸软骨素进行分离纯化研究,但未准确定量鹿茸中硫酸软骨素的含量。鹿角、鹿角胶、鹿角霜中硫酸软骨素的分离纯化及含量测定未见报道。本研究建立了酶解-HPLC法,对鹿茸中总硫酸软骨素及硫酸软骨素A、B、C的含量进行了测定;提纯分离了鹿角、鹿角胶、鹿角霜等鹿源药材中的总硫酸软骨素,并对总硫酸软骨素及硫酸软骨素A、B、C的含量进行准确定量。此外,本研究就不同基源鹿源药材中硫酸软骨素的含量进行了比较,结果表明,仅考虑硫酸软骨素含量,马鹿的鹿茸、鹿角、鹿角胶、鹿角霜和梅花鹿的鹿茸、鹿角、鹿角胶、鹿角霜含量相差不大,与梅花鹿和马鹿同等作为药用相符;鹿角制备的鹿角胶、鹿角霜和鹿角脱盘制备的鹿角胶、鹿角霜含量相差不大,与鹿角和鹿角脱盘同等作为药用相符。
| [1] |
中华人民共和国药典2015年版.一部[S]. 2015: 321 ChP 2015. Vol Ⅰ[S]. 2015: 321 |
| [2] |
李春义. 鹿茸完全再生机制研究进展[J]. 农业生物技术学报, 2017, 25(1): 1. LI CY. Progress in the mechanism underlying full regeneration of mammalian organ deer antlers[J]. J Agric Biotechnol, 2017, 25(1): 1. |
| [3] |
曹胜男, 包海鹰. 鹿角的化学成分及药理活性研究进展[J]. 经济动物学报, 2011, 15(4): 230. CAO SN, BAO HY. Research progress on chemical constituents and pharmaceutical activities of antlers[J]. J Econ Animl, 2011, 15(4): 230. DOI:10.3969/j.issn.1007-7448.2011.04.012 |
| [4] |
钱璟, 吉静娴, 黄凤杰, 等. 鹿角脱盘活性物质的研究与开发利用[J]. 药物生物技术, 2009, 16(3): 283. QIAN J, JI JX, HUANG FJ, et al. Study and utilization of the active substance in antler plate[J]. Pharm Biotechnol, 2009, 16(3): 283. |
| [5] |
鲍悦, 高久堂, 孙佳明, 等. 中药鹿角胶的研究进展[J]. 吉林中医药, 2016, 36(2): 173. BAO Y, GAO JT, SUN JM, et al. Research progress of traditional Chinese medicine Colla Corni Cervi[J]. Jilin J Tradit Chin Med, 2016, 36(2): 173. |
| [6] |
ZHOU QL, GUO YJ, WANG LJ, et al. Velvet antler polypeptides promoted proliferation of chondrocytes and osteoblast precursors and fracture healing[J]. Acta Pharmaol Sin, 1999, 20(3): 279. |
| [7] |
ⅡDAJ, MEIJNEAM, KNUTSONJR, 等. Cell surface chondroitin sulfate proteoglycans in tumor cell adhesion, motility and invasion[J]. Sem Cancer Biol, 1996, 7(3): 155. |
| [8] |
PUMPHREY CY, THEUS AM, LI S, et al. Neoglycans, carbodiimide-modified glycosam in oglycosam in oglycans:a new class of anticancer agents that inhibits cancer cell proliferation and induces apoptosis[J]. Cancer Res, 2002, 62(13): 3722. |
| [9] |
赵虎, 周庭银. 骨质中硫酸软骨素蛋白多糖的类型和特征[J]. 中国生物化学与分子生物学报, 2000, 16(2): 231. ZHAO H, ZHOU TY. Characteristics of chondroitin sulfated proteoglycans in the matrix phase of bones[J]. Chin J Biochem Mol Biol, 2000, 16(2): 231. DOI:10.3969/j.issn.1007-7626.2000.02.016 |
| [10] |
CAMPO RD, ROMANO JE. Changes in cartilage proteoglycans associated with calcification[J]. Calcif Tissue Int, 1986, 39(3): 175. DOI:10.1007/BF02555115 |
| [11] |
BOSKEY AL, STINER D, DOTY SB, et al. Studies of mine realization in tissue culture:optiomal conditions for carilage calcification[J]. Bone Miner, 1992, 16(1): 11. DOI:10.1016/0169-6009(92)90819-Y |
| [12] |
DENHOLM EM, LIN YQ, SILVER PJ, et al. Antitumor activities of chondroitinase AC and chondroitinase B:inhibition of angiogenesis, proliferation and invasion[J]. Eur J Pharmacol, 2001, 416(3): 213. DOI:10.1016/S0014-2999(01)00884-6 |
| [13] |
徐传屯, 关瑞章, 郑江. 硫酸软骨素测定方法的研究进展[J]. 集美大学学报(自然科学版), 2008, 13(1): 54. XU CT, GUAN RZ, ZHENG J. Research progress of the determination methods of chondroitin sulfate[J]. J Jimei Univ(Nat Sci), 2008, 13(1): 54. |
| [14] |
任丽萍, 于海洲, 宋玉娟, 等. 酶解液相色谱法测定硫酸软骨素钠含量[J]. 药物分析杂志, 2012, 32(7): 1246. REN LP, YU HZ, SONG YJ, et al. Enzymolysis-HPLC determination of the content of chondroitin sulfate sodium[J]. Chin J Pharm Anal, 2012, 32(7): 1246. |
| [15] |
李和平, 王春生. 生态养鹿[M]. 北京: 中国农业出版社, 2011: 89. LI HP, WANG CS. Ecological Deer[M]. Beijing: China Agriculture Press, 2011: 89. |
| [16] |
王玉田. 动物性副产品加工利用[M]. 北京: 化学工业出版社, 2009: 152. WANG YT. Processing and Utilization of Animal by-products[M]. Beijing: Chemical Industry Press, 2009: 152. |
| [17] |
熊双丽, 李安林, 张晓娟. 猪肺管硫酸软骨素的提取分离与抗氧化活性研究[J]. 食品工业科技, 2014, 35(17): 93. XIONG SL, LI AL, ZHANG XJ. Purification and antioxidant activity of chondroitin sulfate from pig lung trachea[J]. Sci Technol Food Ind, 2014, 35(17): 93. |
| [18] |
陆钊, 刘小虎, 刘田, 等. 猪硫酸软骨素的制备和含量测定[J]. 第四军医大学学报, 2009, 30(20): 2172. LU Z, LIU XH, LIU T, et al. Synthesis and determination of pig chondroitin sulfate[J]. J Fourth Mil Med Univ, 2009, 30(20): 2172. |
| [19] |
中华人民共和国药典2015年版.二部[S]. 2015: 1340 ChP 2015. Vol Ⅱ[S]. 2015: 1340 |
| [20] |
曹译, 王瑞林, 张敏, 等. 鹿茸硫酸软骨素蛋白聚糖的分离纯化研究[J]. 生物学杂志, 2006, 23(5): 30. CAO Y, WANG RL, ZHANG M, et al. Study of isolation and identification of chondroitin sulfate proteoglycan in pliose antler[J]. J Biol, 2006, 23(5): 30. |
 2018, Vol. 38
2018, Vol. 38 
