2. 北京以岭药业有限公司, 北京 102600;
3. 石家庄以岭药业股份有限公司, 石家庄 050035
2. Beijing Yiling Pharmaceutical Co., Ltd., Beijing 102600, China;
3. Shijiazhuang Yiling Pharmaceutical Co., Ltd., Shijiazhuang, 050035, China
大黄是中国传统四大中药之一,为蓼科植物掌叶大黄Rheum palmatum L.、唐古特大黄R. tanguticum Maxim. ex Balf.、药用大黄R. officinale Baill.的根和根茎,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经及利湿退黄的功效[1];其化学成分复杂,主要包括蒽醌、蒽酮、二苯乙烯、鞣质、色酮、苯丁酮苷等各类化合物。药理学及分子生物学研究表明,番泻苷及蒽醌苷类为大黄泻下的主要成分,游离蒽醌类为大黄抑菌、抗肿瘤的有效成分[2];苯丁酮类成分中的莲花掌苷和异莲花掌苷具有良好的抗炎镇痛作用[3];鞣质中没食子酰葡萄糖苷和没食子酰原花青素具有降血脂作用[4],RG-tannin有振奋精神作用[5],d-儿茶素和没食子酸有止血作用[6]。目前对大黄及其制剂的质量控制,多以蒽醌类化合物的含量为标准,但大黄的药效成分不只是蒽醌类化合物,中药的成分多样性决定了质量控制应采用多指标的质量评价模式。
本课题组通过对掌叶大黄进行化学成分研究,分离得到1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷,通过指纹图谱研究发现,儿茶素和1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷的含量较高。近年来国内外对于大黄有较多研究,药材的指纹图谱和多成分含量测定也已见诸报道[7-14],但通过建立指纹图谱与多成分含量测定、化学成分定性分析相结合对大黄进行质量控制且以1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷为含量测定指标的研究尚未见报道,因此目前仍缺乏整体的综合评价大黄质量的方法。掌叶大黄是《中华人民共和国药典》(以下简称《中国药典》)中收载的品种,主产地资源丰富,采收较容易,资源易得到保证,故本实验主要对掌叶大黄进行质量控制研究。本实验通过建立掌叶大黄UPLC指纹图谱,并结合多成分含量测定和系统的化学成分鉴定,为掌叶大黄质量综合评价提供可行方法,并为进一步进行药效物质基础研究提供依据。
1 仪器与试药 1.1 仪器Waters UPLC超高效液相色谱仪(配备样品管理器FTN、四元溶剂管理器、PDA检测器),ACQUITY UPLC-Synapt G2 MS色谱-质谱联用仪(Waters公司);Milli-Q超纯水净化系统(Millipore公司);KQ250DB型超声波清洗器(昆山市超声仪器有限公司);Mettler AL204型和AB135-S型电子分析天平(Mettler Toledo公司)。
1.2 对照品与试剂儿茶素(LOT#BCBR0996V,纯度≥98%)购自Sigma公司,大黄素(批号110756-201512,含量以98.7%计)、大黄酚(批号110796-201319,含量以99.6%计)、大黄素甲醚(批号110758-201415,含量以99.1%计),大黄酸(批号110757-200206,供含量测定用),芦荟大黄素(批号110795-201308,含量以97.8%计),均购自中国食品药品检定研究院。番泻苷A(批号20120514,HPLC≥98%),番泻苷B(批号20120605,HPLC≥98%)购自上海源叶生物科技有限公司;没食子酸(批号BCBK2434V,91215-100 mg,纯度≥98%)购自Sigma公司;1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷由本实验室自制,并经UPLC-PDA检测,质量分数大于98%。芦荟大黄素-8-O-β-D-葡萄糖苷、1, 6-二-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷、大黄酚-1-O-β-D-葡萄糖苷、大黄素-8-O-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷由本实验室自制,并经UPLC-PDA检测,质量分数大于95%。色谱级甲醇、乙腈和质谱级乙腈购自Thermo Fisher公司,质谱级甲酸(LOT.SFASI-FQ)购自梯希爱(上海)化成工业发展有限公司。水为超纯水(Milli-Q制备)。
1.3 药材样本采集10批掌叶大黄药材均购自甘肃省(详细来源见表 1),经石家庄以岭药业股份有限公司药材资源部田清存主任中药师鉴定为蓼科植物掌叶大黄(R. palmatum L.),样本存放于北京以岭药业有限公司。
|
|
表 1 10批次掌叶大黄药材信息 Table 1 Sample information of 10 batches of the roots and rhizomes of R. palmatum |
采用Waters BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),柱温30 ℃,检测波长280 nm,进样量1 μL,流动相为乙腈(A)-0.1%甲酸溶液(B),梯度洗脱(0~30 min,4%A→25%A;30~45 min,25%A→70%A;45~50 min,70%A),流速0.3 mL·min-1,色谱采集时间为50 min。此色谱条件检测时间适中,信息量丰富,亦用于指纹图谱的分析,对照品及供试品色谱图见图 1。
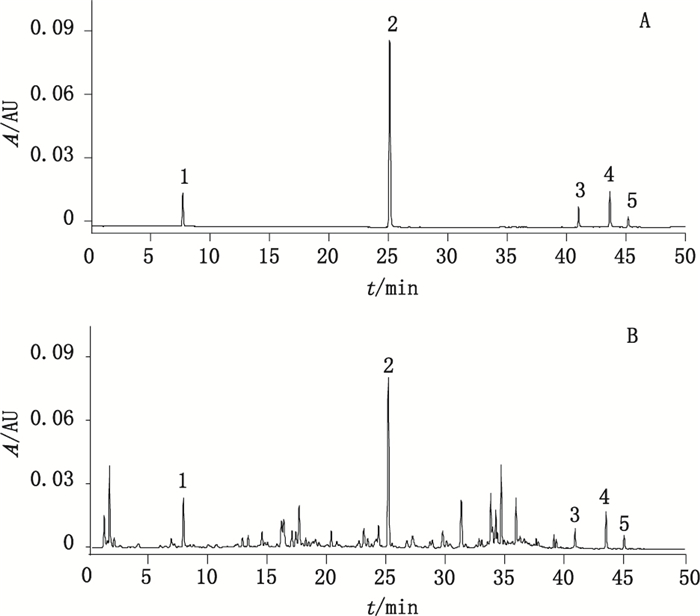
|
1.儿茶素(catechin)2. 1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷(1-O-galloyl-2-O-cinnamoyl-β-D-glucoside)3.大黄素(emodin)4.大黄酚(chrysophanol)5.大黄素甲醚(physcion) 图 1 对照品(A)和掌叶大黄药材样品(B)的UPLC色谱图 Figure 1 UPLC chromatograms of reference substance(A)and the roots and rhizomes of R. palmatum(B) |
采用电喷雾离子源(ESI),负离子MSE模式,雾化气体为高纯度氮气(N2),碰撞气体为高纯度氩气(Ar)。质量扫描范围m/z 100~1 500;毛细管电压为2.5 kV;锥孔电压为40 V;离子源温度为100 ℃;雾化温度为400 ℃;载气体积流量为800 L·h-1,碰撞能量(CE)20~40 V;采用亮氨酸-脑啡肽进行精确质量校正([M-H]-为m/z 554.261 5)。
2.2 溶液的制备 2.2.1 对照品储备液分别取儿茶素、1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷、大黄素、大黄酚和大黄素甲醚对照品适量,精密称定,加甲醇溶解并稀释成质量浓度分别为0.882 0、0.950 0、0.079 9、0.239 0、0.048 2 mg·mL-1的对照品储备液。
2.2.2 供试品溶液取大黄药材,粉碎,过4号筛。取粉末约0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,密塞,称量,超声处理(功率250 W,频率40 kHz)20 min,放冷,再称量,用甲醇补足减失的量,摇匀,用0.2 μm滤膜滤过,取续滤液,即得。
3 结果与分析 3.1 掌叶大黄中5个成分测定 3.1.1 线性关系考察精密吸取混合对照品储备液适量,以甲醇逐级稀释,稀释倍数分别为0、10、20、40、100、200倍,摇匀。分别按“2.1.1”项色谱条件进样分析,测定峰面积。以质量浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制各标准曲线,得到线性回归方程和线性范围,结果见表 2,5个成分在各浓度范围内的线性关系良好。
|
|
表 2 5个成分的标准曲线及线性范围 Table 2 Calibration curves and linear ranges of five constituents |
分别精密吸取混合对照品溶液1 μL,按“2.1.1”项色谱条件连续进样6次,计算儿茶素、1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷、大黄素、大黄酚、大黄素甲醚峰面积的RSD,结果各RSD均小于2%,表明仪器精密度良好。
3.1.3 稳定性试验取S1样品0.5 g,按“2.2.2”项方法制备供试品溶液,按“2.1.1”项色谱条件分别在0、2、4、6、8、12和24 h进样分析,计算5个成分峰面积的RSD,结果各RSD均小于2%,表明供试品溶液在24 h内稳定性良好。
3.1.4 重复性试验取S1样品6份,每份约0.5 g,按“2.2.2”项方法制备供试品溶液,按“2.1.1”项色谱条件进样分析,计算儿茶素、1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷、大黄素、大黄酚、大黄素甲醚质量分数的RSD,结果各RSD均小于3%,表明该方法重复性良好。
3.1.5 加样回收率试验取S1样品9份,每份0.25 g,精密称定,置具塞锥形瓶中,分别精密加入相当于样品中各待测成分含有量80%、100%和120%的各对照品,按“2.2.2”项方法制备供试溶液,按“2.1.1”项色谱条件进样分析,计算5个成分的加样回收率,结果平均回收率分别为97.2%、100.2%、99.1%、98.6%、100.0%,各成分回收率的RSD小于3%,表明该方法准确度良好。
3.1.6 样品测定按“2.2.2”项方法制备10批供试品溶液,按“2.1.1”项下色谱条件分别测定10批掌叶大黄药材中的儿茶素、1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷、大黄素、大黄酚、大黄素甲醚的含量,结果见表 3。不同批次的掌叶大黄药材中各测定成分均有不同程度的差异。
|
|
表 3 10批次掌叶大黄药材中5个成分的量及指纹图谱相似度 Table 3 Contents of five constituents and similarity of UPLC fingerprint for 10 batches of the roots and rhizomes of R. palmatum |
采用国家药典委员会开发的中药色谱指纹图谱相似度评价系统(2012版软件)对10批掌叶大黄药材UPLC指纹图谱进行数据处理,确定共有峰21个,由于1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷在各批次掌叶大黄中均有,保留时间适中,分离度良好且峰面积较大,故选定其作为参照峰(S),以相似度进行指纹图谱方法学考察,测定方法与“3.1”项相同。结果显示,同一供试品溶液连续进样6次,相似度高于0.990,精密度良好。重复性考察相似度高于0.990,稳定性考察相似度高于0.900,表明方法学验证符合指纹图谱技术要求。
3.2.2 相似度计算及对照指纹图谱的生成采用国家药典委员会开发的中药色谱指纹图谱相似度评价系统(2012版软件)对10批掌叶大黄样品进行分析,采用中位数法对各指纹图谱色谱峰进行了多点校正和自动匹配,以S1为参照指纹图谱,计算相似度并生成对照指纹图谱,10批次掌叶大黄样品UPLC指纹图谱见图 2,生成对照指纹图谱见图 3。计算得到的10批次样品与对照指纹图谱的相似度结果见表 3。结果表明各批次药材之间有较好的一致性,所建立的UPLC指纹图谱可用于掌叶大黄的质量评价。
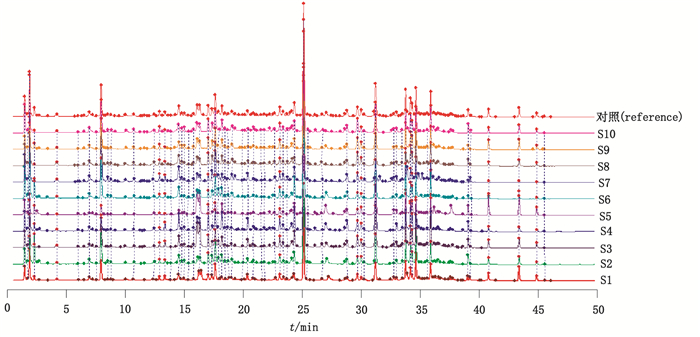
|
图 2 10批次掌叶大黄药材的UPLC指纹图谱 Figure 2 UPLC fingerprints of 10 batches of the roots and rhizomes of R. palmatum |
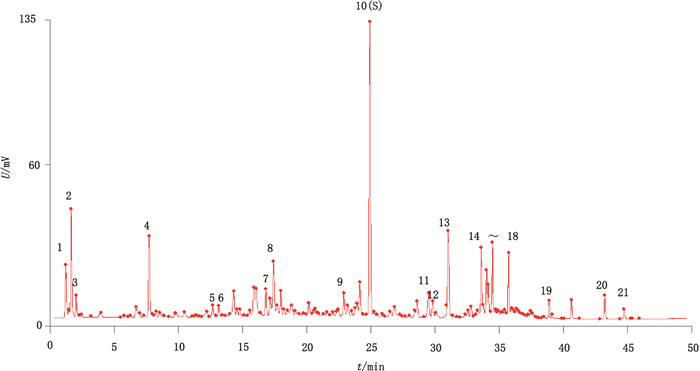
|
图 3 掌叶大黄药材的对照指纹图谱 Figure 3 Reference fingerprint of the roots and rhizomes of R. palmatum |
采用UPLC SYNAPT G2-S MS对甲醇超声提取的样品(S1)进行化学成分定性分析,负离子模式下基峰图见图 4,共检出80个化合物。通过对照品、保留时间和质谱信息,并结合相关文献数据[2, 13-22]比对,进行化学成分确认,初步鉴定了71个化合物,其中指纹图谱21个共有峰全部鉴定,另有9个未知化合物,其中15个化合物通过对照品指认,结果见表 4。

|
图 4 掌叶大黄样品负离子模式下离子流图 Figure 4 Base peak chromatogram in negative mode of the roots and rhizomes of R. palmatum |
|
|
表 4 掌叶大黄样品的UPLC-ESI-MS化学成分分析 Table 4 Chemical constituents from the roots and rhizomes of R. palmatum analyzed by UPLC-ESI-MS |
本实验比较了不同提取溶剂,如甲醇、70%和50%甲醇、乙醇、70%和50%乙醇在超声条件下提取掌叶大黄样品。通过对比得到的色谱峰峰容量和峰面积,最终确定用甲醇作为提取溶剂。又分别考察了超声20、30、40 min和回流0.5、1、2 h的不同提取方式和时间,结果表明提取方式和提取时间对色谱峰容量及峰面积影响不大,故选取超声20 min作为样品处理方式。
4.2 检测波长的确定掌叶大黄中极性较大的成分在280 nm下吸收较强,极性较小的游离蒽醌类如大黄素、大黄酚等在254 nm下吸收较强,但在280 nm下也有较强吸收,且280 nm下指纹图谱峰容量较多,色谱信息丰富,出于含量测定和指纹图谱同时考虑,故选择280 nm作为检测波长。
本研究建立了掌叶大黄药材多成分含量测定和指纹图谱、定性分析相结合的质量评价方法,指纹图谱结合定性分析初步鉴定了掌叶大黄中71个化学成分,结构类型分别为蒽醌类22个、蒽酮类13个、二苯乙烯类3个、鞣质类28个、苯丁酮类3个和色原酮类2个。含量测定方法包含掌叶大黄中3个蒽醌和2个鞣质类成分,10批次样品中儿茶素、1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷、大黄素、大黄酚和大黄素甲醚的含量范围分别为3.165~23.099、4.323~13.874、0.07~0.971、0.120~2.058、0.042~0.492 mg·g-1,结合指纹图谱结果可见,儿茶素和1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷在样品中含量较高,显著高于其他成分,是掌叶大黄药材物质基础的重要组成部分,其药理活性也是不容忽视的,因此有必要增加大黄中儿茶素和1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷的含量测定指标以提升药材的质量。掌叶大黄药材的化学成分复杂,仅以几种成分来控制药材质量较为片面,因此本实验采用指纹图谱进一步对掌叶大黄药材质量进行表征和研究,同时结合物质基础,完善质量评价体系,为用药提供科学的依据。
| [1] |
中华人民共和国药典2015年版.一部[S]. 2015: 23 ChP 2015.VolⅠ[S]. 2015: 23 |
| [2] |
高亮亮.唐古特大黄、药用大黄和掌叶大黄的化学成分和生物活性研究[D].北京: 北京协和医学院, 2012 GAO LL. Studies on the Chemical Constituents and Biological Activity of Rheum tanguticum Maxim. ex Balf., Rheum officinal Baill. and Rheum palmatum L.[D]. Beijing: Chinese acedemy of medical Sciences, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10023-1013311795.htm |
| [3] |
Tang T, Yin LW, Yang J. Emodin, an anthraquinone derivative from Rheum officinale Baill, enhances cutaneous wound healing in rats[J]. Eur J Pharm, 2007, 567: 177. DOI:10.1016/j.ejphar.2007.02.033 |
| [4] |
ABE I, SEKI T, Noguchi H, et al. Galloyl esters from rhubarb are potent inhibitors of squalene epoxidase, a key enzyme in cholesterol biosynthesis[J]. Planta Med, 2000, 66(8): 753. DOI:10.1055/s-2000-9781 |
| [5] |
贺玉琢. 大黄的趋精神作用[J]. 国外医学中医中药分册, 1997, 19(2): 9. HE YZ. Psychotropic effect of rhubarb[J]. Foreign Med Sci, 1997, 19(2): 9. |
| [6] |
戴可逊, 李东园, 荆伟, 等. 大黄止血有效成分的研究[J]. 中成药研究, 1983, 5(7): 29. DAI KX, LI DY, JING W, et al. Studies on hemostatic constituents from rhubarb[J]. Chin Tradit Pat Med, 1983, 5(7): 29. |
| [7] |
窦志华, 乔进, 卞理, 等. 指纹图谱与一测多评法相结合的大黄质量控制方法[J]. 中国药学杂志, 2015, 50(5): 442. DOU ZH, QIAO J, BIAN L, et al. Combinational quality control method of Rhei Radix et Rhizoma based on fingerprint and QAMS[J]. Chin Pharm J, 2015, 50(5): 442. |
| [8] |
杜清涛, 温金莲, 严优芍, 等. 不同品种不同产地大黄UPLC指纹图谱研究[J]. 中药材, 2013, 36(5): 725. DU QT, WEN JL, YAN YS, et al. UPLC fingerprint of Rhei Radix et Rhizoma from different habitats[J]. J Chin Med Mater, 2013, 36(5): 725. |
| [9] |
钱蕙, 李楠, 曹玉华. 高效液相色谱建立掌叶大黄指纹图谱[J]. 天然产物研究与开发, 2008, 20(6): 1051. QIAN H, LI N, CAO YH. Fingerprint development for Rheum palmatum by HPLC[J]. Nat Prod Res Dev, 2008, 20(6): 1051. DOI:10.3969/j.issn.1001-6880.2008.06.025 |
| [10] |
李丽, 张村, 肖永庆, 等. 大黄5种饮片中2个二苯乙烯苷类成分含量测定[J]. 中国中药杂志, 2010, 35(11): 1415. Li L, ZHANG C, XIAO YQ, et al. Determination of two stilbene glycoside in five processed products of Rheum palamatum[J]. China J Chin Mater Med, 2010, 35(11): 1415. |
| [11] |
王云, 李丽, 张村, 等. 大黄5种饮片中没食子酸和儿茶素的含量比较研究[J]. 中国中药杂志, 2010, 35(17): 2267. WANG Y, LI L, ZHANG C, et al. Comparison of gallic acid and catechin contents in five processed products of Rheum palamatumm[J]. China J Chin Mater Med, 2010, 35(17): 2267. |
| [12] |
GAO XY, JIANG Y, LU JQ, et al. One single standard substance for the determination of multiple anthraquinone derivatives in rhubarb using high-performance liquid chromatography-diode array detection[J]. J Chromatogr A, 2009, 1216(11): 2118. DOI:10.1016/j.chroma.2008.11.104 |
| [13] |
Zhang L, LIU HY, QIN LL, et al. Global chemical profiling based quality evaluation approach of rhubarb using ultraperformance liquid chromatography with tandem quadrupole time-of-flight mass spectrometry[J]. J Sep Sci, 2015, 38(3): 511. DOI:10.1002/jssc.201400971 |
| [14] |
Jin W, GE RL, WEI QJ, et al. Development of high-performance liquid chromatographic fingerprint for the quality control of Rheum tanguticum Maxim et Balf[J]. J Chromatogr A, 2006, 1132(1-2): 320. DOI:10.1016/j.chroma.2006.08.022 |
| [15] |
KASHIWADA Y, NONAKA GI, NISHIOKA I. Galloylsucroses from rhubarbs[J]. Phytochemistry, 1988, 27(5): 1469. DOI:10.1016/0031-9422(88)80217-6 |
| [16] |
KASHIWADA Y, NONAKA GI, NISHIOKA I. Studies on rhubarb(Rhei Rhizoma). Ⅵ. Isolation and characterization of stilbenes[J]. Chem Pharm Bull, 1984, 32(9): 3501. DOI:10.1248/cpb.32.3501 |
| [17] |
Zhang C, LI L, XIAO YQ, et al. Two new anthraquinone glycosides from the roots of Rheum palmatum[J]. J Asian Nat Prod Res, 2010, 12(12): 1026. DOI:10.1080/10286020.2010.529612 |
| [18] |
SHI YQ, FUKAI T, SAKAGAMI H, et al. Cytotoxic and DNA damage-inducing activities of low molecular weight phenols from rhubarb[J]. Anticancer Res, 2001, 21(4A): 2847. |
| [19] |
QI HY, ZHANG F, ZHANG M, et al. Three new anthraquinones from Polygonum cillinerve[J]. Chin Chem Lett, 2005, 16(8): 1050. |
| [20] |
Nonaka GI, Nishioka I, Nagasawa T, et al. Tannins and related compounds. I. Rhubarb(1)[J]. Chem Pharm Bull, 1981, 29(10): 2862. DOI:10.1248/cpb.29.2862 |
| [21] |
Okabe H, Matsuo K, Nishioka I. Studies on rhubarb(Rhei Rhizoma). Ⅱ. Anthraquinone glycosides[J]. Chem Pharm Bull, 1973, 21(6): 1254. DOI:10.1248/cpb.21.1254 |
| [22] |
NONAKA G, MINAMI M, NISHIOKA I. Studies on rhubarb(Rhei Rhizoma). Ⅲ. Stilbene glycosides[J]. Chem Pharm Bull, 1977, 25(9): 2300. DOI:10.1248/cpb.25.2300 |
 2018, Vol. 38
2018, Vol. 38 
