2. 浙江中医药大学附属第一医院, 杭州 310006
2. The First Affiliated Hospital of Zhejiang Chinese Medical University, Hangzhou 310006, China
丹参、当归均为养血活血之要药,两药配伍具有活血化瘀、益气强心、通脉止痛之功效,常用于治疗血瘀血虚诸证[1]。丹参味苦,性微寒,归心、肝经,具有祛瘀止痛、活血调经等功效,主要含有水溶性的酚酸类成分及脂溶性的共轭醌酮类成分[2-3];当归味甘、辛,性温,归肝、心、脾经,具有补血活血、调经止痛等功效,主要含有挥发油、有机酸及多糖等活性成分[4-5]。目前有关丹参、当归配伍的多成分含量测定尚未见报道,本文采用RP-HPLC多波长切换梯度洗脱技术,建立了同时测定丹参-当归药对中丹参素、绿原酸、阿魏酸、迷迭香酸、丹酚酸B、藁本内酯和丹参酮ⅡA 7个成分含量的HPLC分析方法,可用于丹参-当归药对的质量控制及质量评价,并为其临床应用及开发提供科学依据。
1 仪器与试药 1.1 仪器安捷伦公司Agilent 1200高效液相色谱仪(配备G1322A在线脱气机,G1311A四元梯度泵,G1329A自动进样仪,G1316A柱温箱,G1315D二极管阵列检测器,Agilent色谱工作站);梅特勒公司Mettler XS105DU十万分之一电子分析天平;赛多利斯公司Sartorious BS110S万分之一电子分析天平;Eppendorf公司Centrifuge 5804R高速冷冻离心机;天津市泰斯特仪器有限公司FZ102型微型植物粉碎机;昆山市超声仪器有限公司KQ5200B型超声波清洗器;上海天达仪器有限公司PHS-3TC精密数显酸度计;Eppendorf公司手动移液器。
1.2 试药丹参、当归饮片分别购于杭州胡庆余堂(丹参饮片批号150401,当归饮片批号170201)、方回春堂(丹参饮片批号170705,当归饮片批号170522J)、浙江天道医药有限公司(丹参饮片批号170401,当归饮片批号170501),经浙江中医药大学药学院中药鉴定教研室鉴定分别为唇形科植物丹参(Salvia miltiorrhiza Bge.)的干燥根及根茎和伞形科植物当归(Angelica sinensis(Oliv.)Diels)的干燥根,符合2015年版《中华人民共和国药典》(一部)项下规定。丹参素钠、丹酚酸B、绿原酸和丹参酮ⅡA的对照品均购于中国食品药品检定研究院,纯度 > 98%,批号分别为110855-200506、111562-200807、110753-201415和110766-200416;迷迭香酸、阿魏酸的对照品购于上海源叶生物科技有限公司,纯度 > 98%,批号分别为B20862、B20007;藁本内酯购于成都克洛玛生物科技有限公司,纯度 > 98%,批号为140714。乙腈、甲醇为色谱纯,实验用水为娃哈哈纯净水,其他试剂均为分析纯。
2 方法与结果[6-11] 2.1 溶液的制备 2.1.1 混合对照品溶液分别取丹参素钠(1 g相当于丹参素0.900 0 g)、绿原酸、阿魏酸、丹酚酸B、迷迭香酸、藁本内酯、丹参酮ⅡA的对照品适量,精密称定,加甲醇(丹参素钠加50%甲醇水,丹酚酸B加75%甲醇水)配制成质量浓度分别为1.614(相当于丹参素1.453)、2.001、2.573、2.612、1.921、5.584、0.709 mg·mL-1的各对照品储备液。再精密吸取各对照品储备液适量,置5 mL棕色量瓶中,以甲醇定容至刻度,得每1 mL含丹参素14.53 μg,绿原酸20.01 μg,阿魏酸27.02 μg,迷迭香酸77.80 μg,丹酚酸B 169.8 μg,藁本内酯55.84 μg和丹参酮ⅡA 5.320 μg的混合溶液,即得。
2.1.2 供试品溶液取丹参、当归的饮片粉末(过50目筛)各0.2 g,精密称定,加70%甲醇水30 mL,称量,浸泡30 min,50 ℃超声(功率200 W,频率40 kHz)提取30 min,放冷,称量,用溶剂补足减失的量,过滤,续滤液于4 ℃、12 000 r·min-1下高速冷冻离心15 min,取上清液,即得。
2.1.3 丹参对照溶液取丹参饮片粉末(过50目筛)0.2 g,精密称定,按“2.1.2”项下方法制备丹参对照溶液。
2.1.4 当归对照溶液取当归饮片粉末(过50目筛)0.2 g,精密称定,按“2.1.2”项下方法制备当归对照溶液。
2.2 色谱条件及系统适用性试验色谱柱:Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相:乙腈-0.1%磷酸水溶液,梯度洗脱(表 1);流速:1.0 mL·min-1;柱温:25 ℃;波长切换(表 2);进样量:10 μL。在上述色谱条件下,各检测成分均达到基线分离,理论塔板数均大于2 000。
|
|
表 1 梯度洗脱程序 Table 1 Gradient elution procedures |
|
|
表 2 波长切换时间 Table 2 Wavelength switching events |
精密吸取“2.1”项下混合对照品溶液、供试品溶液及丹参、当归的对照溶液各10 μL,分别在上述色谱条件下进样,得相应的色谱图,如图 1。供试品溶液色谱图中,在与混合对照品色谱图的丹参素、绿原酸、阿魏酸、迷迭香酸、丹酚酸B、藁本内酯、丹参酮ⅡA相应的色谱峰位置上,均有相同保留时间的色谱峰;而丹参对照溶液色谱图中无绿原酸、阿魏酸和藁本内酯峰,当归对照溶液色谱图中无丹参素、迷迭香酸、丹酚酸B和丹参酮ⅡA峰,说明丹参与当归配伍后,对彼此含有的成分的测定不产生干扰。
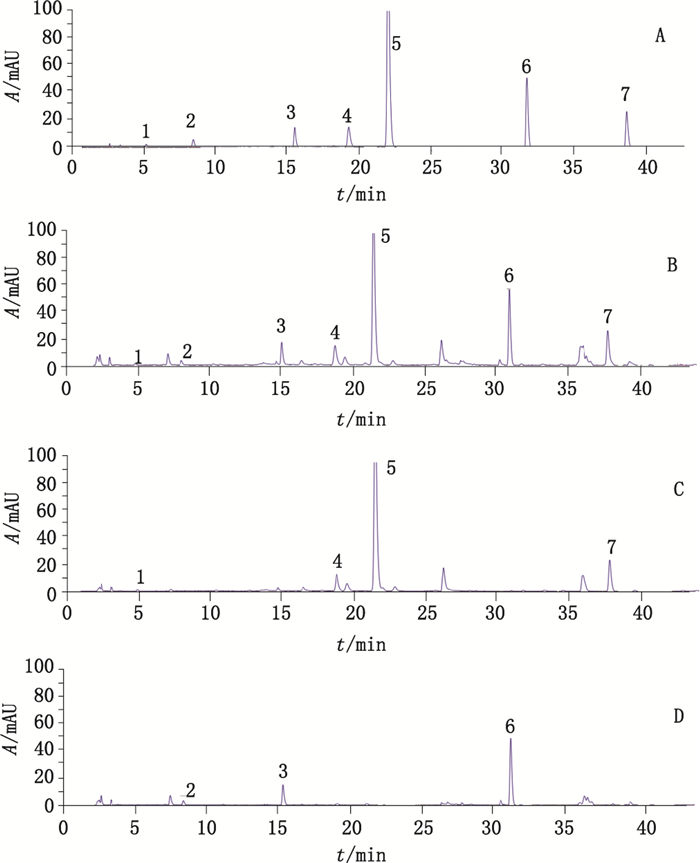
|
1.丹参素(danshensu) 2.绿原酸(chlorogenic acid) 3.阿魏酸(ferulic acid) 4.迷迭香酸(rosmarinic acid) 5.丹酚酸B(salvianolic acid B)6.藁本内酯(ligustilide) 7.丹参酮ⅡA(tanshinone ⅡA) 图 1 混合对照品(A)、样品(B)、丹参(C)、当归(D)的HPLC图 Figure 1 HPLC chromatograms of mixed reference substances (A), sample (B), Salviae Miltiorrhizae Radix et Rhizoma (C)and Angelicae Sinensis Radix (D) |
分别精密吸取上述对照品储备液丹参素20 μL,绿原酸20 μL,阿魏酸25 μL,迷迭香酸55 μL,丹酚酸B 800 μL,藁本内酯200 μL,丹参酮ⅡA 85 μL,置同一2 mL棕色量瓶中,加甲醇定容至刻度,摇匀,得丹参素、绿原酸、阿魏酸、迷迭香酸、丹酚酸B、藁本内酯和丹参酮ⅡA质量浓度分别为14.53、20.01、32.16、52.82、1 045、558.4、30.13 μg·mL-1的混合溶液,再逐级稀释2、5、10、20、50倍,得6个浓度系列的混合对照品溶液;在上述色谱条件下分别进样测定,以各成分的进样量X(ng)为横坐标,相应峰面积Y为纵坐标,进行线性回归,得回归方程,结果见表 3,各成分在线性范围内均有良好的线性关系。
|
|
表 3 线性关系考察结果 Table 3 The results of calibration |
精密吸取“2.1.1”项下的混合对照品溶液,按“2.2”项下色谱条件连续重复进样6次,记录峰面积,结果丹参素、绿原酸、阿魏酸、迷迭香酸、丹酚酸B、藁本内酯和丹参酮ⅡA峰面积的RSD分别为1.2%、0.84%、0.59%、0.62%、0.19%、0.44%和0.58%,表明仪器精密度良好。
2.6 稳定性试验精密吸取同一供试品溶液10 μL,按“2.2”项下色谱条件,分别于0、2、4、6、8、10、12 h进样测定,结果12 h内供试品溶液中丹参素、绿原酸、阿魏酸、迷迭香酸、丹酚酸B、藁本内酯和丹参酮ⅡA峰面积的RSD分别为2.5%、0.48%、2.2%、0.39%、0.21%、0.17%、0.82%,表明供试品溶液在12 h内稳定。
2.7 重复性试验分别取同一批次丹参(批号170401)、当归饮片(批号170501)粉末6份,每份各约0.2 g,精密称定,按“2.1.2”项下方法制成供试品溶液,并在上述色谱条件下进样测定,以外标两点法计算含量,结果样品中丹参素、绿原酸、阿魏酸、迷迭香酸、丹酚酸B、藁本内酯和丹参酮ⅡA的平均含量分别为0.324 0、0.382 0、0.930 5、2.237、47.79、16.41和1.506 mg·g-1,RSD分别为1.7%、1.4%、0.64%、0.68%、0.86%、0.90%和2.0%,表明该方法重复性良好。
2.8 加样回收率试验取已测含量的同一批次丹参饮片(批号170401)、当归饮片(批号170501)粉末6份,每份各约0.1 g,精密称定,分别精密加入与样品中各成分等量的单一成分对照品溶液,按“2.1.2”项下方法制成供试溶液,在上述色谱条件下进样测定,计算加样回收率及其RSD,结果见表 4,均符合要求。
|
|
表 4 加样回收试验结果(n=6) Table 4 Results of recovery tests |
取3个批次的丹参、当归饮片,按“2.1.2”项下方法制成供试品溶液。精密吸取供试品溶液和混合对照品溶液,在上述色谱条件进样测定,以外标两点法计算各成分含量,结果见表 5。
|
|
表 5 含量测定结果(n=3) Table 5 Results of content determination |
采用SPSS 17.0软件对3批丹参-当归饮片中各成分配伍前后的含量进行t检验数据分析,发现丹参-当归配伍后,丹参素和藁本内酯含量显著增加(P < 0.05),而绿原酸、阿魏酸、迷迭香酸、丹酚酸B和丹参酮ⅡA含量无明显变化。
3 讨论 3.1 质量评价指标的确定《中华人民共和国药典》2015年版分别将丹参酮ⅡA和丹酚酸B作为丹参的质量评价指标,将阿魏酸作为当归的质量评价指标。而丹参素、丹酚酸B、丹参酮ⅡA、迷迭香酸均为丹参的主要成分,具有抗炎,促进成骨细胞分化、增殖的作用[12-13];阿魏酸、绿原酸、藁本内酯均为当归的主要成分,具有抗炎镇痛,促进成骨细胞增殖的作用[14-15]。丹参和当归常配伍使用治疗骨关节炎、股骨头坏死等骨科疾病,故本文选择丹参素、绿原酸、阿魏酸、迷迭香酸、丹酚酸B、藁本内酯和丹参酮ⅡA作为丹参-当归药对的质量评价指标。
3.2 提取工艺考察本文单因素考察了提取方式(超声、回流)、提取溶剂(30%、50%、70%甲醇水溶液和30%、50%、70%乙醇水溶液)、提取时间(30、45、60 min)、溶剂倍量(10、20、50、100、150倍)和浸泡时间(0.5、1、2 h),以7个成分的含量为评价指标,最终确定上述样品前处理方法,此条件下各成分提取较完全,提取效率高,干扰杂质峰较少。
3.3 检测波长的选择本文采用波长切换技术,以DAD检测器在200~ 400 nm对7个成分进行光谱扫描,得各成分的最大吸收波长,分别确定280 nm测定丹参素、丹参酮ⅡA,286 nm测定丹酚酸B,320 nm测定绿原酸、阿魏酸、迷迭香酸和藁本内酯,保证各成分均在其最大吸收波长下检测,检测灵敏度高、干扰小。
3.4 流动相的选择以各色谱峰分离度、峰形、出峰时间为指标,比较了甲醇-1%醋酸水、甲醇-3%醋酸水、乙腈-0.1%磷酸水溶液流动相,发现流动相为乙腈-0.1%磷酸水溶液时,各色谱峰分离良好,峰形较好,基线平稳,故选定乙腈-0.1%磷酸溶液作为流动相梯度洗脱。
3.5 小结本文建立了同时测定丹参-当归药对中7个化学成分含量的分析方法,操作简便,重复性好,结果准确可靠,可用于丹参-当归药对及其制剂的质量评价与质量控制,为丹参-当归药对的作用机制研究及临床应用提供依据。
| [1] |
刘春慧. 基于七情配伍理论的丹参药对临床用药规律研究[J]. 中医杂志, 2016, 57(2): 118. LIU CH. Research of clinical medication regularity of Radix Salviae Miltiorrhizae based on the theory of compatibility of seven emotions[J]. J Tradit Chin Med, 2016, 57(2): 118. |
| [2] |
李巧玉, 刘杨, 包华音, 等. 近5年丹参化学成分及药理作用研究进展[J]. 食品与药品, 2014, 16(2): 145. LI QY, LIU Y, BAO HY, et al. Advances in studies on chemical constituents and pharmacological effects of Salvia miltiorrhiza in recent 5 years[J]. Food Drug, 2014, 16(2): 145. |
| [3] |
梁文仪, 陈文静, 杨光辉, 等. 丹参酚酸类成分研究进展[J]. 中国中药杂志, 2016, 41(5): 806. LIANG WY, CHEN WJ, YANG GH, et al. Research progress in salvianolic acids of Salvia miltiorrhiza[J]. China J Chin Mater Med, 2016, 41(5): 806. |
| [4] |
李曦, 张丽宏, 王晓晓, 等. 当归化学成分及药理作用研究进展[J]. 中药材, 2013, 36(6): 1023. LI X, ZHANG LH, WANG XX, et al. Research progress in chemical constituents and pharmacological effects of Angelica sinensis[J]. J Chin Med Mater, 2013, 36(6): 1023. |
| [5] |
张来宾, 吕洁丽, 陈红丽, 等. 当归中苯酞类成分及其药理作用研究进展[J]. 中国中药杂志, 2016, 41(2): 167. ZHANG LB, LÜ JL, CHEN HL, et al. Research progress of structures and pharmacological activities of phthalides from Angelica sinensis[J]. China J Chin Mater Med, 2016, 41(2): 167. |
| [6] |
程沛, 韩东岐, 胡伟慧, 等. 高效液相色谱法同时测定丹参中10种水溶性和4种脂溶性成分的含量[J]. 药物分析杂志, 2015, 35(6): 991. CHENG P, HAN DQ, HU WH, et al. Simultaneous determination of ten hydrophilic compounds and four lipophilic compounds in Radix Salviae Miltiorrhizae by HPLC[J]. Chin J Pharm Anal, 2015, 35(6): 991. |
| [7] |
唐登峰, 祝明, 陈勇, 等. RP-HPLC同时测定冠心宁注射液中丹参素、原儿茶醛、阿魏酸、迷迭香酸和丹酚酸B的含量[J]. 药物分析杂志, 2012, 32(1): 144. TANG DF, ZHU M, CHEN Y, et al. RP-HPLC simultaneous determination of danshensu, protocatechuicaldehyde, ferulic acid, rosmarinic acid, and salvianolicacid B in Guanxinning injection[J]. Chin J Pharm Anal, 2012, 32(1): 144. |
| [8] |
郜舒蕊, 赵志刚, 侯俊玲, 等. 均匀设计法优化丹参中4种活性成分的超声提取工艺[J]. 中国实验方剂学杂志, 2014, 20(10): 8. GAO SR, ZHAO ZG, HOU JL, et al. Optimization of rapid ultrasonic extraction process of four active components from Salviae Miltiorrhizae Radix et Rhizoma by uniform design[J]. Chin J Exp Tradit Med Form, 2014, 20(10): 8. |
| [9] |
温学逊, 牛研, 王书芳, 等. 当归不同药用部位活性成分含量的HPLC分析方法及特征图谱研究[J]. 药物分析杂志, 2014, 34(2): 317. WEN XX, NIU Y, WANG SF, et al. HPLC analysis and characteristic chromatograms of active components in different medicinal parts of Angelicae Sinensis Radix[J]. Chin J Pharm Anal, 2014, 34(2): 317. |
| [10] |
姜鸿, 王光函, 张颖, 等. HPLC法测定火绒草中原儿茶酸、原儿茶醛、绿原酸和咖啡酸[J]. 中成药, 2011, 33(11): 2023. JIANG H, WANG GH, ZHANG Y, et al. Determination of protocatechuic acid, protocatechuic aldehyde, caffeic acid and chlorogenic acid of edelweiss by HPLC[J]. Chin Tradit Pat Med, 2011, 33(11): 2023. DOI:10.3969/j.issn.1001-1528.2011.11.052 |
| [11] |
顾志荣, 王亚丽, 孙宇靖, 等. 当归中5种成分同时测定与产地质量评价[J]. 中成药, 2014, 36(10): 2135. GU ZR, WANG YL, SUN YJ, et al. Simultaneous determination and quality evaluation of 5 components in Angelica sinensis[J]. Chin Tradit Pat Med, 2014, 36(10): 2135. DOI:10.3969/j.issn.1001-1528.2014.10.028 |
| [12] |
张晓, 张国庆, 顾伯林, 等. 丹参及其有效成分对骨代谢影响的实验研究进展[J]. 中国骨质疏松杂志, 2015, 21(1): 112. ZHANG X, ZHANG GQ, GU BL, et al. Experimental research progress of the effect of Salvia miltiorrhiza and its active ingredients on bone metabolism[J]. Chin J Osteoporos, 2015, 21(1): 112. DOI:10.3969/j.issn.1006-7108.2015.01.025 |
| [13] |
BAI B, LI Y. Danshen prevents articular cartilage degeneration via antioxidation in rabbits with osteoarthritis[J]. Osteoarthritis Cartilage, 2016, 24(3): 514. DOI:10.1016/j.joca.2015.10.004 |
| [14] |
高建林, 陈珺, 李兵. 阿魏酸对体外培养的成骨细胞增殖、分化和矿化功能的影响[J]. 中国药理学通报, 2016, 32(10): 1479. GAO JL, CHEN J, LI B. Effects of ferulic acid on proliferation, differentiation and mineralization of osteoblasts cultured in vitro[J]. Chin Pharmacol Bull, 2016, 32(10): 1479. DOI:10.3969/j.issn.1001-1978.2016.10.030 |
| [15] |
ZHU MD, ZHAO LX, WANG XT, et al. Ligustilide inhibits microglia-mediated proinflammatory cytokines production and inflammatory pain[J]. Brain Res Bull, 2014, 109: 54. DOI:10.1016/j.brainresbull.2014.10.002 |
 2018, Vol. 38
2018, Vol. 38 
