作为遥感监测手段的高光谱成像技术,最早的起源可追溯到其在航空成像领域中的应用[1]。随着光谱技术和计算机技术的飞速发展,高光谱成像技术的应用领域现已拓展至农业、工业及医药科学等领域[2]。高光谱成像作为一种新型的光谱测量方法,相比传统的光谱测量技术有其显著的优势,即可同时获得被测样品的光谱信息及空间信息。用于采集高光谱数据的测量系统被称为高光谱成像系统,与传统光谱仪器只采集光源照射点位置的光谱信息不同,该系统是以测量范围内被测试样所覆盖面积的像素点为单位采集光谱信息,而且相比于传统成像技术仅采集光谱维度上R、G、B 3个通道的信息而言,高光谱成像技术是在光谱维度上设置N个通道(例如800~1 500 nm内,隔2 nm设置1个采集通道,共计351个通道),将光谱维度进行拓展,其结果是高光谱成像系统不仅可以获取被测试样表面上每个点的光谱数据,还可以获取测量波长范围内任何1个波长的影像信息,这使其测量结果中包含的数据量非常庞大,所以测量结果可以更加全面地反映与被测试样整体性质和属性相关的特征。高光谱成像的上述特点对于需要全面了解与被测试样整体性质(如成分分布)相关的研究而言是非常有利的,但是另一方面,信息量的增大必然使得所采集到的光谱数据量增大,这对于接下来的数据解析过程是一个新的挑战。而且由于高光谱成像系统的数据采集特点,系统获得的直接数据必须通过相应的光谱转换和校正处理之后才可用于进一步的数据解析。所以,对于高光谱成像技术而言,对测量数据进行合理的数据处理是非常重要,且是必不可少的过程。
根据测量用光谱波段和测量原理的差异,可将高光谱成像分为拉曼、紫外、可视、红外及近红外高光谱成像。其中,近红外波段的光谱域较宽,测量方式简单,测量结果中包含的关于被测试样的信息量大,所以近红外高光谱成像作为应用最广泛的高光谱成像系统,已应用于包括环境监测、食品药品安全监管及质量控制在内的研究领域[3-5]。由于近红外高光谱成像属于无损检测技术,即测量前后被测试样的物理化学性质不发生任何变化,且无需对被测试样进行预处理,所以其作为在线检测手段,对生产过程及最终产品进行质量控制和监测的潜在应用是各领域研究者共同关注的焦点。本文将从近红外高光谱成像系统的构造、数据采集方式、数据结构、数据处理方法等方面进行综合阐述,并总结其在药物分析领域内的应用现状,对高光谱成像技术在该领域内的应用前景进行展望。
1 近红外高光谱成像系统及数据采集方式近红外高光谱成像系统一般由光源、光谱相机(包含镜头或滤光片、单色器、入/出射狭缝、检测器)、计算机系统、移动式样品台等构成[6]。光源是能提供近红外辐射的部件,由于卤素灯发射光的波长范围较宽,可覆盖可视及近红外波段,所以卤素灯是应用最为普遍的光源。由光源发射出的光,被样品表面反射后,经由滤光片或镜头进入到光谱相机里,再经过特定宽度的入射狭缝后被单色器(一般为光栅式分光器)分光,经出射狭缝被检测器按不同波长记录信号。计算机系统负责将上述光电信号转换成数字信号,并予以记录和保存。而样品台是用于放置被测试样的部件,但其具体形式(移动式或固定式)取决于近红外高光谱成像系统的数据采集方式。
近红外高光谱成像系统的数据采集方式可分为2种,分别为凝视采集和扫描采集[7]。凝视采集是通过利用光谱相机前置的滤光片(可通过调节滤光片,从而控制进入光谱相机内的入射光的波长)过滤波长,从而获得各个像素点位置的不同波长处的光谱信息。以该方法采集数据时,光谱相机和被测试样的位置都是固定的,无需进行移动,所以称之为凝视采集。而扫描采集是通过将光谱相机与被测试样进行相对移动,以点或线为单位获得被测试样的光谱信息。由于以点为单位采集光谱数据时,消耗时间过长,且易受到噪音的影响,所以以线为单位的采集方式最为常见。本文将以该采集方式的应用作为前提,进行以下叙述。
近红外高光谱成像系统的构造如图 1。通过固定光谱相机,以水平方向移动载有被测试样的样品台,以线为单位逐一采集整个被测试样各个像素点对应的光谱数据,即每1次扫描获得的是垂直于样品台移动方向上的1条直线所对应的各个像素点的光谱信息。由于该系统是基于扩散反射原理进行的光谱数据采集,所以为了获取被测试样的相对反射率,必须用相应的标准反射板作为标准,事先采集背景光谱,进而计算相对反射率。在计算相对反射率时,检测器的噪音、不同像素点光源照射强度的差异等因素是无法被忽略的,即需要进行相应的光谱校正。
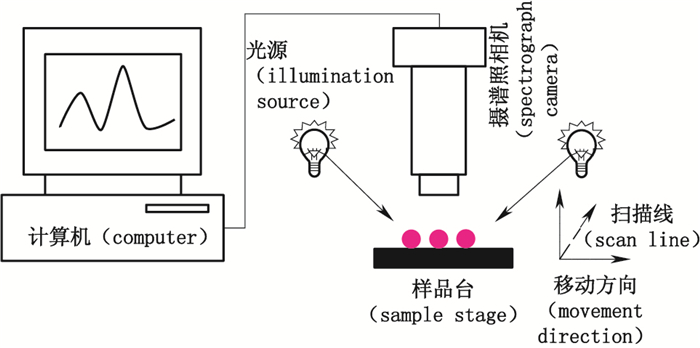
|
图 1 高光谱成像系统的组成 Figure 1 Component of a hyperspectral imaging system |
近红外高光谱成像是通过采集不同像素点位置的光谱信息而产生的三维数据[8]。线为单位采集数据的近红外高光谱成像系统,每1次扫描获得的是直线上相对应的所有像素点的光谱数据,即进行1次扫描时阵列式检测器上每1列光学元件记录的是扫描直线上对应像素点位置的光谱数据。通过移动样品台,进行连续扫描,采集得到被测试样覆盖全部像素点位置的光谱数据。如图 2。

|
图 2 显示高光谱成像数据的光谱与空间维度关系的示意图 Figure 2 Schematic representation of hyperspectral imaging data showing the relationship between spectral and spatial dimensions |
传统近红外光谱数据是以波长为横坐标,吸收度为纵坐标的二维数据。而近红外高光谱数据相当于在上述的光谱数据上增加1个用以表示空间位置的维度,即整体被测试样的光谱信息都会被包含在测量结果里,所以也被称作近红外高光谱数据立方体(hyperspectral data cube)。
3 数据处理的原理 3.1 反射率校正上述近红外高光谱数据是以被测平面上的线为单位进行扫描后,叠加而得的。在进行数据处理前,需要进行数据排列格式的转换(将数据模块转换成各波长下像素点位置的反射率或灰度值的数据块),以便于抽取被测试样覆盖面积所对应各像素点的光谱数据或选取某一波长下的图像数据,从而进行进一步的数据解析。
近红外高光谱成像系统采集的直接数据并不是反射率(R:reflectance value),而是灰度值(G:gray value)。根据其测量原理,需采集标准反射板的近红外高光谱数据(GBack ground)后,将灰度值转换为反射率。而且,由于测量过程当中检测器的噪音(暗电流,GDark)与波长存在依存关系,所以在计算反射率时必须对其进行校正[9]。反射率的校正,可依照公式(1)进行。
| $ R = \frac{{{G_{{\rm{sample}}}} - {G_{{\rm{Dark}}}}}}{{{G_{{\rm{Background}}}} - {G_{{\rm{Dark}}}}}} $ | (1) |
式中,GDark值是通过遮蔽光学相机的镜头(无任何反射光进入光学相机的状态)采集得到的检测器信号。
在绝大多数情况下,应关注的是与吸收度值相关的被测试样的物理化学特征,所以需将反射率转换成吸收度。
按公式(2)进行转换:
| $ A = \log R $ | (2) |
从近红外高光谱数据中提取操作感兴趣区域(region of interest:ROI)的光谱数据是解析数据的前提[10]。所谓ROI光谱,系指近红外高光谱数据中被测试样覆盖的像素所对应的光谱数据,其提取方法分为直接选取法和主成分分析法2种。直接选取法可利用MATLAB、OpenCV等可编写菜单式界面的软件,直接由某个波长下的成像图,用光标选择的方式定位ROI光谱范围,从而提取ROI光谱;主成分分析法是根据ROI光谱与背景(样品台)光谱的差异进行分离提取的方法。由于ROI光谱与背景光谱有着显著的差异,利用主成分分析法很容易将其分离,从而得到ROI光谱[11]。
3.2.2 预处理方法近红外波段吸收峰重叠严重,且由于被测试样表面散射光的影响,吸收曲线的基线常存在漂移等现象,将直接影响识别和提取与被测试样属性相关的光谱信息。所以,基于分离重叠吸收峰、校正基线漂移等目的,选择合理的光谱预处理方法对ROI光谱进行数据处理是降低上述不利因素影响的必要措施。现阶段,对光谱预处理方法的研究是化学计量学领域中非常热门的话题之一。常见的光谱预处理方法有平滑处理、微分处理(Savitzky-Golay)、Standard Normal Variate(SNV)、Multiplicative Scatter Correction(MSC)、小波变换、傅里叶变换等。多个研究实例证明[12-17],上述这些光谱预处理方法的应用,能够很好地提高近红外高光谱数据中与被测试样属性相关的光谱信息的有效率。
3.3 波长选择由于近红外高光谱成像系统的测量结果中既含有被测试样的空间信息,又含有光谱信息,所以其数据量是非常庞大的。数据量的增大必然会增加后续对其进行分析解析的难度。虽然ROI光谱的提取在一定程度上减小了近红外高光谱数据的数据量,但近红外光谱域宽,采集数据点(波数/波长)较多,致使用于分析解析的数据量仍然较大。在采集的近红外光谱中,有些波段的光谱信息与被测试样的属性相关性弱或无相关性,有些波段虽然含有与被测试样属性相关的光谱信息,但由于该波段受噪音的影响较大,容易导致数据分析结果产生较大的误差。所以,为了减小数据量和分析结果的误差,剔除无信息波段或选择有效波段(波长选择),对后续的建立模型等操作有重要的意义。
现已提出的波长选择方法较多,其原理及适用范围不尽相同,所以选择合适的波长选择方法是建立有效模型的关键[18]。较简单的方法有手动选择和基于线性回归的选择方法。前者是根据仪器测量数据的特点,即最小波段及最大波段处的信噪比较高,在建立模型前将该范围的光谱信息去除的方法;后者是根据浓度与吸光度的线性回归结果,即相关系数的大小选择波长的方法。除此之外,一些基于复杂算法的波长选择方法也相继被报道。例如,用于减少多重共线性的Successive Projection Algorithm法、剔除无效信息的Uninformative Variable Elimination法、基于概率全局优化技术提出的Simulated Annealing法、模仿人脑功能的Artificial Neural Networks法、模拟遗传学机理的Genetic Algorithm法、选择连续波段的Interval Selection Method、Moving Window Partial Least Squares Regression、基于预测均方差的Backward Variable Selection Method for PLS Regression等[19-25]方法。无论是哪一种波长选择方法,目的都是为了简化模型,减小误差,至于使用哪种方法最为合理,取决于被测试样及目标成分的光谱特点。
3.4 模型的建立及评价本文所述“模型”是指对试样的近红外光谱数据和传统分析方法的测试结果(定性属性或定量浓度)进行相关分析后,建立的根据样品的近红外光谱,推算样品定性或定量信息的数学模型。
近红外吸收峰的信号弱且重叠严重,很难对吸收峰进行归属,所以简单的一元回归分析无法建立有效的预测模型(无特征波长),而传统的多重线性回归分析是以测量大量的样品光谱为前提,且近红外光谱上各波长处的吸收度数据间存在多重共线性,所以预测模型的精度往往无法达到实际应用要求的预测精度。为了减少构建模型时所需的样品数量,并去除或减少各波长间的多重共线性,潜变量回归(latent variable regression)分析已成为利用多变量(波长)数据建立模型的主要方法。现阶段已提出的潜变量回归分析的具体算法种类繁多,但其最终目的皆为降低数据维度,提取有效信息,从而提高预测模型的精度。例如,主成分回归、偏最小二乘回归、聚类分析、机器学习、自建模曲线解析等算法在实际研究中的应用[26-30],已证明该类算法将大大改善所建立模型的预测精度。
验证近红外模型的预测精度,即评价基于近红外光谱的预测值的准确度(相对于标准值),对于创建近红外快速无损检测方法而言至关重要。在近红外光谱法中预测模型的验证可分为交叉验证和外部验证2种方法[31-33]。样品数量较少时往往采用交叉验证法作为评价模型预测精度的方法,而样品数量相对较多时采用外部验证法能更客观(避免过拟合)地评价模型的预测能力。
4 医药领域中的应用 4.1 药材及制剂(片剂)的鉴别保证药材及制剂的质量(真伪、优劣)是确保用药安全及再加工处理的前提条件。传统近红外光谱仪只采集试样被光源照射部位的光谱进行鉴别分析,光谱缺乏代表性,鉴别结果很容易受到成分分布不均匀,试样表面的凹凸差异等因素的影响,有时会导致鉴别模型的预测精度降低。相比于传统近红外光谱仪,近红外高光谱系统采集的光谱更具有代表性,抗噪音能力强,所以基于近红外高光谱的数据解析更容易捕捉到与待测试样属性(真伪、优劣)相关的光谱信息,有利于建立分辨能力更强,预测精度更高的鉴别模型。近红外高光谱成像技术作为药材及制剂质量控制手段的应用研究已被报道,且受关注度越来越高。例如,近红外高光谱结合化学计量学算法,对常用药用植物紫锥菊3个品种的鉴别研究[34]、八角茴香和毒八角茴香的鉴别研究[35]、高血压药(bisoprolol-hemifumerate)和伪品的鉴别研究[36]等。总结相关研究的结论,可以得知基于近红外高光谱的药材及制剂(片剂)鉴别方法具有良好的预测精度,表示近红外高光谱技术有潜力作为鉴别药材及制剂的检测手段。
4.2 药物片剂中有效成分及辅料的分布药效成分及辅料的均匀分布是确保固体剂型的质量,保证用药准确性和疗效的前提,也是制药行业质量控制环节中重点关注的问题之一。传统近红外光谱是二维数据,即吸收度(或反射率)对波长(或波数)的变化曲线,只反映光源照射点位置处目标成分的定量信息,无法对该成分在被测试样整体当中的分布情况进行描述。而近红外高光谱则是三维数据,是通过在传统近红外光谱二维数据的基础上增加1个维度,即空间维度,获得的复杂数据体系。该数据体系可视为以像素元为单位,将被测试样分割成多个子试样后,分别采集各个子试样的近红外光谱而得到的,即数据体系中的各个近红外光谱可以反映与其对应的像素元位置处目标成分的定量信息。所以通过对近红外高光谱数据的解析,可以描述目标成分在被测试样整体当中的分布情况。近红外高光谱成像技术作为评价药效成分及辅料分布均匀性的检测手段,已广泛应用于片剂成分分布相关的研究领域,并逐步展现出其在片剂质量控制环节中不可代替的作用。例如,近红外高光谱结合多元曲线分辨技术(无需校正组的建模方法),对劳拉西泮片剂中劳拉西泮成分及4种不同辅料的分布情况,4种不同厂家的阿司匹林片剂中乙酰水杨酸成分的分布情况进行了预测[37-42],近红外高光谱结合Self-modeling curve resolution analysis(SMCR)解析,对片剂中药效成分己酮可可碱及辅料棕榈酸的分布情况进行了预测[43],均获得了满意的预测结果,表明近红外高光谱成像技术有望成为提高片剂质量控制现代化程度的有效手段。
4.3 载药薄膜的监测聚合物载药薄膜作为药物传递系统,具有缓释、靶向给药等作用。在制药过程中如何监测载药薄膜的组成和分布情况对控制药物质量而言意义重大。如前所述,近红外高光谱数据不仅包含与目标成分分布相关的信息,而且光谱的代表性又强,所以近红外高光谱成像技术可提供解决上述问题的有效途径。Guilherme等[44]利用近红外高光谱成像技术,对扑热息痛载药薄膜中各组分(羟丙基甲基纤维素、聚乙烯吡咯烷酮、聚乙二醇)进行了定量研究,结果显示,基于近红外高光谱建立的预测载药薄膜组分分布情况及各组分相对含量的方法具有较高的预测精度。表明近红外高光谱成像技术可作为研究载药薄膜的均匀性及组成的有力工具,为进一步了解药物传递系统的释药特性提供技术支持。
5 总结近红外高光谱数据包含了被测试样的光谱及空间信息,数据量庞大,必须利用相应的化学计量学方法提取有效信息,建立模型,从而预测被测试样的属性和特点。相比于传统近红外光谱而言,更有利于深入了解被测试样的性质。
近红外高光谱技术作为药物生产及质量控制环节中的实时监测手段,已广泛应用于包括中药原药材、中成药、片剂等在内的各个研究领域。随着仪器硬件技术及数据处理方法的进一步发展,该技术有潜力成为高效能的在线检测手段,实际应用于在线监测领域。
| [1] |
MEHTA N, SHAIK S, DEVIREDDY R, et al. Hyperspectral Remote Sensing:Principle and Applications[M]. Boca Raton, Florida: CRC Press, 2012.
|
| [2] |
BARBARA B, WALTRAUD K, KARSTEN R, et al. Hyperspectral imaging:a review of best practice, performance and pitfalls for in-line and on-line application[J]. J Near Infrared Spectrosc, 2012, 20(5): 438. DOI:10.1255/jnirs.1003 |
| [3] |
MORONI M, LUPO E, MARRA E, et al. Hyperspectral image analysis in environmental monitoring:setup of a new tunable filter platform[J]. Procedia Environ Sci, 2013, 19(6): 885. |
| [4] |
GOWEN AA, DONNELL CPO, CULLEN PJ, et al. Hyperspectral imaging-an emerging process analytical tool for food quality and safety control[J]. Food Sci Technol, 2007, 18(12): 590. DOI:10.1016/j.tifs.2007.06.001 |
| [5] |
GOWEN AA, DONNELL CPO, CULLEN PJ, et al. Recent application of chemical imaging to pharmaceutical process monitoring and quality control[J]. Eur J Pharm Biopharm, 2008, 69(1): 10. DOI:10.1016/j.ejpb.2007.10.013 |
| [6] |
DIMITRIS M, RONALD L, THOMAS C. Hyperspectral Imaging Remote Sensing:Physics, Sensors, and Algorithms[M]. Cambridge: Cambridge University Press, 2016.
|
| [7] |
GABRIELE R. Near-infrared spectroscopy and imaging:basic priciples and pharmaceutical applications[J]. Adv Drug Deliv Rev, 2005, 57(8): 1109. DOI:10.1016/j.addr.2005.01.020 |
| [8] |
AMIGO JM. Practical issues of hyperspectral imaging analysis of solid dosage forms[J]. Anal Bioanal Chem, 2010, 398(1): 93. DOI:10.1007/s00216-010-3828-z |
| [9] |
GENDRIN C, ROGGO Y, COLLET C. Pharmaceutical application of vibrational chemical imaging and chemometrics:a review[J]. J Pharm Biomed Anal, 2008, 48(3): 533. DOI:10.1016/j.jpba.2008.08.014 |
| [10] |
GIORDANO R, GUCCIONE P.ROI-based on-board compression for hyperspectral remote sensing images on GPU[J].Sensors(Basel), 2017, 17(5).pii: E1160.doi: 10.3390/s17051160 https://pdfs.semanticscholar.org/19b9/37b60b449c5d6c349f137c1cccf9192fbd99.pdf
|
| [11] |
SACRE PY, De BLEYE C, CHAVEZ PF, et al. Data processing of vibrational chemical imaging for pharmaceutical applications[J]. J Pharm Biomed Anal, 2014, 101: 123. DOI:10.1016/j.jpba.2014.04.012 |
| [12] |
VIDAL M, AMIGO JM. Pre-processing of hyperspectral image.Essential steps before image analysis[J]. Chemometr Intell Lab Syst, 2012, 117(6): 138. |
| [13] |
CANDOLFI A, de MAESSCHALCK R, MASSART DL, et al. The influence of data pre-processing in the pattern recognition of excipients near-infrared spectra[J]. J Pharm Biomed Anal, 1999, 21(1): 115. DOI:10.1016/S0731-7085(99)00125-9 |
| [14] |
RINNAN A, van den BERG F, ENGELSEN SB. Review of the most common pre-processing techniques for near-infrared spectra[J]. TrAC Trends Anal Chem, 2009, 28(10): 1201. DOI:10.1016/j.trac.2009.07.007 |
| [15] |
YANG XL, WANG F. Pre-processing influence on near-infrared spectra for determination of volatile in lignite coal samples[J]. Adv Mater Res, 2014, 898: 831. DOI:10.4028/www.scientific.net/AMR.898 |
| [16] |
LASCH P. Spectral pre-processing for biomedical vibrational spectroscopy and microspectroscopic imaging[J]. Chemometr Intell Lab Syst, 2012, 117(6): 100. |
| [17] |
ZHANG L, LU HS, YAN HW, et al. Research on preprocessing method of near-infrared spectroscopy detection of coal ash calorific value[J]. Spectrosc Spect Anal, 2013, 33(12): 3212. |
| [18] |
ZOU XB, ZHAO JW, MALCOLM JWP, et al. Variables selection methods in near-infrared spectroscopy[J]. Anal Chim Acta, 2010, 667(1-2): 14. DOI:10.1016/j.aca.2010.03.048 |
| [19] |
MARIO CUA, TERESA C BS, ROBERTO KHG, et al. The successive projections algorithm for variable selection in spectroscopic multicomponent analysis[J]. Chemometr Intell Lab Syst, 2001, 57(2): 65. DOI:10.1016/S0169-7439(01)00119-8 |
| [20] |
CAI WS, LI YK, SHAO XG. A variable selection method based on uninformative variable elimination for multivariate calibration of near-infrared spectra[J]. Chemometr Intell Lab Syst, 2008, 90(2): 188. DOI:10.1016/j.chemolab.2007.10.001 |
| [21] |
SHI JY, HU XT, ZOU XB, et al. A heuristic and parallel simulated annealing algorithm for variable selection in near-infrared spectroscopy analysis[J]. J Chemometr, 2016, 30(8): 442. DOI:10.1002/cem.v30.8 |
| [22] |
PEREZ-MARIN D, GARRIDO-VARO A, GUERRERO JE, et al. Use of artificial neural networks in near-infrared reflectance spectroscopy calibrations for predicting the inclusion percentages of wheat and sunflower meal in compound feeding stuffs[J]. Appl Spectrosc, 2006, 60(9): 1062. DOI:10.1366/000370206778397506 |
| [23] |
BRANDYE MS, GEMPERLINE PJ. Wavelength selection and optimization of pattern recognition method using the genetic algorithm[J]. Anal Chim Acta, 2000, 423(2): 167. DOI:10.1016/S0003-2670(00)01114-4 |
| [24] |
JIANG JH, BERRY RJ, OZAKI Y, et al. Wavelength interval selection in multicomponent spectral analysis by moving window partial least-squares regression with applications to mid-infrared and near-infrared spectroscopic data[J]. Anal Chem, 2002, 74(14): 3555. DOI:10.1021/ac011177u |
| [25] |
FERNÁNDEZ PIERNA JA, ABBAS O, BAETEN V, et al. A backward variable selection method for PLS regression (BVSPLS)[J]. Anal Chim Acta, 2009, 642(1-2): 89. DOI:10.1016/j.aca.2008.12.002 |
| [26] |
ROGGO Y, CHALUS P, MAURER L, et al. A review of near infrared spectroscopy and chemometrics in pharmaceutical technologies[J]. J Pharm Biomed Anal, 2007, 44(3): 683. DOI:10.1016/j.jpba.2007.03.023 |
| [27] |
RAVN C, SKIBSTED E, BRO R. Near-infrared chemical imaging(NIR-CI)on pharmaceutical solid dosage forms-comparing common calibration approaches[J]. J Pharm Biomed Anal, 2008, 48(3): 554. DOI:10.1016/j.jpba.2008.07.019 |
| [28] |
CANDOLFI A, de MAESSCHALCK R, MASSART DL, et al. Identification of pharmaceutical excipients using NIR spectroscopy and SIMCA[J]. J Pharm Biomed Anal, 1999, 19(6): 923. DOI:10.1016/S0731-7085(98)00234-9 |
| [29] |
LAI YH, NI YG, KOKOT S. Discrimination of Rhizoma Corydalis from two sources by near-infrared spectroscopy supported by the wavelet transform and least-squares support vector machine methods[J]. Vib Spectrosc, 2011, 56(2): 154. DOI:10.1016/j.vibspec.2011.01.007 |
| [30] |
TAN K, HU J, DU PJ, et al. A novel semi-supervised hyperspectral image classification approach based on spatial neighborhood information and classifier combination[J]. ISPRS J Photogramm Remote Sens, 2015, 105: 19. DOI:10.1016/j.isprsjprs.2015.03.006 |
| [31] |
BLANCO M, EUSTAQUIO A, GONZALEZ JM, et al. Identification and quantitation assays for intact tablets of two related pharmaceutical preparations by reflectance near-infrared spectroscopy:validation of the procedure[J]. J Pharm Biomed Anal, 2000, 22(1): 139. DOI:10.1016/S0731-7085(99)00274-5 |
| [32] |
BLANCO M, ROMERO MA, ALCALA M. Strategies for constructing the calibration set for a near infrared spectroscopic quantitation method[J]. Talanta, 2004, 64(3): 597. DOI:10.1016/j.talanta.2004.03.027 |
| [33] |
HASWELL SJ, WALMSLEY AD. Chemometrics:the issues of measurement and modelling[J]. Anal Chim Acta, 1999, 400(s1-3): 399. |
| [34] |
SANDASI M, VERMAAK I, VILJOEN AM. Hyperspectral Imaging and chemometric modeling of echinacea-a novel approach in the quality control of herbal medicines[J]. Molecules, 2014, 19(9): 13104. DOI:10.3390/molecules190913104 |
| [35] |
VERMAAK I, VILJOEN A, LINDSTROM SW. Hyperspectral imaging in the quality control of herbal medicines-the case of neurotoxic Japanese star anise[J]. J Pharm Biomed Anal, 2013, 75(75C): 207. |
| [36] |
PUCHERT T, LOCHMANN D, MENEZES JC, et al. Near-infrared chemical imaging (NIR-CI)for counterfeit drug identification-a four-stage concept with a novel approach of data processing(Linear Image Signature)[J]. J Pharm Biomed Anal, 2010, 51(1): 138. DOI:10.1016/j.jpba.2009.08.022 |
| [37] |
FRANCH-LAGE F, AMIGO JM, SKIBSTED E, et al. Fast assessment of the surface distribution of API and excipients in tablets using NIR-hyperspectral imaging[J]. Int J Pharm, 2011, 411(1-2): 27. DOI:10.1016/j.ijpharm.2011.03.012 |
| [38] |
CRUZ J, BLANCO M. Content uniformity studies in tablets by NIR-CI[J]. J Pharm Biomed Anal, 2011, 56(2): 408. DOI:10.1016/j.jpba.2011.04.018 |
| [39] |
SACRÉ PY, LEBUN P, CHAVEZ PF, et al. A new criterion to assess distributional homogeneity in hyperspectral images of solid pharmaceutical dosage forms[J]. Anal Chim Acta, 2014, 818: 7. DOI:10.1016/j.aca.2014.02.014 |
| [40] |
ROSAS JG, ARMENTA S, CRUZ J, et al. A new approach to determine the homogeneity in hyperspectral imaging considering the particle size[J]. Anal Chim Acta, 2013, 787(13): 173. |
| [41] |
ROSAS JG, BLANCO M. A criterion for assessing homogeneity distribution in hyperspectral images.Part 2:application of homogeneity indices to solid pharmaceutical dosage forms[J]. J Pharm Biomed Anal, 2012, 70(21): 691. |
| [42] |
PALOU A, CRUZ J, BLANCO M. Determination of drug, excipients and coating distribution in pharmaceutical tablets using NIR-CI[J]. J Pharm Anal, 2012, 2(2): 90. DOI:10.1016/j.jpha.2011.11.003 |
| [43] |
AWA K, OKUMURA T, SHINZAWA H, et al. Self-modeling curve resolution (SMCR)analysis of near-infrared (NIR)imaging data of pharmaceutical tablets[J]. Anal Chim Acta, 2008, 619(1): 81. DOI:10.1016/j.aca.2008.02.033 |
| [44] |
ALEXANDRINO GL, POPPI RJ. NIR imaging spectroscopy for quantification of constituents in polymers thin films loaded with paracetamol[J]. Anal Chim Acta, 2013, 765: 37. DOI:10.1016/j.aca.2012.12.017 |
 2018, Vol. 38
2018, Vol. 38 
