救必应胃痛片由木香、救必应、高良姜、肉桂、陈皮、甘草流浸膏、碳酸氢钠和三硅酸镁八味药组成,除甘草流浸膏外,其余七味以粉末入药,具有镇痛、解痉、制酸、健胃功效,是广西圣特药业自行研制开发的非处方药,用于胃、十二指肠溃疡,慢性胃炎属肝胃不和证者。现行版质量标准为国家食品药品监督管理局颁布的WS-10593(ZD-0593)-2002-2012Z[1],其【鉴别】项下无植物药(木香、救必应、肉桂、高良姜和陈皮)的显微特征鉴别方法;薄层色谱鉴别方法操作烦琐;【含量测定】项下只有橙皮苷的含量测定、碳酸氢钠和三硅酸镁的限值。本文拟建立以下方法:(1)建立木香、救必应、肉桂、高良姜和陈皮的显微特征鉴别法;(2)简化橙皮苷、桂皮醛和木香的薄层色谱鉴别法,增加木香烃内酯和去氢木香烃内酯的薄层色谱鉴别法;(3)简化及改进原标准中检测橙皮苷含量的高效液相色谱法,增加木香烃内酯、去氢木香烃内酯、桂皮醛3个含量控制指标成分,建立同时测定橙皮苷、木香烃内酯、去氢木香烃内酯和桂皮醛含量的方法。
1 仪器与试药 1.1 仪器Waters 1525型高效液相色谱仪,DM500显微成像仪(德国徕卡显微系统有限公司),电子分析天平Merttler AE200和XS205(瑞士梅特勒公司),TLC Visualizer全自动薄层色谱成像仪(瑞士卡玛公司),超声波清洗器AS7240BT(天津奥特赛恩斯仪器有限公司)。
1.2 试剂硅胶G板(青岛海洋化工厂,规格:20 cm×20 cm),甲醇为色谱纯,水为超纯水,其余试剂均为分析纯。
1.3 试药 1.3.1 原药材来源及批号救必应(批号20140628),肉桂(批号20130903),陈皮(批号20141103),木香(批号20130121),高良姜(批号20150925),由广西圣特药业有限公司提供(购于广西玉林药材市场),经广西中医药大学中药鉴定教研室蔡毅教授鉴定之后用于实验。
1.3.2 对照药材、对照品批号及来源救必应(批号1076-9901),肉桂(批号121363-200401),陈皮(批号120969-200507),木香(批120921-201309),高良姜(批号121263-200502),木香烃内酯(批号111524-200503),去氢木香烃内酯(批号111525-200505),橙皮苷(批号110721-200512),桂皮醛(批号110710-201418,含量99.4%),均来源于中国食品药品检定研究院。
1.3.3 样品救必应胃痛片(批号131001、131101、140101、140102、140301、140601、141101、150101、150301、150601、151001、151201、160101)共13批,规格为0.36g·片-1,均来自广西圣特药业有限公司。
2 显微鉴别方法与结果 2.1 实验方法分别取5种原药材粉末、5种对照药材粉末和样品粉末少许,置载玻片上,滴加水合氯醛试液,盖上盖玻片,在高倍镜下(400倍)观察。
2.2 实验结果在显微镜下观察,5种原药材粉末、5种对照药材粉末、按处方比例混合的对照药材粉末及样品粉末的显微图谱见图 1~13。

|
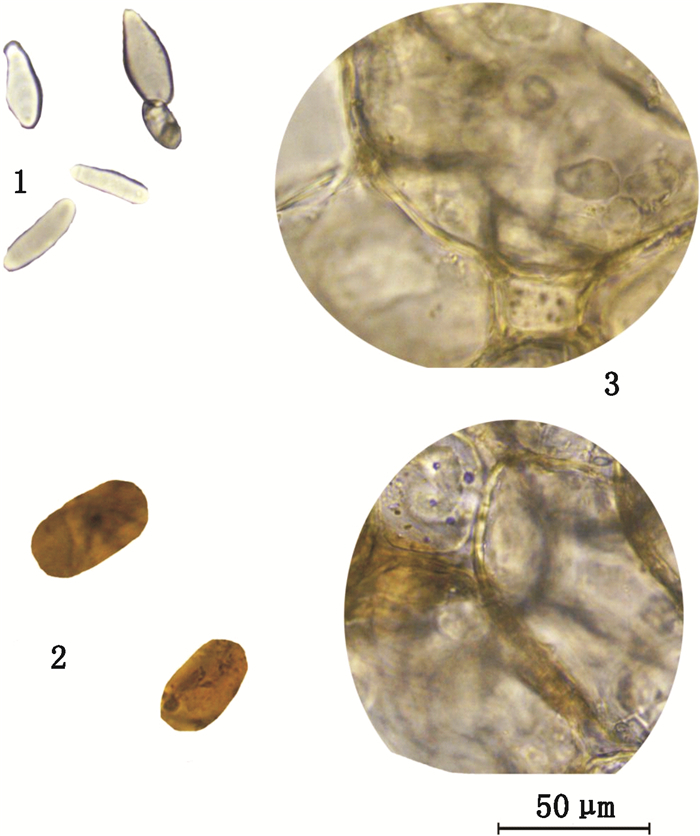
1.草酸钙方晶(calcium oxalate crystals)2.果皮表皮细胞(Pericarp epidermis cell)3.螺纹导管(spiral cell)4.橙皮苷结晶(hesperidin crystal) 图 1 陈皮对照药材粉末显微图 Figure 1 Contrast micrographs of Citri Reticulatae Pericarpium medicinal powder |
|
1.淀粉粒(starch grain)2.分泌细胞(secretory vessel)3.表皮细胞(epidermis cell) 图 2 高良姜对照药材粉末显微图 Figure 2 Contrast micrographs of Alpinae Officinarum Rhizoma medicinal powder |
|
1.淀粉粒(starch grain)2.石细胞(sclereid)3.木栓细胞(cork cell)4.草酸钙方晶(calcium oxalate crystals) 图 3 救必应对照药材粉末显微图 Figure 3 Contrast micrographs of Ilicis Rotundae Cortex medicinal powder |

|
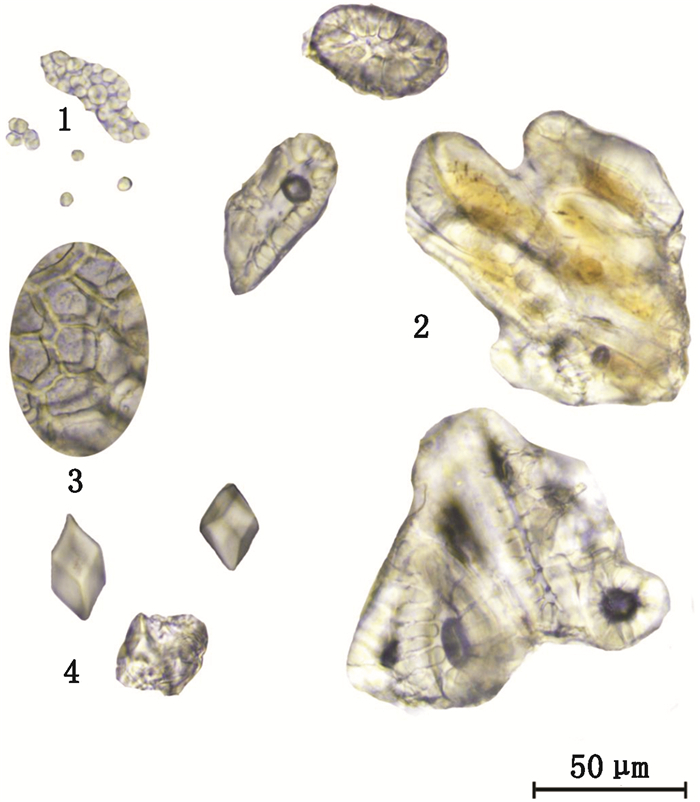
1.油室碎片(The oil chamber pieces)2.导管(a.网纹导管b.具缘纹孔)(duct:a. reticulate vessel b. bordered pit)3.菊糖(synanthrin) 图 4 木香对照药材粉末显微图 Figure 4 Contrast micrographs of Aucklandiae Radix medicinal powder |
|
1.棕色块(Brown piece)2.油细胞(eleocyte)3.石细胞(sclereid)4.淀粉粒(starch grain)5.纤维(fibre) 图 5 肉桂对照药材粉末显微图 Figure 5 Contrast micrographs of Cinnamomi Cortex medicinal powder |

|
1.肉桂纤维(The fibre of Cinnamomi Cortex)2.高良姜淀粉粒(The starch grain of Alpinae Officinarum Rhizoma)3.木香菊糖(The synanthrin of Aucklandiae Radixa)4.陈皮橙皮苷结晶(The hesperidin crystal of Citri Reticulatae Pericarpium)5.救必应草酸钙方晶(The calcium oxalate crystals of Ilicis Rotundae Cortex) 图 6 混合对照药材粉末显微图 Figure 6 Contrast micrographs of mixture medicinal powder |
|
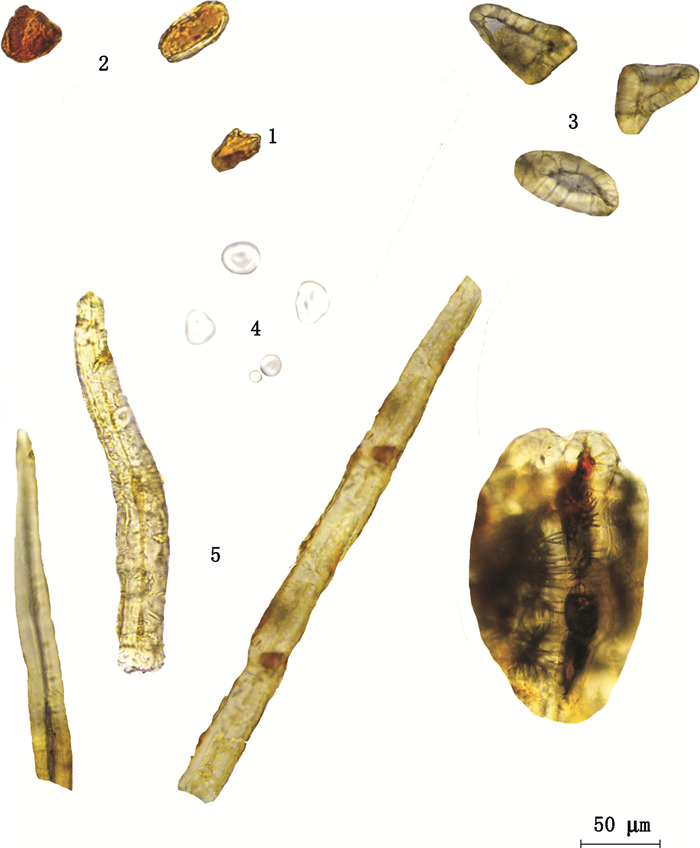
1.气孔(stoma)2.果皮表皮细胞(Pericarp epidermis cell)3.橙皮苷结晶(hesperidin crystal) 图 7 陈皮原药材粉末显微图 Figure 7 The micrographs of original medicinal powder of Citri Reticulatae Pericarpium |
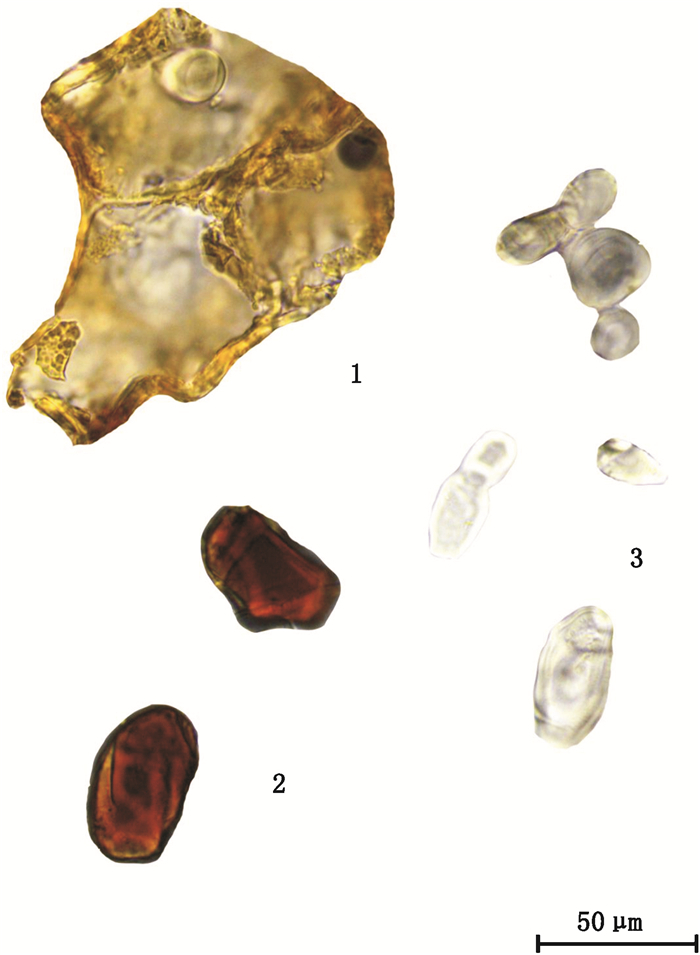
|
1.表皮细胞(epidermis cell)2.分泌细胞(secretory cell)3.淀粉粒(starch grain) 图 8 高良姜原药材粉末显微图 Figure 8 The micrographs of original medicinal powder of Alpinae Officinarum Rhizoma |
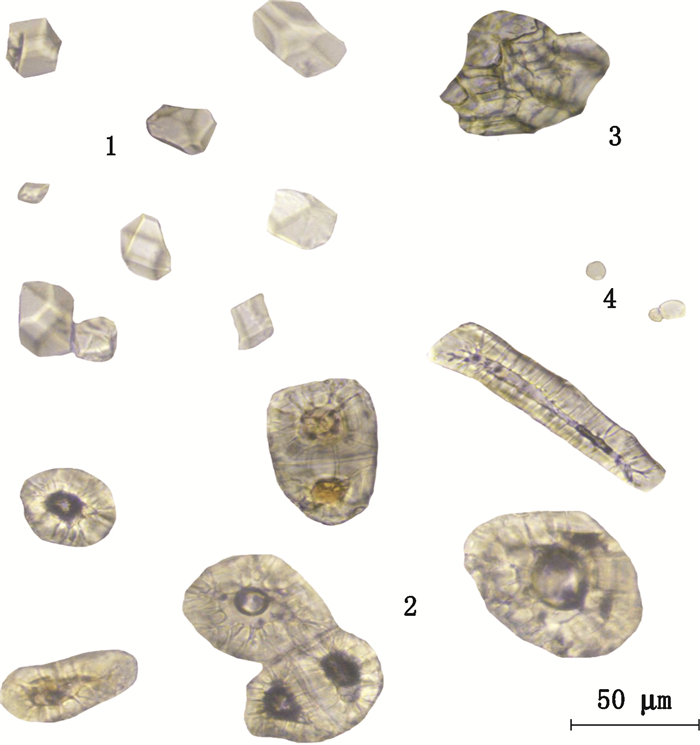
|
1.草酸钙方晶(calcium oxalate crystals)2.石细胞(sclereid)3.木栓细胞(cork cell)4.淀粉粒(starch grain) 图 9 救必应原药材粉末显微图 Figure 9 The micrographs of original medicinal powder of Ilicis Rotundae Cortex |
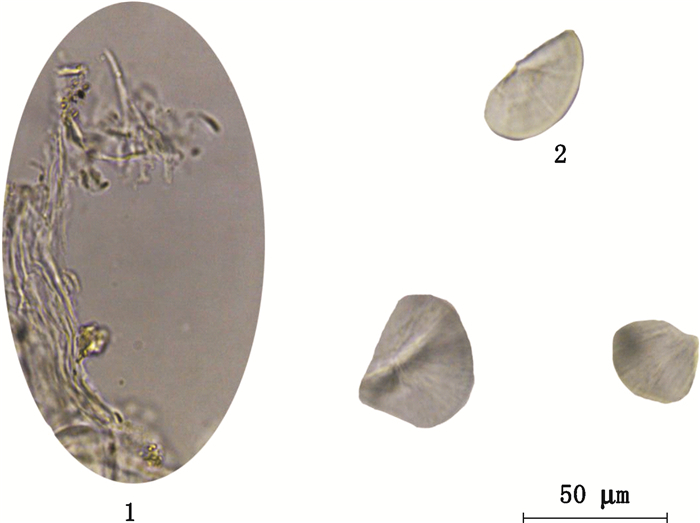
|
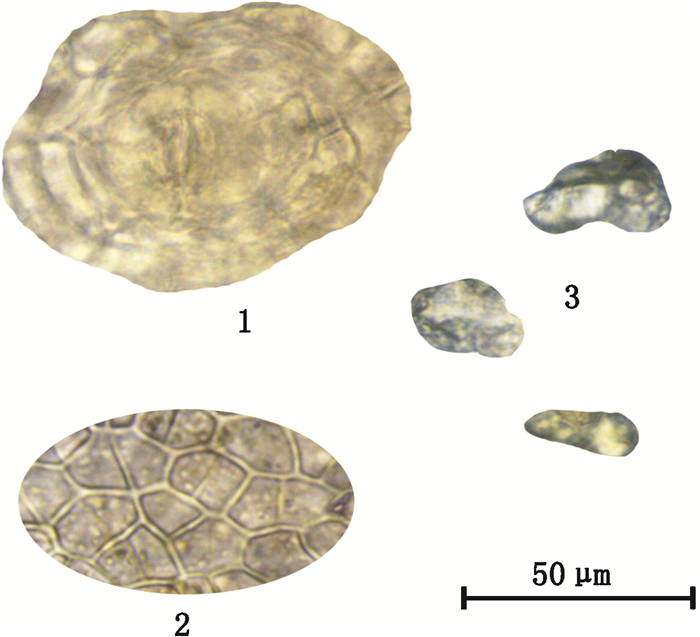
1.油室(oil chamber)2.菊糖(synanthrin) 图 10 木香原药材粉末显微图 Figure 10 The micrographs of original medicinal powder of Aucklandiae Radixa |

|
1.淀粉粒(starch grain)2.石细胞(sclereid)3.油细胞(eleocyte)4.纤维(fibre) 图 11 肉桂原药材粉末显微图 Figure 11 The micrographs of original medicinal powder of Cinnamomi Cortex |

|
1.救必应草酸钙方晶(The calcium oxalate crystals of Ilicis Rotundae Cortex)2.陈皮橙皮苷结晶(The hesperidin crystal of Citri Reticulatae Pericarpium)3.肉桂纤维(The fibre of Cinnamomi Cortex)4.木香菊糖(The synanthrin of Aucklandiae Radixa)5.高良姜淀粉(The starch grain of Alpinae Officinarum Rhizoma) 图 12 混合原药材粉末显微图 Figure 12 The micrographs of mixture original medicinal powder |
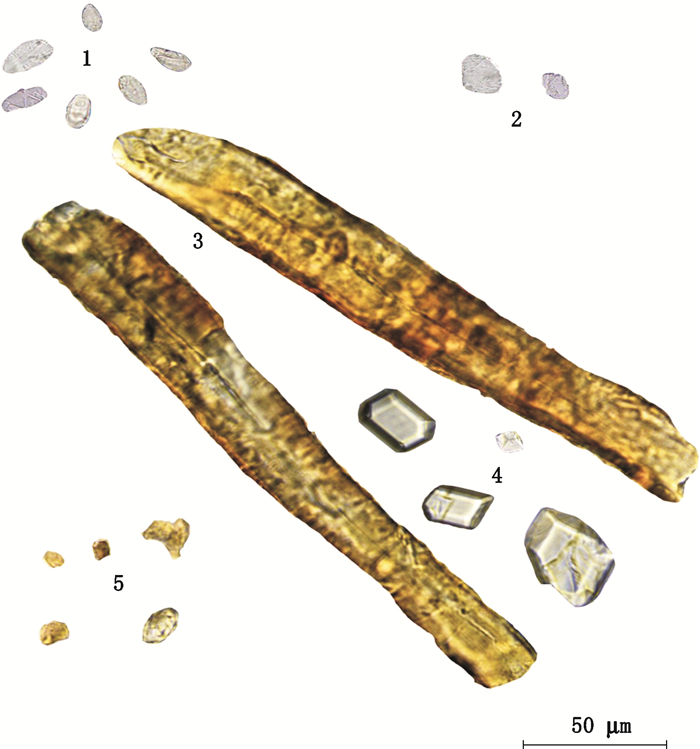
|
1.高良姜淀粉粒(The starch grain of Alpinae Officinarum Rhizoma)2.木香菊糖(The synanthrin of Aucklandiae Radixa)3.肉桂纤维(The fibre of Cinnamomi Cortex)4.救必应草酸钙方晶(The calcium oxalate crystals of Ilicis Rotundae Cortex)5.陈皮橙皮苷结晶(The hesperidin crystal of Citri Reticulatae Pericarpium) 图 13 救必应胃痛片粉末显微图 Figure 13 The micrographs of sample |
救必应胃痛片中以粉末入药的植物药有木香、救必应、高良姜、肉桂和陈皮,根据《中华人民共和国药典》2015年版[2],本文通过对5种药材的原药材粉末、按处方比例混合的原药材粉末和样品粉末进行显微鉴别[3-6],并与各自的对照药材粉末和按处方比例混合的对照药材粉末进行比较,结果发现,原药材木香、救必应、高良姜、肉桂和陈皮,与各自的对照药材具相同的显微特征,且与《中华人民共和国药典》2015年版[2]要求一致;救必应胃痛片样品粉末中——木香的菊糖,肉桂的纤维,救必应的草酸钙方晶,陈皮的陈皮苷结晶,高良姜的淀粉粒,与各自对照药材及按处方比例混合的对照药材粉末具相同的显微特征。
2 薄层色谱鉴别结果 2.1 木香薄层色谱鉴别[2]取救必应胃痛片样品2片,研细,加甲醇10 mL,超声处理(功率250 W,频率50 kHz)30 min,滤过,滤液作为供试品溶液。取木香对照药材0.5 g,同法制成对照药材溶液。取木香烃内酯和去氢木香烃内酯对照品适量,分别加甲醇制成每1 mL含0.5 mg的溶液,作为对照品溶液。照薄层色谱法(《中华人民共和国药典》2015年版四部通则0502),吸取上述溶液各5 μL、供试品溶液10 μL,分别点于同一硅胶G薄层板上,以环己烷-甲酸乙酯-甲酸(15: 5: 1)的上层溶液为展开剂,展开,取出,晾干,喷以1%香草醛硫酸溶液,加热至斑点显示清晰。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上显相同颜色的斑点,如图 14(T:26 ℃;RH:60%;展距:8 cm)。
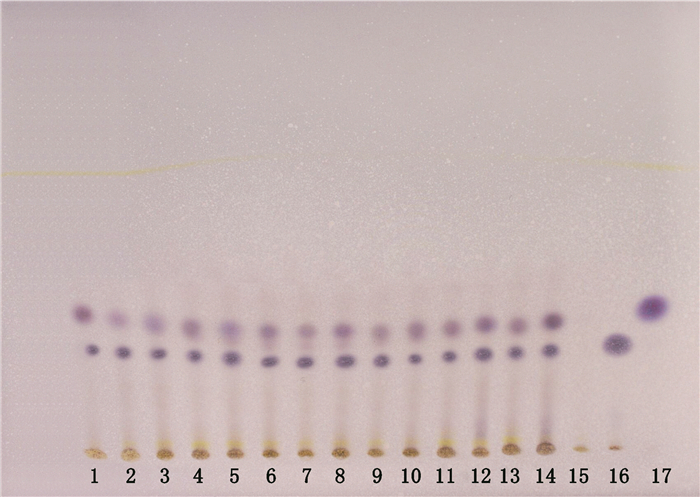
|
1~13.救必应胃痛片供试品(samples 1~13)14.木香对照药材(The contrast medicinal of Aucklandiae Radix)15.缺木香阴性样品(negative sample without Aucklandiae Radix)16.木香烃内酯(Costunolide)17.去氢木香烃内酯(Dehydrocostuslactone) 图 14 木香薄层色谱图 Figure 14 TLC Chromatograms of Aucklandiae Radix |
按“2.1”项下方法制备供试品溶液。取橙皮苷对照品适量,加甲醇制成饱和溶液,作为对照品溶液。照薄层色谱法(中华人民共和国药典2015年版四部通则0502),吸取上述溶液各10μL,分别点于同一硅胶G薄层板上,以醋酸乙酯-甲醇-水(10: 1.7: 1.3)的上层溶液为展开剂,展开,取出,晾干,喷以三氯化铝试液,置紫外光灯(365 nm)下检视。供试品色谱中,在与对照品色谱相应的位置上显相同颜色的荧光斑点,如图 15(T:28 ℃;RH:66%;展距:9 cm)。

|
1~13.救必应胃痛片供试品(samples)14.缺陈皮阴性样品(negative sample without Citri Reticulatae Pericarpium)15.橙皮苷(hesperidin) 图 15 橙皮苷薄层色谱图 Figure 15 TLC Chromatograms of hesperidin |
按“2.1”项下方法制备供试品溶液。取桂皮醛对照品适量,加甲醇制成每1 mL含10 μg的溶液,作为对照品溶液。取肉桂对照药材1.0 g,同法制成对照药材溶液。照薄层色谱法(中华人民共和国药典2015年版四部通则0502),吸取上述对照品溶液和对照药材溶液各5 μL、供试品溶液10 μL,分别点于同一硅胶G薄层板上,照以石油醚(60~90 ℃)-醋酸乙酯(17: 3)为展开剂,展开,取出,晾干,喷以二硝基苯肼乙醇试液。供试品色谱中,在与对照品色谱和对照药材色谱相应的位置上显相同颜色的斑点,如图 16(T:28 ℃;RH:58%;展距:10 cm)。

|
1~13.救必应胃痛片供试品(samples 1~13)14.缺肉桂阴性样品(negative sample without Cinnamomi Cortex)15.肉桂对照药材(The contrast medicinal of Cinnamomi Cortex)16.桂皮醛(cinnamaldehyde) 图 16 桂皮醛薄层色谱图 Figure 16 TLC Chromatograms of cinnamaldehyde |
精密称取对照品木香烃内酯10.32 mg、去氢木香烃内酯10.09 mg,分别置100 mL量瓶中,加甲醇溶解并定容,作为对照储备液A、B;精密称取对照品桂皮醛15.49 mg、橙皮苷15.30 mg,分别置50 mL量瓶中,加甲醇溶解并定容,作为对照储备液C、D;分别精密吸取上述对照储备液A、B和C各1 mL、D 2 mL,置于同一10 mL量瓶中,加甲醇至刻度,摇匀,即得(即质量浓度分别为木香烃内酯10.32 μg·mL-1,去氢木香烃内酯10.09 μg·mL-1,桂皮醛30.79 μg·mL-1,橙皮苷61.20 μg·mL-1)。
3.2 供试品溶液的制备取已研细的救必应胃痛片样品0.5 g,精密称定,置具塞锥形瓶中,精密加入90%甲醇25 mL,称量,超声处理(功率250 W,频率50 kHz)20 min,放冷,再称量,用90%甲醇补足减失的量,摇匀,过0.45 μm微孔滤膜,取续滤液,即得。
3.3 色谱条件与系统适用性试验[8-12]色谱柱:Agilent Eclipse XDB-C18(250 mm×4.6 mm,5 μm);柱温:35 ℃;检测波长:0~25 min:283 nm,25~60 min:225 nm;流速:1.0 mL·min-1;进样量:10 μL。流动相:甲醇(A)-水(B),梯度洗脱:0~20 min:38%A;20~50 min:38%A→75%A;50~60 min:75%A。按上述实验条件进行测定,结果4种指标成分的理论板数均不低于5 000,且都能达到基线分离,分离度大于1.5。
3.4 专属性试验按照救必应胃痛片处方比例,分别制备不含木香、陈皮和肉桂的样品,按“3.2”项下方法制成阴性样品溶液,进样测定。结果显示阴性样品溶液各成分峰对测定无干扰,结果见图 17。
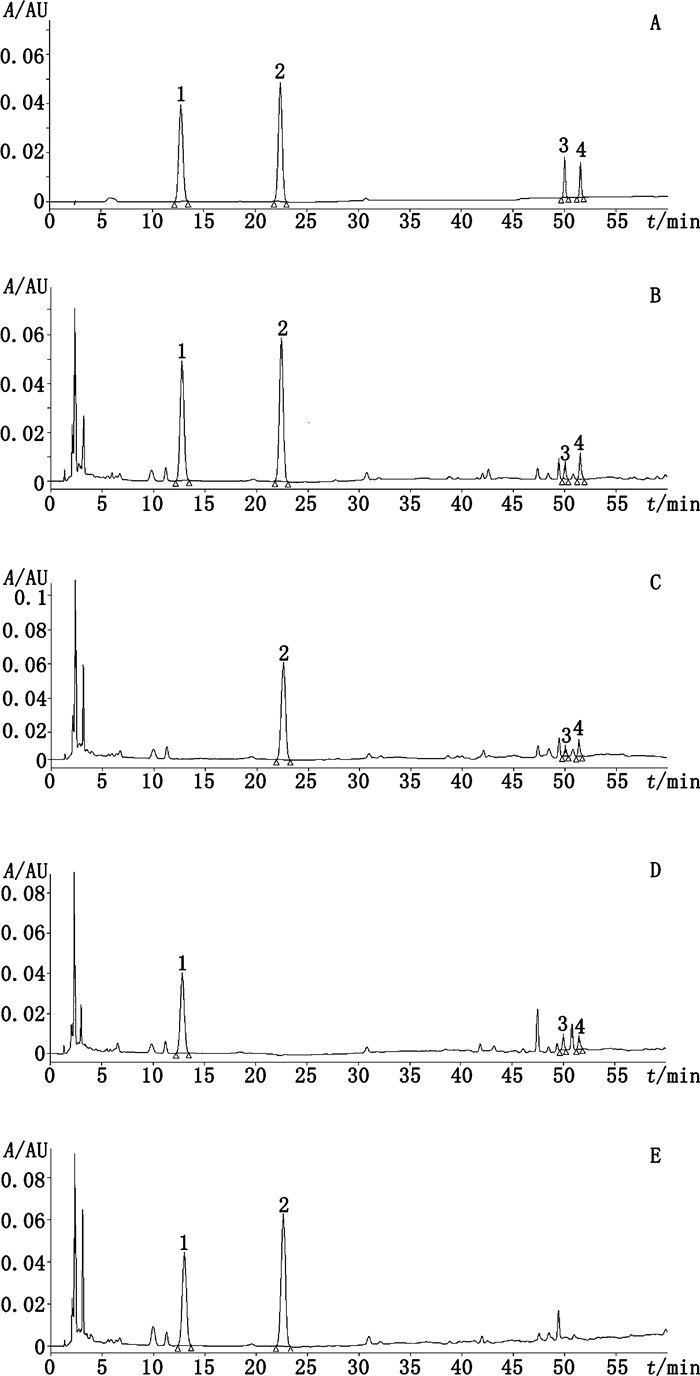
|
1.橙皮苷(hesperidin)2.桂皮醛(cinnamaldehyde)3.木香烃内酯(costunolide)4.去氢木香烃内酯(dehydrocostus lactone) 图 17 混合对照品(A)、救必应胃痛片样品(B)、缺陈皮阴性样品(C)、缺肉桂阴性样品(D)和缺木香阴性样品(E)的HPLC色谱图 Figure 17 HPLC chromatograms of mixed reference substances(A)、sample of Jiubiying Weitong tablets(B)、negative sample without Citri Reticulatae Pericarpium(C)、negative sample without Cinnamomi Cortex(D)and negative sample without Aucklandiae Radix(E) |
精密称取对照品木香烃内酯11.18 mg、去氢木香烃内酯10.72 mg、桂皮醛19.85 mg,分别置50 mL量瓶中,加甲醇溶解并定容,作为对照储备液E、F、G;精密称取橙皮苷对照品11.88 mg,置25 mL量瓶中,加甲醇溶解并定容,作为对照储备液H。精密吸取对照储备液E、F、G各0.1、0.25、0.5、1.0、2.5、5.0 mL和H 0.1、0.5、1.0、2.0、3.75、7.5 mL,分别置6个25 mL量瓶中,加甲醇稀释至刻度(质量浓度约相当于木香烃内酯0.894 4、2.236、4.472、8.944、22.36、44.72 μg·mL-1,去氢木香烃内酯0.857 6、2.144、4.288、8.576、21.77、42.88 μg·mL-1,桂皮醛1.578、3.946、7.892、15.78、39.46、78.92 μg·mL-1,橙皮苷1.901、9.504、19.01、38.02、71.76、142.6 μg·mL-1),摇匀,进样10 μL进行分析,记录峰面积。以对照品浓度C(μg·mL-1)为横坐标,色谱峰峰面积Y为纵坐标,制作标准曲线,求得标准曲线的回归方程、相关系数,结果见表 1。
|
|
表 1 4个有效成分的回归方程、相关系数和线性范围 Table 1 Regression equation, R and Linear rang of four effective components |
精密吸取混合对照品溶液,连续进样6次,每次10 μL,以木香烃内酯、去氢木香烃内酯、橙皮苷、桂皮醛峰面积计,RSD分别为0.4%、0.9%、0.2%和0.2%。表明该方法精密度良好。
3.7 稳定性试验取同一供试品溶液,室温下分别于0、2、4、8、12、24 h进样测定,根据色谱图的峰面积来考察木香烃内酯、去氢木香烃内酯、橙皮苷、桂皮醛的稳定性,结果RSD分别为0.7%、2.0%、1.6%和1.6%。表明供试品溶液在室温下24 h内能保持稳定。
3.8 重复性试验取同一样品各6份,分别按“3.2”项下方法制备供试品溶液,进样10 μL,测定。结果样品中木香烃内酯、去氢木香烃内酯、橙皮苷、桂皮醛平均含量(n=6)分别为0.054 7、0.118 8、0.958 3、0.642 2 mg·片-1,RSD分别为2.6%、2.3%、2.0%、1.4%。表明该方法重复性良好。
3.9 加样回收率试验精密称取同一批(批号140101,0.36 g·片-1)已知木香烃内酯含量为0.151 8 mg·g-1、去氢木香烃内酯含量为0.330 1 mg·g-1、橙皮苷含量为2.661 9 mg·g-1、桂皮醛含量为1.784 0 mg·g-1的样品0.25 g,共6份,再精密称取橙皮苷对照品15.77 mg,置50 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为对照储备液Ⅰ;再精密称取桂皮醛对照品79.40 mg,置20 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,精密量取5 mL至10 mL量瓶中,加甲醇稀释至刻度,摇匀,作为对照储备液J;分别精密吸取对照储备液A(0.103 2 mg·mL-1)0.5 mL和B(0.100 9 mg·mL-1)0.8 mL、I(0.315 4 mg·mL-1)3.45 mL、J(1.973 mg·mL-1)0.25 mL,按“3.2”项下方法操作,制备供试溶液,测定,计算回收率。结果见表 2。
|
|
表 2 4个有效成分加样回收率实验结果(n=3) Table 2 Result of the recovery test in four effective components |
取13批救必应胃痛片样品,分别按“3.2”项下方法制备供试品溶液,进样测定,按外标法计算含量,其含量分别为:木香烃内酯0.011 6~0.200 8 mg·片-1;去氢木香烃内酯0.084 9~0.221 9 mg·片-1;橙皮苷0.711 7~1.232 0 mg·片-1;桂皮醛0.029 5~1.007 5 mg·片-1。
4 讨论与结论 4.1 显微鉴别研究显微鉴别法是中药鉴定方法的主要手段之一,特征细胞能较准确地反映各药材的显微鉴别特征。本文增加了处方中以细粉入药的木香、救必应、高良姜、肉桂和陈皮等药材的显微鉴别法,完善了救必应胃痛片的定性鉴别方法,为控制该制剂定性鉴别和制法工艺质量标准提供依据。
4.2 薄层色谱鉴别法方法改进后,原标准中的橙皮苷、桂皮醛、木香药材等的薄层色谱鉴别,均可以采用同一提取方法“取样品2片,加甲醇10 mL,超声处理(功率250 W,频率50 kHz)30 min”制备供试品溶液,且在其相应的方法项下,增加了肉桂、木香烃内酯和去氢木香烃内酯的鉴别。不但简化了操作步骤,节省了时间,节约了试剂和试样的使用量,且优化了各自的展开系统,避免了氯仿和甲苯等有毒有害试剂的使用,也完善了救必应胃痛片的薄层鉴别法,使该药的内在质量得到更加全面的控制。
4.3 含量测定方法研究 4.3.1 供试品溶液制备方法的选择和优化原标准中【含量测定】项下只有橙皮苷的含量测定,其提取方法是以石油醚为溶剂,索氏提取2~3 h,药渣挥干溶剂后用甲醇提取目标成分。本文采用正交设计方法优化供试品溶液的提取方法,选择溶剂体积、甲醇浓度和提取时间作为考察因素,以去氢木香烃内酯(Y1)、木香烃内酯(Y2)、桂皮醛(Y3)和橙皮苷(Y4)的得率作为考核指标,建立L9(34)正交表考察上述三因素三水平对4个目标成分的影响,得出最优水平组合:使用90%甲醇25 mL超声处理(功率250 W,频率50 kHz)20 min制备供试品溶液。简化了操作,节约了时间,且减少了试剂的用量。
4.3.2 检测波长的选择采用DAD检测器在200~400 nm范围内,分别对橙皮苷、桂皮醛、木香烃内酯和去氢木香烃内酯对照品溶液进行光谱扫描,绘制DAD的3D图谱,找出最大吸收波长;再参考《中华人民共和国药典》[2]中陈皮、桂枝和木香等药材含量测定项下的检测波长,结合实际的实验操作条件,将橙皮苷和桂皮醛的检测波长设为283 nm,木香烃内酯和去氢木香烃内酯的检测波长设为225 nm。
4.3.3 流动相的选择参考《中华人民共和国药典》2015年版[2]中陈皮、桂枝和木香等药材含量测定项下的流动相条件,并与相关文献[8-12]中流动相条件综合分析,进行梯度洗脱(以甲醇为流动相A,水为流动相B),按以下梯度洗脱程序进行试验:① 0~20 min:35%A,20~40 min:65%A;② 0~20 min:38%A,20~40 min:38%→70%A;③ 0~20 min:38%A,20~50 min:38%→75%A,50~60 min:75%A;④ 0~20 min:38%A,20~40 min:38%→75%A。综合分析保留时间、理论板数、基线、杂质影响等各因素,程序③为最理想的流动相条件。原标准中的流动相为甲醇-醋酸-水,改进为甲醇-水后,不但避免了醋酸对色谱柱的损害,还能在此色谱条件下同时检测4个有效成分。简化操作,缩短分离和检测时间,提高了工作效率。
4.3.4 考察不同型号的色谱仪、色谱柱对结果的影响取批号为140101的样品,①:于高效液相色谱仪(Waters 1525)测定,分别使用不同型号的色谱柱Agilent XDB-C18、Agilent SB-Aq C18、Ultimate XB-C18、Hubble C18对其进行分离、检测,分别计算4个目标成分的含量,木香烃内酯、去氢木香烃内酯、橙皮苷和桂皮醛的RSD分别为3.0%、2.9%、2.4%和3.3%。②:于高效液相色谱仪(安捷伦Agilent 1260)测定,使用色谱柱Agilent XDB-C18进行分离、检测,与Waters 1525色谱仪中Agilent XDB-C18分离得出的结果进行比较,木香烃内酯、去氢木香烃内酯、橙皮苷和桂皮醛的RD分别为1.4%、1.6%、3.7%和2.0%。
4.3.5 比较2种不同的方法检测橙皮苷的含量本文按照原标准规定的方法,取批号为140101的样品进行橙皮苷含量测定,结果该方法测得的橙皮苷含量为1.007 2 mg·片-1,与本文所测得的含量(0.958 3 mg·片-1)相接近。
4.4 结论本文在救必应胃痛片现行版质量标准[1]的基础上,增加了药材粉末显微鉴别,改进了薄层色谱鉴别,扩展了含量测定项中的目标成分测定,方法简单易行、高效快速,质量可控,为完善和提升救必应胃痛片的质量标准提供依据,也为甄别伪劣药品和确保人民群众用药安全提供参考。
测定13批次样品中木香烃内酯、去氢木香烃内酯、橙皮苷和桂皮醛含量(按外标法计算),发现各批次间木香烃内酯和去氢木香烃内酯总含量、桂皮醛含量结果差异较大,笔者分析造成该差异的原因可能有以下几点:第一,药材市场是中药制剂中中药材的主要来源地,现在中药材市场的品种较混乱,且质量高低不一,这给中药制剂的质量带来很大的影响;第二,处方的制作工艺和原药材的处理也是影响药品质量的重要因素,木香、陈皮、肉桂入药前需粉碎成细粉,粉末需灭菌(该厂使用烘制灭菌法,115 ℃烘制30 min),打粉机工作所产生的热能和烘制过程中所使用的温度,都有可能导致各药材所含挥发性有效成分损失量大小不一;第三,厂家从购进原药材(饮片)到生产环节,需经过一定时间的储存期,储存环境及时间对药材的含量也有一定的影响。
| [1] |
国家药品标准ZD-0932号[S].2013 National Drug Standards ZD-0932[S].2013 |
| [2] |
中华人民共和国药典2015年版.四部[S].2015: 200 ChP 2015.Vol IV[S].2015: 200 |
| [3] |
宗玉英, 余满堂, 车镇涛, 等. 木香类药材的显微及HPLC鉴别[J]. 中药材, 2008, 31(9): 1318. ZONG YY, YU MT, CHE ZT, et al. The microscopical and HPLC identification of several "Muxiang" raw materials[J]. J Chin Med Mater, 2008, 31(9): 1318. DOI:10.3321/j.issn:1001-4454.2008.09.008 |
| [4] |
顾利红, 毕福钧, 陈蔼. 不同来源救必应药材的质量评价[J]. 中草药, 2013, 44(5): 622. GU LH, BI FJ, CHEN A. Quality evaluation of Ilicis Rotundae Cortex from different sources[J]. Chin Tradit Herb Drugs, 2013, 44(5): 622. |
| [5] |
庞运同, 董元玉. 肉桂及其伪品的鉴别[J]. 中国医院药学杂志, 2004, 24(12): 788. PANG YT, DONG YY. Identification of cinnamomi cortex and its forgery[J]. Chin J Hosp Pharm, 2004, 24(12): 788. DOI:10.3321/j.issn:1001-5213.2004.12.040 |
| [6] |
王青晓, 高晓洁, 桂新景, 等. 香砂养胃丸(大蜜丸)质量标准改进研究[J]. 中医学报, 2016, 31(6): 845. WANG QX, GAO XJ, GUI XJ, et al. Improvement on the quality control standard of Xiangsha Yangwei pills(honey pills)[J]. Acta Chin Med, 2016, 31(6): 845. |
| [7] |
吴垠, 赖宇红. 香砂养胃片中橙皮苷薄层鉴别方法的修订[J]. 中药材, 2007, 30(2): 153. WU Y, LAI YH. Revision of the TLC identification method of hesperidin in Xiangsha Yangwei tablets[J]. J Chin Med Mater, 2007, 30(2): 153. DOI:10.3321/j.issn:1001-4454.2007.02.013 |
| [8] |
蒋秋香, 黄昊, 蓝凤良. HPLC法测定香砂养胃片中4种有效成分的含量[J]. 药物分析杂志, 2015, 35(9): 1669. JIANG QX, HUANG H, LAN FL. Simultaneous determination of four effective components in the Xiangsha Yangwei tablets by HPLC[J]. Chin J Pharm Anal, 2015, 35(9): 1669. |
| [9] |
胡志军, 陈建秋. HPLC测定不同基原陈皮药材中陈皮苷含量[J]. 中国实验方剂学杂志, 2012, 18(10): 95. HU ZJ, CHEN JQ. Content determination of hesperidin from different kinds of Pericarpium Citri Reticulatae by HPLC[J]. Chin J Exp Tradit Med Form, 2012, 18(10): 95. DOI:10.3969/j.issn.1005-9903.2012.10.027 |
| [10] |
刘宏明, 张叶, 聂磊. HPLC法同时测定小儿柴桂退热颗粒中葛根素、大豆苷、黄芩苷、大豆苷元、桂皮醛、黄芩素的含量[J]. 药物分析杂志, 2014, 34(6): 1038. LIU HM, ZHANG Y, NIE L. Simulaneous determination of puerarin, daidzin, baicalin, daidzein, cinnamaldehyde and baicalein in Xiaoer Chaigui Tuire Keli by HPLC[J]. Chin J Pharm Anal, 2014, 34(6): 1038. |
| [11] |
裴贵珍, 郭鑫, 张雪峰, 等. HPLC法同时测定六味能消胶囊中木香烃内酯、去氢木香烃内酯大黄素、大黄酚的含量[J]. 药物分析杂志, 2015, 35(2): 241. PEI GZ, GUO X, ZHANG XF, et al. Simultaneous determination of costunolide, dehydrocostus lactone, emodin and chrysophanol in Liuweinengxiao capsules by HPLC[J]. Chin J Pharm Anal, 2015, 35(2): 241. |
| [12] |
崔璐, 孙小玲, 郝延军, 等. HPLC法同时测定前列癃闭通片中6个有效成分的含量[J]. 药物分析杂志, 2015, 35(11): 1914. CUI L, SUN XL, HAO YJ, et al. Determination of six active ingredients in Qianlielong Bitong tablets by HPLC[J]. Chin J Pharm Anal, 2015, 35(11): 1914. |
 2018, Vol. 38
2018, Vol. 38 