硫酸卡那霉素为链霉菌发酵制取的氨基糖苷类抗生素,主要成分为卡那霉素A,仅含有少量的卡那霉素B和卡那霉素C[1],通过与细菌核糖体30S亚单位结合,抑制细菌蛋白质合成。硫酸卡那霉素抗菌谱广,与新霉素相似,适用于革兰氏阴性菌如大肠埃希菌,克雷伯菌属及志贺菌属引起感染的治疗,对耐药性金葡菌也有良好的抗菌作用[2]。氨基糖苷类抗生素为末端紫外吸收的品种,难以选用紫外检测器检测[3-4],该品种及注射液收载于《中华人民共和国药典》2015年版二部[5],含量测定和卡那霉素B采用高温型蒸发光检测器的液相色谱法进行测定,无有关物质检测方法。各国药典收载的单硫酸卡那霉素和硫酸卡那霉素均无有关物质检查。
本研究建立硫酸卡那霉素及注射液有关物质高温型和低温型蒸发光检测器方法并进行了比对,研究表明低温型蒸发光检测器在杂质检出量和分离效果上均优于高温型检测器,为后续杂质谱的进一步研究奠定了基础。
1 仪器与试药仪器:Waters Acquity H Class高效液相色谱仪(包括Waters Quaternary Solvent Manager,Waters Acquity sample manager-FTN,ELS Detector(低温型蒸发光检测器)和Empower3色谱数据工作站,Waters公司);岛津LC-20AT高效液相色谱仪(包括LC-20AT pump,SIL-20AC自动进样器,Alltect ELSD 2000ES检测器(高温型蒸发光检测器),LC solution色谱工作站,岛津公司);三氟醋酸(Merck)、甲醇(色谱纯)。
对照品:卡那霉素(含量66.5%,批号130556-200501)、卡那霉素B(批号130548-200501),中国食品药品检定研究院。
样品:硫酸卡那霉素(批号20120112-1、20120203-1,本溪海大制药有限公司;批号D1405020、D1405022,田福兴医药有限公司)、硫酸卡那霉素注射液(规格:2 mL:0.5 g)(批号1306171、1306172、1303102,广州南国药业有限公司提供;批号13091301、13091302、13091303,瑞阳制药有限公司提供)。
2 高温型蒸发光检测器方法的建立 2.1 流动相筛选参照相关文献报道[6-14]及《中华人民共和国药典》2015年版二部硫酸卡那霉素含量测定及卡那霉素B测定方法。
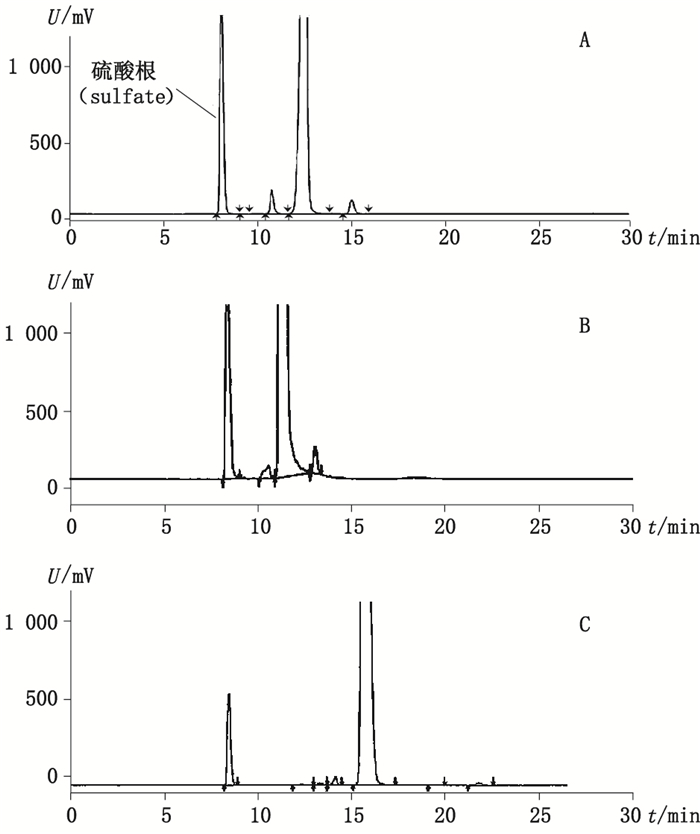
称取硫酸卡那霉素样品(批号20120112-1)适量,加水溶解并制成每1 mL中各约含2 mg的溶液,取20 μL分别在流动相比例为0.2 mol·L-1三氟醋酸-甲醇(95:5)、0.2 mol·L-1三氟醋酸-甲醇(98:2)、0.2 mol·L-1三氟醋酸(100%)的条件下分析,分离情况见图 1。
|
A.0.2 mol·L-1 TFA-MeOH(95:5)B. 0.2 mol·L-1 TFA-MeOH(98:2)C.(0.2 mol·L-1 TFA(100%) 图 1 不同流动相比例下卡那霉素有关物质分离色谱图 Figure 1 The chromatograms of kanamycin related substances under different ratio of mobile phase |
由图 1可见,色谱条件为0.2 mol·L-1三氟醋酸的分离度优于《中华人民共和国药典》2015年版条件,可将原方法中无法分开的杂质实现分离,能更准确地进行杂质测定。因此,高温型蒸发光检测器采用0.2 mol·L-1三氟醋酸为流动相条件进行方法学考察。
2.2 色谱条件色谱柱:Waters XSelect® HSS T3色谱柱(5 μm,4.6 mm×250 mm);流动相:0.2 mol·L-1三氟醋酸溶液;流速0.3 mL·min-1;柱温:30 ℃;蒸发光散射检测器:漂移管温度110 ℃,载气流量2.5 L·min-1;进样量:20 μL。
2.3 专属性试验 2.3.1 卡那霉素B与卡那霉素的分离分别称取对照品卡那霉素与卡那霉素B适量,加水溶解并制成每1 mL中各约含80 μg的混合溶液,取20 μL进样分析,分离情况见图 2。

|
图 2 卡那霉素与卡那霉素B分离图谱 Figure 2 The chromatogram of kanamycin and kanamycin B |
取硫酸卡那霉素样品(批号20120112-1),分别用光照射(4 500 lx放置21 d)、高温(100 ℃15 h)、加强碱(10 mol·L-1氢氧化钠溶液7 h)、加强酸(10 mol·L-1盐酸溶液7 h)和加强氧化剂(30%过氧化氢溶液50 h)等条件分别进行加速破坏;同时另取1份样品,不作任何破坏进行对比试验,色谱图见图 3。经加速破坏研究,表明本品对光照、高温,热较稳定,对酸、碱破坏较不稳定。加速破坏过程产生的降解物质峰不产生干扰,能达到完全的分离,说明本法可用于硫酸卡那霉素有关物质的检测。

|
图 3 样品未破坏及5种方式破坏的色谱图 Figure 3 Chromatograms of original samples solution and sample solution destroyed by five ways |
称取卡那霉素对照品适量,加水溶解并逐级稀释得系列稀释溶液,按信噪比为3:1测定检测下限为0.031 μg(S/N=3.35),按信噪比10:1测定定量下限为0.062 μg(S/N=11.52)。
2.5 线性范围精密称取卡那霉素对照品适量,加水制成3、6、12、30、60、120 μg·m-1的系列溶液,摇匀,取上述溶液,分别准确进样20 μL,记录峰面积。以浓度的对数对峰面积的对数进行线性回归,得下列线性方程:Y=1.515X+8.262 r=0.999 6
结果表明,在0.003~0.12 mg·mL-1的浓度范围内,线性关系良好。
2.6 耐用性精密称取对照品卡那霉素(批号130556-200501)12.43 mg和卡那霉素B对照品(批号130548-200501)8.31 mg,置于100 mL量瓶中,加水溶解并稀释至刻度,摇匀。照上述测定方法,在改变流速、柱温和流动相的比例等条件下,分别取20 μL注入液相色谱仪检测。考察系统适用性变化情况。结果见表 1。结果表明流速、柱温和流动相的比例等微弱变化不干扰分离度和保留时间。
|
|
表 1 耐用性验证结果 Table 1 Validation results of robustness |
采用5根不同的色谱柱对耐用性进行了考察,结果见表 2。结果表明,不同色谱柱对出峰时间和分离度均有一定的影响。
|
|
表 2 耐用性验证结果 Table 2 Validation results of robustness |
取硫酸卡那霉素适量,以水溶解并配制成2.0 mg·mL-1的溶液作为供试品溶液;取硫酸卡那霉素注射液适量,加水稀释制成2.0 mg·mL-1的溶液作为供试品溶液。对照溶液及供试品溶液典型色谱图见图 4。

|
图 4 有关物质对照溶液及供试品溶液典型色谱图 Figure 4 Chromatograms of reference solution and sample solutions |
色谱柱:Agilent ZORBAX SB-C18色谱柱(5 μm,4.6 mm×250 mm);流动相:0.2 mol·L-1三氟醋酸溶液-甲醇(98:2);低温型蒸发光散射检测器,漂移管温度65 ℃,喷雾器比率40%,压力0.207 MPa;流速:0.3 mL·min-1;柱温:30 ℃;进样量:20 μL。
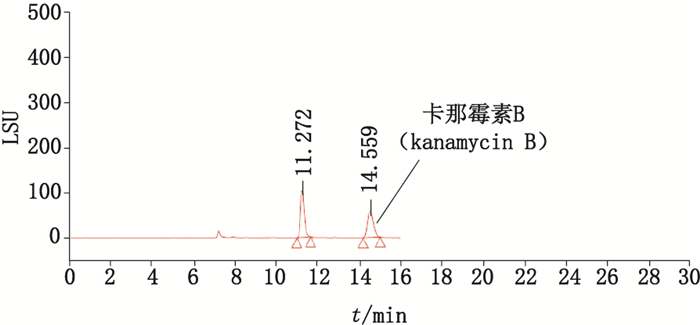
3.2 专属性试验 3.2.1 卡那霉素B与卡那霉素的分离情况考察分别称取对照品卡那霉素与卡那霉素B适量,加水溶解并制成每1 mL中各约含80 μg的混合溶液,取20 μL进样分析,分离情况见图 5。
|
图 5 卡那霉素与卡那霉素B分离图谱 Figure 5 Chromatogram of peaks of kanamycin and kanamycin B |
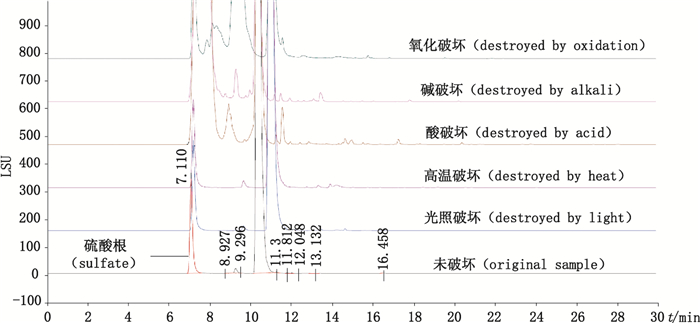
取硫酸卡那霉素样品(批号20120112-1),分别用光照射(4 500 lx放置21 d)、高温(100 ℃15 h)、加强碱(10 mol·L-1氢氧化钠溶液7 h)、加强酸(10 mol·L-1溶液7 h)和加强氧化剂(30%过氧化氢溶液50 h)等条件分别进行加速破坏;同时另取1份样品,不作任何破坏进行对比试验,检测所得色谱图见图 6。结果表明本品对光照、高温,热较稳定;对酸、碱破坏较不稳定。加速破坏过程产生的降解物质峰不产生干扰,能达到完全的分离,说明本法可用于硫酸卡那霉素有关物质的检测。
|
图 6 样品未破坏及5种方式破坏的色谱图 Figure 6 Chromatograms of original samples solution and sample solution destroyed by five ways |
称取卡那霉素对照品适量,加水溶解并逐级稀释得系列稀释溶液,按信噪比为3:1测定检测下限为0.022 μg(S/N=3.76),按信噪比10:1测定定量下限为0.051 μg(S/N=11.98)。
3.4 漂移管温度,喷雾器比率以及压力参数察对漂移管温度进行了55、60、65、70、75、80、85、90 ℃条件的考察,通过分离效果比对,确定最佳温度为65 ℃。对喷雾器比率进行了10%、20%、30%、40%、50%、60%、70%、80%、90%,冷却条件进行了考察,通过分离效果比对,确定最佳比率为40%。对喷雾器气体压力进行了0.172、0.207、0.241、0.407和0.310 MPa条件进行了考察,通过分离效果比对,确定了最佳压力为0.207 MPa。
3.5 线性范围精密称取卡那霉素对照品适量,加水制成3、6、12、30、60、120 μg·mL-1系列溶液,摇匀,取上述溶液,分别准确进样20 μL,记录峰面积。以浓度的对数对峰面积的对数进行线性回归,得下列线性方程:Y=1.621X+7.453 r=0.999 1
结果表明,在0.003~0.12 mg·mL-1度范围内,线性关系良好。
3.6 耐用性精密称取对照品卡那霉素(批号130556-200501)12.41 mg和卡那霉素B 8.69 mg,置100 mL量瓶中,加水溶解并稀释至刻度,摇匀。在改变流速、柱温和流动相的比例等条件下,分别取20 μL注入液相色谱仪检测。考察系统适用性变化情况。结果见表 3。结果表明流速、柱温和流动相的比例等微弱变化对检测不形成干扰。
|
|
表 3 耐用性验证结果 Table 3 Validation results of robustness |
采用7根不同的色谱柱对耐用性进行了考察,结果见表 4。结果表明,不同色谱柱对出峰时间和分离度均有一定的影响。
|
|
表 4 耐用性验证结果 Table 4 Validation results of robustness |
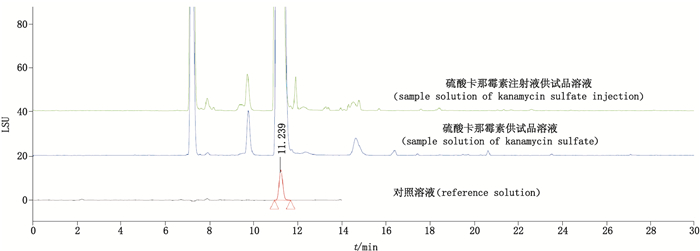
取硫酸卡那霉素适量,以水溶解并配制成2.0 mg·mL-1作为供试品溶液;取硫酸卡那霉素注射液适量,加水稀释制成2.0 mg·mL-1的溶液作为供试品溶液,供试品溶液典型色谱图见图 7。
|
图 7 有关物质对照溶液及供试品溶液色谱图 Figure 7 Chromatograms of reference solution and sample solutions |
USP 39[15]、EP 8.0[16]、BP 2016[17]和JP 16[18]收载的硫酸卡那霉素和单硫酸卡那霉素均采用薄层色谱法进行卡那霉素B的检查,EP 8.0和BP 2016限度规定为不得过4.0%;USP 39和JP 16限度均规定为不得过3%。《中华人民共和国药典》2015年版收载的硫酸卡那霉素中卡那霉素B的限度为不得过2.0%,收载的硫酸卡那霉素注射液中卡那霉素B的限度为不得过4.0%。根据蒸发光检测器的线性特点,确定采用卡那霉素对照品的线性溶液,以峰面积对数值与浓度对数值得到的线性方程进行杂质的计算。
5 结果及讨论建立的2种方法均采用Waters XSelect® HSS T3(5 μm,4.6 mm×250 mm)色谱柱对4批原料药和6批注射液进行了有关物质检测,结果比对见表 5和表 6。
|
|
表 5 硫酸卡那霉素有关物质2种方法检测结果比对表 Table 5 The result comparison of related substance of kanamycin sulfate by two methods |
|
|
表 6 硫酸卡那霉素注射液有关物质2种方法检测结果比对表 Table 6 The result comparison of related substance of kanamycin sulfate injection by two methods |
由此可见,高温型和低温型检测结果中的卡那霉素B的含量差异不大,其他单个杂质和杂质总量低温型检测器检测结果均高于高温型检测器,其中低温型检测器的最大杂质为相对保留时间约为0.85的未知杂质,高温型检测器的最大杂质也为主峰前杂质,但与其他杂质峰未达到基线分离。对杂质的分离能力低温型检测器更有优势。
通过2种检测器方法的建立,全面考察了硫酸卡那霉素及其注射液的杂质谱情况,经过结果比对和分离效果评价,低温型检测器在控制有关物质质量方面较高温型检测更具有优势,为选择合适的方法,制定合理限度进行该品种的有关物质控制以及进一步进行杂质解析,分析杂质来源奠定了研究基础。
| [1] |
于治国, 王桂花, 魏红. 高效液相色谱法测定血清及尿中卡那霉素含量[J]. 沈阳药学院学报, 1989, 6(2): 109. YU ZG, WANG GH, WEI H. High-performace liquid chromatographic assay of kanamycin in serum and urine[J]. J Shenyang Coll Pharm, 1989, 6(2): 109. |
| [2] |
鞠建刚, 杜迎彬. 注射用硫酸卡那霉素有关物质分析方法研究[J]. 山东化工, 2015, 44(17): 82. JU JG, DU YB. Research of analytical method of related substances in kanamycin sulfate for injection[J]. Shandong Chem Ind, 2015, 44(17): 82. DOI:10.3969/j.issn.1008-021X.2015.17.026 |
| [3] |
李玉林, 陈真文, 周玲, 等. 硫酸卡那霉素注射液中有关物质测定方法研究[J]. 中国药业, 2011, 20(10): 41. LI YL, CHEN ZW, ZHOU L, et al. Determination of related substances in kanamycin sulfate injection by HPLC-ELSD[J]. China Pharm, 2011, 20(10): 41. DOI:10.3969/j.issn.1006-4931.2011.10.025 |
| [4] |
王建. 硫酸卡那霉素及其注射液的HPLC衍生化测定[J]. 中国医药工业杂志, 1995, 26(3): 120. WANG J. HPLC derivatization determination of kanamycin and its injection[J]. Chin J Pharm, 1995, 26(3): 120. |
| [5] |
中华人民共和国药典2015年版. 二部[S]. 2015: 1316 ChP 2015. Vol Ⅱ[S]. 2015: 1316 |
| [6] |
侯曦凡, 夏焕章. HPLC-ELSD法分析中间体中妥布霉素含量及其主要杂质卡那霉素B[J]. 药物分析杂志, 2009, 29(7): 1138. HOU XF, XIA HZ. HPLC-ELSD determination of intermediate tobramycin and its main impurities kanamycin B[J]. Chin J Pharm Anal, 2009, 29(7): 1138. |
| [7] |
李予雯, 钟洪兰, 刘思佳, 等. 高效液相色谱法-串联质谱法检测3种氨基糖苷类抗结核药[J]. 现代医院, 2016, 16(6): 851. LI YW, ZHONG HL, LIU SJ, et al. Determination of three aminoglycoside anti-tuberculosis durgs using high performance liquid chromatography-tandem mass spectrometry[J]. Mod Hosp J, 2016, 16(6): 851. DOI:10.3969/j.issn.1671-332X.2016.06.024 |
| [8] |
王金凤, 杨化新, 朱俐, 等. HPLC-NQAD和HPLC-ELSD法测定硫酸卡那霉素注射剂的含量[J]. 药物分析杂志, 2014, 34(4): 644. WANG JF, YANG HX, ZHU L, et al. Determination of kanamycin sulfate injection by HPLC-NQAD and HPLC-ELSD[J]. Chin J Pharm Anal, 2014, 34(4): 644. |
| [9] |
蔡春燕, 杨芳, 闫爱国, 等. UPLC-MS/MS法同时检测饲料中5种氨基糖苷类抗生素[J]. 广东化工, 2014, 41(10): 144. CAI CY, YANG F, YAN AG, et al. Determination of five aminogly coside antibiotics in fodder by UPLC-MS/MS[J]. Guangdong Chem, 2014, 41(10): 144. DOI:10.3969/j.issn.1007-1865.2014.10.071 |
| [10] |
薛晶, 崔学文, 胡昌勤. HPLC法测定人用皮卡狂犬病疫苗和皮卡佐剂中硫酸卡那霉素的含量[J]. 药物分析杂志, 2011, 31(10): 1911. XUE J, CUI XW, HU CQ. HPLC determination of kanamycin sulfate in PIKA rabies vaccine for human use and PIKA adjuvant[J]. Chin J Pharm Anal, 2011, 31(10): 1911. |
| [11] |
张明媛, 常靓, 刘长海, 等. 柱前衍生化高效液相色谱法检测硫酸阿米卡星注射液中卡那霉素含量的改进[J]. 药学实践杂志, 2013, 31(5): 343. ZHANG MY, CHANG L, LIU CH, et al. An improvement method of pre-column derivatization LC-UV for assaying kanamycin in amikacin sulfate injection[J]. J Pharml Pract, 2013, 31(5): 343. DOI:10.3969/j.issn.1006-0111.2013.05.006 |
| [12] |
姜皓然, 李祥鹏, 玄光善. 柱前衍生化HPLC检测硫酸卡那霉素的方法研究[J]. 海峡药学, 2009, 21(7): 85. JIANG HR, LI XP, XUAN GS. Studies of kanamycin sulfate determination method by HPLC with pre-column derivatization[J]. Strait Pharm J, 2009, 21(7): 85. DOI:10.3969/j.issn.1006-3765.2009.07.032 |
| [13] |
张凤妹, 王建. HPLC-电喷雾检测器测定硫酸阿米卡星中卡那霉素和硫酸盐的含量[J]. 中国抗生素杂志, 2015, 40(5): 354. ZHANG FM, WANG J. The determination of HPLC method for the kanamycin and sulfate in amikacin sulfate using charged aerosol detector[J]. Chin J Antibiot, 2015, 40(5): 354. DOI:10.3969/j.issn.1001-8689.2015.05.008 |
| [14] |
习玲玲, 朱岩. 液相色谱-脉冲安培电化学法测定硫酸卡那霉素中各组分含量[J]. 分析化学, 2007, 35(5): 703. XI LL, ZHU Y. Determination of kanamycin sulfate by liquid chromatography with pulsed amperametric detection[J]. Chin J Anal Chem, 2007, 35(5): 703. DOI:10.3321/j.issn:0253-3820.2007.05.019 |
| [15] |
USP 39-NF 34[S]. 2016: 4456
|
| [16] |
EP. 8. 0[S]. 2014: 2563
|
| [17] |
BP 2016Ⅱ[S]. 2016: 43
|
| [18] |
JP 16[S]. 2011: 1002
|
 2018, Vol. 38
2018, Vol. 38 