猴在生物医药领域发挥着重要作用,在传染病学、生殖生理学、神经生物学、老年病、遗传性疾病、营养代谢疾病、内分泌疾病、药理和毒理学、肿瘤学、环境保护等方面的研究中,应用其作为实验材料具有特别重要的意义,其价值是其他动物无法比拟的。猴群体饲养,容易感染真菌引发疾病,会影响到实验动物生产和动物实验结果,特别是人兽共患真菌病,还会对饲养人员和实验人员造成健康危害。因此,全面了解猴真菌种类和致病性真菌的分布,做好真菌监测分析工作具有重要意义。分离培养与鉴定是研究猴真菌的基础,随着科技的进步和研究方法的不断改进,以分子生物学为基础的多种技术在各领域中得到大量应用,通过形态学与分子手段相配合的方式成为对真菌的分类地位加以确定的重要方法。本研究联合应用真菌培养、TaqMan-小沟结合物探针实时荧光定量聚合酶链反应(TaqMan-minor groove binder probe based real-time fluorescence quantitative PCR,TaqMan-MGB探针RTFQ-PCR)、普通PCR、基因克隆和测序技术,进行猴真菌种类、数量及分布情况调查,为致病性真菌感染、真菌毒素引起的疾病的防治提供有益的参考资料。
1 材料与方法 1.1 主要试药真菌培养基和鉴定试剂购自英国OXOID公司。Neo-Sensitab抗真菌药敏片购自丹麦ROSCO公司:制霉菌素(50 μg)、两性霉素B(10 μg)、氟康唑(25 μg)、益康唑(10 μg)、沃尔康唑(1 μg)、咪康唑(10 μg)、酮康唑(15 μg)、克霉唑(10 μg)、氟胞嘧啶(10 μg)、特比萘芬(30 μg)。DNA提取和PCR扩增回收试剂盒等分子生物学试剂购自日本TaKaRa公司。白色念珠菌(Candida albicans)标准菌株ATCC 10231和白色念珠菌TaqMan-MGB探针RTFQ-PCR检测试剂由本实验室提供。
1.2 样本来源122只猴来自全国几个不同的厂家,其中58只恒河猴,编号0411F1~0411F28、0509F1~0509F10、1010F1~1010F10、1011F1~ 1011F10;64只食蟹猴(Macaca fascicularis),编号0808F1~0808F16、0830F1~0830F8、0918F1~0918F40),活体采集毛发皮屑和直肠拭子[1]。
1.3 真菌分离鉴定和DNA提取在负压生物安全柜内,将采集的样本作特定处理后分别接种沙堡氏葡萄糖琼脂斜面、改良马丁琼脂斜面、皮肤病原真菌鉴别琼脂平板,置28 ℃、35 ℃培养3~14 d。将分离获得的真菌菌株,划线接种改良马丁琼脂平板、皮肤病原真菌鉴别琼脂平板,置28 ℃、35 ℃培养3~14 d。挑取单菌落,接种改良马丁琼脂斜面、改良马丁琼脂平板、皮肤病原真菌鉴别琼脂平板、改良马丁液体培养基,置28 ℃、35 ℃培养3~14 d。通过观察真菌分离株的生长速度、菌落直径、质地、颜色、形态、气味、菌落反面和可溶性色素、培养基中渗出物的有无等进行大体分类。对每一类典型的菌落进行镜检,观察菌丝和分生孢子形态特征、孢子着生部位及排列方式等,实时动态显微视屏摄录存档。参照各种真菌形态描述及检索表,进行真菌菌种的初步鉴定和分类[2-4]。使用DNA试剂盒提取真菌DNA。对形态学特征不能鉴定到种的真菌结合分子生物学方法鉴定和分类。
1.4 真菌普通PCR检测、基因克隆和序列测定参考文献[5-8],采用真菌核糖体DNA(nuclear ribosomal DNA,rDNA)标记进行真菌分类鉴定,针对真菌核糖体RNA基因(ribosomal RNA gene,rRNA)小亚基(small subunit,SSU,18S)、内转录间隔区(internal transcribed spacer,ITS,ITS1+5.8S+ITS2)、大亚基(large subunit,LSU,25~28S)区域设计普通PCR检测引物(表 1)。
|
|
表 1 真菌普通PCR引物序列 Table 1 Sequences of conventional PCR primers for fungi |
以抽提的真菌DNA为模板进行普通PCR检测。PCR总反应体系为50 μL,包括10×Buffer(Mg2+Plus)5.0 μL、dNTP Mixture 4.0 μL、正反向引物各0.5 μL、EX Taq 0.25 μL、模板DNA 3 μL、nuclease-free water 36.75 μL。循环参数:94℃ 5 min 1个循环;94℃ 30 s,55℃ 30 s,72℃ 1 min,30个循环;72℃ 5 min 1个循环。取真菌PCR扩增产物5 μL进行琼脂糖凝胶电泳。回收纯化目的条带,进行基因克隆测序鉴定。将所获得的猴真菌基因测序数据,在线提交美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI),通过BLAST(Basic Alignment Search Tool)(http://www.ncbi.nlm.nih.gov/blast/)进行比对分析,确定真菌种属。
1.5 TaqMan-MGB探针RTFQ-PCR检测白色念珠菌参考文献[9],针对白色念珠菌核糖体rRNA基因ITS、26S区域设计TaqMan-MGB探针RTFQ-PCR检测用引物和探针(表 2)。以提取的真菌DNA为模板进行TaqMan-MGB探针RTFQ-PCR检测。总反应体系20 μL,包括正、反向引物(各900 nmol·L-1)和探针(250 nmol·L-1)共1 μL、TaqMan mix 10 μL、模板DNA 1 μL、nuclease-free water 8 μL。循环参数:95 ℃ 20 s;95 ℃ 3 s,60 ℃ 30 s,共40个循环。
|
|
表 2 白色念珠菌TaqMan-MGB探针和RTFQ-PCR引物序列 Table 2 Sequences of TaqMan-MGB probe and RTFQ-PCR primers for Candida albicans |
根据美国临床实验室标准化委员会(National Committee for Clinical Laboratory Standard)的规定,采用纸片扩散法(K-B法)进行药敏试验,白色念珠菌ATCC 64548作为试验质控株[10-11]。将待测真菌在沙堡氏培养基上转种,以保证其纯度和活性。在负压生物安全柜内,配制0.5麦氏单位真菌悬液,用生理盐水作1:1稀释,使接种液浓度为5×105 CFU·mL-1。用移液管吸取0.5 mL接种液,倾注于改良SHADOMY琼脂平板表面,涂布均匀。用无菌眼科镊将含有定量抗真菌药物的药片贴在已接种待检真菌的琼脂平板表面,并用镊尖轻压一下药片,使其贴平。每个药片的间距不小于24 mm,药片的中心距平板的边缘不小于15 mm,90 mm直径的平板适宜贴6个药片。将贴好药片的平板置35 ℃培养18~24 h后,用游标卡尺量取抑菌圈直径。药片中所含的药物吸取琼脂中的水分溶解后会不断地向药片周围区域扩散,形成递减的浓度梯度,在药片周围抑菌浓度范围内待检真菌的生长被抑制,从而产生透明的抑菌圈。抑菌圈的大小反映检测真菌对测定药物的敏感程度。根据抑菌圈的大小(不同抗真菌药物其抑菌圈大小的标准不一致),判断为敏感(susceptible,S)、中介(intermediate,I)、耐药(resistant,R)。试验用抗真菌药物结果判定标准如下:制霉菌素(50 μg)(抑菌圈直径≥15 mm,判为敏感;抑菌圈直径在10 mm至14 mm之间,判为中介度;无抑菌圈,判为耐药);两性霉素B(10 μg)(≥15,S;10~14,I;< 10,R);氟康唑(25 μg)(≥20,S;12~19,I;≤11,R);益康唑(10 μg)(≥20,S;12~19,I;≤11,R);沃尔康唑(1 μg)(≥14,S);咪康唑(10 μg)(≥20,S;12~19,I;≤11,R);酮康唑(15μg)(≥30,S;23~29,I;≤22,R);克霉唑(10 μg)(≥20,S;12~19,I;≤11,R);氟胞嘧啶(10 μg)(≥30,S;23~29,I;≤22,R);特比萘芬(30 μg)(≥20,S;12~19,I;≤11,R)。
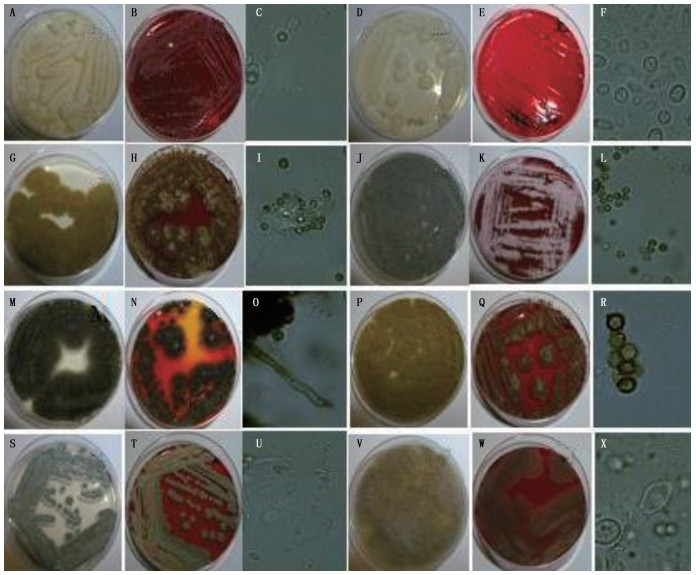
2 结果 2.1 真菌分离鉴定结果本研究利用真菌培养方法从122只猴中分离获得存活真菌71株,经形态学鉴定为:阿萨希毛孢子菌11株(分离菌株编号:0411F1、0808F15、0830F4、0830F5、0918F3、0918F8、0918F10、0918F36、0918F38、0918F40、1011F6-2)、圆形毛孢子菌8株(0411F7、0411F15、0411F25-1、0411F28、0509F1、0509F2、0509F3-2、1010F5-1)、白色念珠菌5株(0509F5、0509F7-1、0509F9、0808F12-1、1010F3-1)、黄曲霉5株(0509F10-1、0808F3、1010F2-1、1010F4-1、1011F6-1)、烟曲霉2株(0509F6、0918F14)、黑曲霉2株(0509F4、0808F7)、焦曲霉1株(0808F1)、杂色曲霉3株(0808F12-2、0808F14、1010F1-2)、聚多曲霉2株(0808F10、0808F16)、匿名曲霉2株(0808F2、1010F9-1)、产黄青霉2株(0411F8、0411F27)、草酸青霉5株(0411F25-2、0808F8、0830F2、0918F18、1010F7-2)、变幻青霉1株(1010F3-2)、宛氏拟青霉1株(1011F2-2)、小刺青霉1株(0509F10-2)、绳状青霉2株(0509F3-1、0509F7-2)、卷枝毛霉6株(0830F1、0830F6、0830F7、0830F8、1010F5-2、1010F7-1)、多变根毛霉2株(0830F3-1、0830F3-2)、伞枝犁头霉4株(1010F2-3、1010F8-2D、1010F8-2U、1010F9-2)、球毛壳霉株(0918F15)、热带头梗霉1株(0918F37)、节菱孢霉菌1株(0509F8-1)、暗孢节菱孢菌1株(0509F8-2)、链格孢1株(1010F4-3)、松色二孢菌1株(0808F9)。获得的71株经纯化转种存活的真菌中有24株分离自猴直肠样本(24/71),47株分离自毛发样本(47/71)。32株真菌分离自恒河猴(直肠部位9株:阿萨希毛孢子菌1011F6-2,圆形毛孢子菌0509F1、0509F2、0509F3-2、1010F5-1,白色念珠菌0509F5、0509F7-1、0509F9、1010F3-1;毛发皮肤处23株:黄曲霉0509F10-1、1010F2-1、1010F4-1、1011F6-1,烟曲霉0509F6,黑曲霉0509F4,杂色曲霉1010F1-2,匿名曲霉1010F9-1,草酸青霉1010F7-2,变幻青霉1010F3-2,宛氏拟青霉1011F2-2,小刺青霉0509F10-2,绳状青霉0509F3-1、0509F7-2,卷枝毛霉1010F5-2、1010F7-1,伞枝犁头霉1010F2-3、1010F8-2D、1010F8-2U、1010F9-2,节菱孢霉菌0509F8-1,暗孢节菱孢菌0509F8-2,链格孢1010F4-3);39株真菌分离自食蟹猴(直肠部位15株:阿萨希毛孢子菌0411F1、0808F15、0830F4、0830F5、0918F3、0918F8、0918F10、0918F36、0918F38、0918F40,圆形毛孢子菌0411F7、0411F15、0411F25-1、0411F28,白色念珠菌0808F12-1;毛发皮肤处24株:黄曲霉0808F3,烟曲霉0918F14,黑曲霉0808F7,焦曲霉0808F1,杂色曲霉0808F12-2、0808F14,聚多曲霉0808F10、0808F16,匿名曲霉0808F2,产黄青霉0411F8、0411F27,草酸青霉0411F25-2、0808F8、0830F2、0918F18,卷枝毛霉0830F1、0830F6、0830F7、0830F8,多变根毛霉0830F3-1、0830F3-2,球毛壳霉0918F15,热带头梗霉0918F37,松色二孢菌0808F9)(表 3)。结果显示,猴直肠部位真菌分离率为34%(24/71),猴毛发皮肤处真菌分离率为66%(47/71)。猴直肠部位优势真菌主要为毛孢子菌属阿萨希毛孢子菌和念珠菌属白色念珠菌,毛发皮肤处优势真菌主要为曲霉菌属黄曲霉、青霉菌属草酸青霉、毛霉菌属卷枝毛霉。图 1显示的是部分真菌菌落生长形态和菌丝孢子的典型特征:阿萨希毛孢子菌(图 1-A~C),圆形毛孢子菌(图 1-D~F),黄曲霉(图 1-G~I),烟曲霉(图 1-J~L),黑曲霉(图 1-M~O),匿名曲霉(图 1-P~R),变幻青霉(图 1-S~U),卷枝毛霉(图 1-V~X)。
|
|
表 3 猴真菌核糖体基因克隆测序 Table 3 Cloning and sequencing of ribosomal genes of monkey-derived fungal strains |
|
图 1 猴真菌培养特性和形态照片 Figure 1 Cultural characteristics and morphological photos of monkey-derived fungal strains |
采用真菌普通PCR检测猴真菌,PCR扩增产物经琼脂糖凝胶电泳检测,选取电泳条带单一、明亮的PCR产物,回收纯化后进行基因克隆、序列测定。将测得的基因序列采用Blast程序与GenBank中已公布的相关真菌的基因序列进行同源性比对,找出最相近的序列信息,确定大致分类地位。当序列相似性不小于99%时,真菌菌株被鉴定到种的水平;相似性小于99%时,鉴定到属的水平;而相似性小于95%时,则不能被鉴定。部分生长不良及形态特征难以分辨的真菌菌株结合真菌基因克隆测序结果比对分析核实。表 3结果显示:获得的71株猴真菌分离菌株核糖体基因序列与GenBank中序列核苷酸同源性为99%~100%。本研究发现猴真菌分布于11属25种,其中毛孢子菌属2种(阿萨希毛孢子菌11株,圆形毛孢子菌8株),念珠菌属1种(白色念珠菌5株),曲霉属7种(黄曲霉5株,烟曲霉5株,黑曲霉2株,焦曲霉1株,杂色曲霉3株2株,聚多曲霉2株,匿名曲霉2株),青霉菌属6种(产黄青霉2株,草酸青霉5株,变幻青霉1株,宛氏拟青霉1株,小刺青霉1株,绳状青霉2株),毛霉菌属2种(卷枝毛霉6株,多变根毛霉2株),犁头霉属1种(伞枝犁头霉4株),毛壳菌属1种(球毛壳霉1株),头梗霉属1种(热带头梗霉1株),节菱孢霉属2种(节菱孢霉菌1株,暗孢节菱孢菌1株),链格孢霉属1种(链格孢1株),色二孢属(Diplodia)1种(松色二孢菌1株)。
2.3 TaqMan-MGB探针RTFQ-PCR检测白色念珠菌结果用白色念珠菌TaqMan-MGB探针RTFQ-PCR从猴中检出5份阳性样本(0509F5、0509F7-1、0509F9、0808F12-1、1010F3-1),这5株分离菌株ITS和26S rRNA基因序列与GenBank中已公布的Candida albicans核苷酸同源性为100%,从分子水平上对白色念珠菌进行了确认。
2.4 抗真菌药物敏感性试验结果部分猴真菌分离株抗真菌药物敏感性试验结果见表 4。阿萨希毛孢子菌(0918F8、0918F36、1011F6-2)、圆形毛孢子菌(0509F2)、黄曲霉(0808F3、1011F6-1)、烟曲霉(0509F6、0918F14)、黑曲霉(0509F4、0808F7)、焦曲霉(0808F1)、杂色曲霉(0808F12-2)、聚多曲霉(0808F10)、匿名曲霉(1011F9-1)、产黄青霉(0411F8)、草酸青霉(0830F2、0918F18)、变幻青霉(1011F3-2)、宛氏拟青霉(1011F2-2)、小刺青霉(0509F10-2)、卷枝毛霉(1011F5-2)、多变根毛霉(1011F7-1)、伞枝犁头霉(1011F8-2D)、热带头梗霉(0918F37),结果显示,这些真菌对制霉菌素、两性霉素B、氟康唑、咪康唑、酮康唑、氟胞嘧啶、特比萘芬等抗真菌药物已经产生耐药性。
|
|
表 4 猴真菌药敏试验 Table 4 Antifugal susceptibility test of monkey-derived fungal strains |
目前,国内外尚未见有关猴的真菌监测分析的报道,猴致病性真菌的研究信息更少。因此,本研究调查分析了猴携带的真菌,识别了致病性真菌,填补了这一研究空白。本次调查中,猴的总真菌感染率(至少检出1种真菌的百分比)为58%(71/122)。共发现了11属25种不同的真菌,其中毛孢子菌2种,分别是阿萨希毛孢子菌、圆形毛孢子菌;念珠菌1种,为白色念珠菌;曲霉7种,分别是黄曲霉、烟曲霉、黑曲霉、焦曲霉、杂色曲霉、聚多曲霉、匿名曲霉;青霉6种,分别是产黄青霉、草酸青霉、宛氏拟青霉、小刺青霉、绳状青霉;毛霉2种,分别是卷枝毛霉、多变根毛霉;犁头霉1种,为伞枝犁头霉;毛壳霉1种,为球毛壳霉;头梗霉1种,为热带头梗霉;节菱孢霉2种,分别是节菱孢霉菌、暗孢节菱孢菌;链格孢霉1种,为链格孢;色二孢菌1种,为松色二孢菌。这些真菌大多为人兽共患病病原体[12-14]。
由真菌引起的疾病统称真菌病(mycosis)。根据感染部位将真菌病分为浅部真菌感染(病原性真菌)和深部真菌感染(机会致病性真菌)。毛发、皮屑、甲屑等为浅部真菌感染采集标本。痰、血、脑脊液等为深部真菌感染采集标本。真菌致病性有条件致病、致敏、产毒、诱癌、致癌等。真菌超敏反应性疾病多由吸入真菌的菌丝或孢子,引起呼吸道过敏反应(哮喘、过敏性鼻炎、荨麻疹)、接触性皮炎。有些真菌污染粮食油料作物,食入后引起急性或慢性中毒,称真菌中毒。本研究猴的毛孢子菌感染率较高(16%,19/122),在对其进一步的菌种鉴定中发现,以阿萨希毛孢子菌和圆形毛孢子菌最为多见。毛孢子菌可导致Ⅲ型或Ⅳ型过敏症。阿萨希毛孢子菌可通过皮肤粘膜感染,侵犯血液循环和肾,损害肺、胃肠道、皮肤、肝、脾等相关器官,其产生生物膜能逃避宿主的正常免疫系统的监视,在易受感染的宿主(癌症、烧伤、移植、关节造形术、类固醇、腹膜透析、长时间机械通气、接受人工瓣膜手术的病人)中成为发病的关键。本研究猴的白色念珠菌感染率为4%(5/122),该菌感染可引起口腔疾病、肺炎、心内膜炎、肠炎、肾盂肾炎、阴道炎、脑膜炎、脑脓肿、败血症等。本研究猴的曲霉菌感染率很高(14%,17/122),主要为黄曲霉、烟曲霉、黑曲霉、焦曲霉、杂色曲霉、聚多曲霉和匿名曲霉。曲霉菌感染可引起真菌性角膜炎甚至致盲。黄曲霉毒素主要侵害肝、肾和神经系统,摄入高含量黄曲霉毒素可导致肝癌甚至急性中毒性死亡。黑曲霉是糖尿病患者甲癣病的主要病原。烟曲霉、焦曲霉、黑曲霉、杂色曲霉感染所致侵袭性肺曲霉病是致死性感染的主要原因。本研究还发现猴的毛霉、犁头霉、节菱孢、链格孢等感染,这些致病性真菌侵袭力较强并可能产生毒素。多变根毛霉感染引起毛霉病,造成局部皮肤粘膜严重破坏,可深达骨组织,病程漫长可达10余年。伞枝犁头霉感染后病情发展迅速,危及生命,病死率较高。暗孢节菱孢菌引起皮肤感染。节菱孢产毒素损害中枢神经和消化系统,严重时会造成终身残疾甚至死亡。链格孢引起皮癣、甲癣、颚骨髓炎等疾病,其毒素是重要的致癌因素[15-22]。
本研究采集了猴的毛发和直肠样本,采用多种培养基进行了真菌分离,选择适宜的温度对单细胞真菌、多细胞真菌进行了纯化转种,获得的存活真菌种类繁多,丰富了猴真菌种子库。传统的真菌分类主要是以形态学为根据,而形态特征受营养基质和温、湿、光、pH、时间等条件的影响,易发生变异(形态、菌落、色素、毒力),有些真菌因环境条件改变,可由一种形态转变为另一种形态,难以准确鉴定到种。仅从形态学上难以区分匿名曲霉与黄曲霉,而杂色曲霉、聚多曲霉、链格孢、松色二孢菌等在真菌培养基上生长状态欠佳,本研究通过提取这些真菌DNA后进行PCR扩增、基因克隆、测序鉴定,经在线序列比对分析能准确鉴定到种,提示形态学方法结合分子生物学技术相互补充,可快速精准做好真菌物种的鉴定。本研究真菌药物敏感性试验结果显示,这些真菌菌株对制霉菌素、两性霉素B、氟康唑、咪康唑、酮康唑、氟胞嘧啶、特比萘芬等抗真菌药物已经产生抗性。由此可见,及时进行真菌培养和药敏试验,及早明确病原学诊断和对抗真菌药物的敏感性,正确选用抗真菌药物是防制致病性真菌感染成功的关键。
综上所述,本研究联合应用真菌培养、TaqMan-MGB探针RTFQ-PCR、普通PCR、基因克隆和测序技术,以形态学特征为基本分类依据,通过靶基因序列测定、比较和分析,准确鉴定猴的真菌,研究的猴真菌具有多样性丰富性,获得了较为全面的结果,充实了猴的真菌种子库。通过对真菌rDNA进行分析,为纯/混合培养、复合样本中在形态学的基础上很难分离的毛孢子菌属、曲霉属真菌的区分提供了一种简便快速工具。今后,还将进一步应用宏基因组和高通量深度测序分析技术,对猴中可能存在但用现行培养方法无法获得的真菌(主要为深部真菌)展开深入调查研究,获得更多更全面的关于猴的真菌多样性的数据,为真菌致病性研究和相关疫病防制提供科学参考依据。
| [1] |
GB/T 14926. 4-2001实验动物·皮肤病原真菌检测方法[S]. 2001 GB/T 14926. 4-2001 Laboratory Animal·Method for Examination of Pathogenic Dermal Fungi[S]. 2001 |
| [2] |
魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979: 13. WEI JC. Handbook of Fungi Identification[M]. Shanghai: Shanghai Science and Technology Press, 1979: 13. |
| [3] |
王端礼. 医学真菌学:实验室检验指南[M]. 北京: 人民卫生出版社, 2005: 103. WANG DL. Medical Mycology-Guide to Laboratory Examination[M]. Beijing: People's Medical Publishing House, 2005: 103. |
| [4] |
高正琴, 岳秉飞. 中国新疆灰仓鼠真菌多样性[J]. 中国人兽共患病学报, 2014, 30(7): 709. GAO ZQ, YUE BF. Diversity of fungi derived from the Cricetulus migratorius from the Xinjiang region of China[J]. Chin J Zoonoses, 2014, 30(7): 709. DOI:10.3969/cjz.j.issn.1002-2694.2014.07.010 |
| [5] |
WHIET TJ, BRUNS T, LEE S, et al. Amplification and Direct Sequencing of Fungal Ribosomal RNA Genes for Phylogenetics.PCR Protocols:A Guide to Methods and Application[J]. New York:Academic Press, 1990, 315. |
| [6] |
FLIEGEROVÁ K, MRÁZEK J, VOIGT K. Differentiation of anaerobic polycentric fungi by rDNA PCR-RFLP[J]. Folia Microbiol(Praha), 2006, 51(4): 273. DOI:10.1007/BF02931811 |
| [7] |
O'DONNELL K. Ribosomal DNA internal transcribed spacers are highly divergent in the phytopathogenic ascomycete Fusarium sambucinum(Gibberella pulicaris)[J]. Curr Genet, 1992, 22(3): 213. DOI:10.1007/BF00351728 |
| [8] |
DAGAR SS, KUMAR S, MUDGIL P, et al. D1/D2 domain of large subunit rDNA for differentiation of Orpinomyces spp[J]. Appl Environ Microbiol, 2011, 77(18): 6722. DOI:10.1128/AEM.05441-11 |
| [9] |
高正琴, 岳秉飞. 白色念珠菌TaqMan-小沟结合物探针实时荧光定量聚合酶链式反应快速检测及抗真菌药物敏感性分析[J]. 药物分析杂志, 2017, 37(6): 1071. GAO ZQ, YUE BF. Rapid detection of Candida albicans by real-time fluorescent quantitative polymerase chain reaction using TaqMan-minor groove binder probe and analysis of antifungal susceptibility[J]. Chin J Pharm Anal, 2017, 37(6): 1071. |
| [10] |
National Committee for Clincial Laboratory Standards. Method for Antifugal Disk Diffusion Susceptibility Testing of Yeasts: Approved Guideline M44-A[S]. 2004
|
| [11] |
ESPINEL-INGROFF A, CANTON E, FOTHERGILL A, et al. Quality control guidelines for amphotericin B, Itraconazole, posaconazole, and voriconazole disk diffusion susceptibility tests with nonsupplemented Mueller-Hinton Agar(CLSI M51-A document) for nondermatophyte filamentous fungi[J]. J Clin Microbiol, 2011, 49(7): 2568. DOI:10.1128/JCM.00393-11 |
| [12] |
TAYLOR LH, LATHAM SM, WOOLHOUSE ME. Risk factors for human disease emergence[J]. Philos Trans R Soc Lond B Biol Sci, 2001, 356(1411): 983. DOI:10.1098/rstb.2001.0888 |
| [13] |
WOOLHOUSE ME, GOWTAGE-SEQUERIA S. Host range and emerging and reemerging pathogens[J]. Emerg Infect Dis, 2005, 1(12): 1842. |
| [14] |
于恩庶, 黄丰, 潘亮, 等. 当今人兽共患病病原体分类[J]. 中国人兽共患病学报, 2006, 22(6): 485. YU ES, HUANG F, PAN L, et al. Zoonotic pathogens species[J]. Chin J Zoonoses, 2006, 22(6): 485. DOI:10.3969/j.issn.1002-2694.2006.06.001 |
| [15] |
de ALMEIDA JÚNIOR JN, HENNEQUIN C. Invasive trichosporon infection:a systematic review on a re-emerging fungal pathogen[J]. Front Microbiol, 2016(7): 1629. |
| [16] |
SALVATORI O, PURI S, TATI S, et al. Innate immunity and Saliva in Candida albicans-mediated oral diseases[J]. J Dent Res, 2016, 95(4): 365. DOI:10.1177/0022034515625222 |
| [17] |
WIJESURIYA TM, KOTTAHACHCHI J, GUNASEKARA TD, et al. Aspergillus species:an emerging pathogen in onychomycosis among diabetics[J]. Indian J Endocrinol Metab, 2015, 19(6): 811. DOI:10.4103/2230-8210.167565 |
| [18] |
佟飞, 吴志坚, 石寒, 等. 一起进食含黄曲霉毒素饲料引起食蟹猴急性中毒死亡病例报告[J]. 广西预防医学, 2003, 9(5): 288. TONG F, WU ZJ, SHI H, et al. A case of acute poisoning death of Macaca fascicularis caused by aflatoxin feed[J]. Guangxi Prev Med, 2003, 9(5): 288. DOI:10.3969/j.issn.1673-758X.2003.05.011 |
| [19] |
MOORE GG, MACK BM, BELTZ SB. Genomic sequence of the aflatoxigenic filamentous fungus Aspergillus nomius[J]. BMC Genomics, 2015, 16(1): 551. DOI:10.1186/s12864-015-1719-6 |
| [20] |
ABUALI MM, POSADA R, del TORO G, et al. Rhizomucor variabilis var.regularior and Hormographiella aspergillata infections in a leukemic bone marrow transplant recipient with refractory neutropenia[J]. J Clin Microbiol, 2009, 47(12): 4176. DOI:10.1128/JCM.00305-09 |
| [21] |
BELFIORI R, TERENZI A, MARCHESINI L, et al. Absidia corymbifera in an immune competent accident victim with multiple abdominal injuries:a case report[J]. BMC Infect Dis, 2007, 7: 46. DOI:10.1186/1471-2334-7-46 |
| [22] |
TWAROCH TE, CURIN M, STERFLINGER K, et al. Specific antibodies for the detection of Alternaria allergens and the identification of cross-reactive antigens in other fungi[J]. Int Arch Allergy Immunol, 2016, 170(4): 269. DOI:10.1159/000449415 |
 2018, Vol. 38
2018, Vol. 38 
