非达霉素(fidaxomicin,商品名:Dificid)是一种新型的窄谱大环内酯类抗生素,通过抑制RNA聚合酶,对艰难梭菌(Clostridium difficile)具有极强的杀菌作用[1-3]。非达霉素于2011年5月获得FDA通过在美国上市,这是近30年来首个被批准用于治疗艰难梭菌相关性腹泻(CDAD)的抗生素[4],为应对日益严重的艰难梭菌耐药菌提供了全新的选择[5]。
由于结构复杂,化学合成困难,非达霉素生产主要依靠微生物发酵[6],因此筛选能够高效合成非达霉素的菌株以及改进发酵工艺对于产量提高具有重要意义。在此过程中,需要建立快速、准确、适用于发酵液样品的非达霉素含量分析方法。根据文献检索,《中华人民共和国药典》2015年版和美国药典(USP 40)尚未将非达霉素收载;在公开发表的刊物中,也仅有少量文章[7-9]涉及非达霉素的定性分析,目前未见发酵液中非达霉素含量分析的相关报道。本研究采用HPLC法定量检测发酵液中的非达霉素,将使高产菌株的筛选和发酵过程产物控制更加高效准确。
1 仪器与试药Shimadzu LC-20A-DAD分析型高效液相色谱仪,包括二元梯度泵、自动进样器、柱温箱和二极管阵列检测器(岛津公司);XA105型电子天平(精度0.01 mg,梅特勒-托利多公司),Allegra X-15R高速离心机(贝克曼-库尔特公司),Millipore超纯水机(默克密理博实验设备有限公司),KQ5200DE型数控超声波清洗器(功率200 W,频率40 kHz。昆山市超声仪器有限公司)。
非达霉素对照品(纯度 > 99%)购自Selleckchem公司。甲醇为色谱纯,水为超纯水,其余试剂均为分析纯。非达霉素发酵液由福建省微生物研究所新药筛选实验室提供。
2 方法与结果 2.1 溶液的制备 2.1.1 对照品溶液取非达霉素对照品13.18 mg,精密称定,置于100 mL量瓶中,用甲醇溶解并定容,摇匀,即得对照品储备液。精密量取储备液2 mL,置于10 mL量瓶中,用甲醇定容,摇匀,即得对照品溶液。
2.1.2 发酵液供试品溶液精密量取发酵液2 mL,加入甲醇6 mL,加盖盖严,摇匀,超声震荡30 min,4 500 r·min-1离心10 min,取上清液于10 mL量瓶中,用甲醇定容,摇匀,用0.45 μm微孔滤膜滤过,取续滤液作为发酵液供试品溶液。
2.2 色谱条件采用Agilent 5 TC-C18色谱柱(250 mm×4.6 mm,5 μm),以甲醇-0.1%甲酸(73:27)为流动相,流速1.0 mL·min-1,检测波长228 nm,柱温40 ℃,进样量20 μL;分析时间为30 min。
2.3 发酵液中非达霉素鉴别为了确证发酵液中的非达霉素,采用高效液相色谱制备方法获得发酵液中色谱峰与非达霉素对照品保留时间一致的化合物单体,对其进行紫外吸收光谱、高分辨质谱和核磁共振谱(1H NMR、13C NMR)分析[10]。结果显示该化合物在206、228、266和317 nm有特征吸收峰;HR-EI-MS:m/z 1079.4175[M+Na]+(C52H74O18Cl2);1H NMR、13C NM报道的大环内酯类化合物非达霉素相同,确定该色谱峰为非达霉素,非达霉素化学结构见图 1。
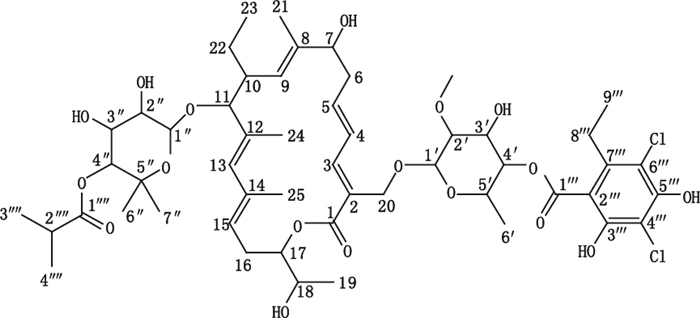
|
图 1 非达霉素的化学结构 Figure 1 The chemical structure of fidaxomicin |
精密吸取“2.1.1”项下对照品溶液,“2.1.2”项下制备的发酵液供试品溶液和空白发酵液(未接种非达霉素产生菌的发酵培养基)供试品溶液各20 μL,按照“2.2”项下的色谱条件进样分析,结果见图 2,非达霉素的保留时间为16.76 min,主峰与相邻杂质峰的分离度大于1.5,理论塔板数以非达霉素峰计不低于6 000。发酵液中培养基组分对非达霉素的测定无干扰。
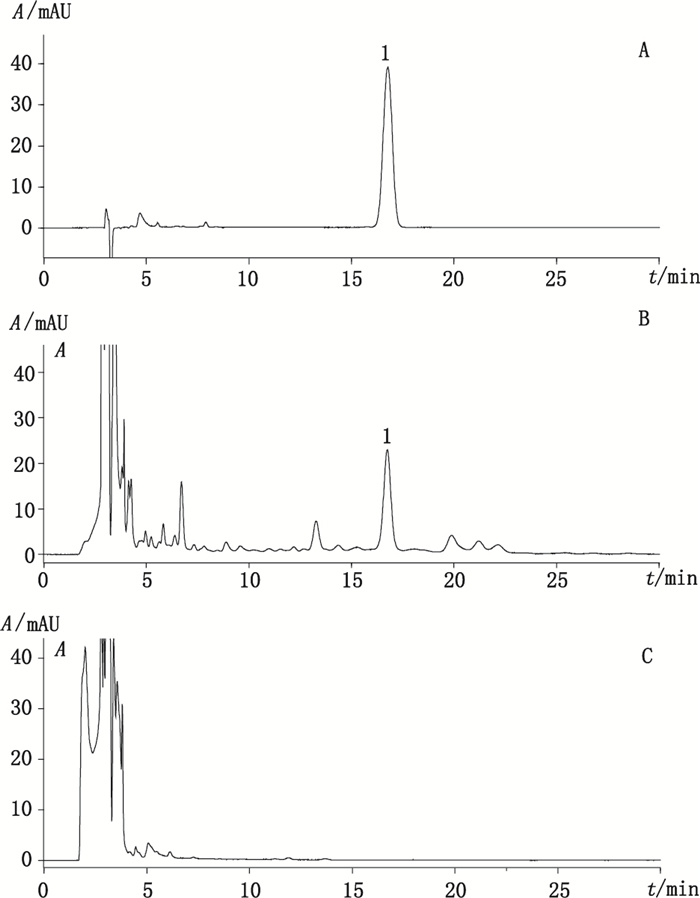
|
1.非达霉素(fidaxomicin) 图 2 对照品(A)、发酵液样品(B)和空白发酵液样品(C)的高效液相色谱图 Figure 2 HPLC chromatograms of reference substance(A), fermentation broth sample(B) and blank fermentation broth sample(C) |
精密吸取非达霉素对照品储备液0.5、1、2、3、4、5、6 mL,分别置于10 mL量瓶中,用甲醇定容,摇匀,配制成系列浓度的对照品溶液;按“2.2”项下色谱条件分别进样20 μL,测定峰面积。以浓度(X,μg·mL-1)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线。其回归方程(n=7):
| $ Y=4.602\times {{10}^{4}}X+2.377\times {{10}^{4}}\ \ \ \ \ \ r=0.9999 $ |
结果表明非达霉素质量浓度在6.59~79.08 μg·mL-1范围内与峰面积线性关系良好。
2.6 精密度试验精密吸取“2.1.2”项下发酵液供试品溶液20 μL,按照“2.2”项下的色谱条件连续进样6次,测定非达霉素峰峰面积和保留时间,计算其RSD(n=6)分别为0.42%和0.060%。表明仪器精密度良好。
2.7 稳定性试验以“2.1.2”项下方法制备发酵液供试品溶液,按照“2.2”项下色谱条件于制备后0、2、4、6、8、10、12 h进样20 μL,测定非达霉素峰面积,其RSD为1.9%,结果表明发酵液供试品溶液在室温下放置12 h内基本稳定。
2.8 重复性试验取同一批次发酵液,以“2.1.2”项下方法平行制备6份发酵液供试品溶液,按照“2.2”项下色谱条件依次进行测定,结果发酵液中非达霉素平均含量为11.46 μg·mL-1,RSD(n=6)为1.4%,表明该方法的重复性良好,方法可行。
2.9 加样回收率试验取已准确测定非达霉素含量(59.4 μg·mL-1)的同一批次发酵液9份,每份精密量取2 mL,平分为3组,每组按低、中、高浓度分别精密加入对照品储备液0.7、0.9、1.1 mL,以“2.1.2”项下方法制备发酵液供试品溶液,按照“2.2”项下色谱条件测定,计算加样回收率,结果见表 1,试验表明该方法准确性良好。
|
|
表 1 回收率试验结果(n=9) Table 1 Results of the recovery test |
精密量取3个不同批次非达霉素发酵液2 mL,以“2.1.2”项下方法制备发酵液供试品溶液,按照“2.2”项下色谱条件进行测定,通过回归方程进行计算,结果3批发酵液中非达霉素的含量分别为59.4、52.5、53.6 μg·mL-1。
3 讨论与结论 3.1 发酵液的处理分别对发酵清液和菌丝中产物分布情况考察后发现,约90%的非达霉素存在于菌丝中(不同发酵批次略有差异),因此需要通过有机溶剂对菌丝进行破壁提取。试验中考察的有机溶剂为甲醇、乙醇和丙酮,有机溶剂与水的体积比分别为2:1、3:1、4:1和5:1,并与无水有机溶剂的提取效果进行比较,结果比例为3:1的甲醇-水提取效率最高;为简化操作步骤,确定向发酵液直接加入3倍体积量甲醇以制备供试品溶液。
另外,由于发酵液静置后菌丝沉积,为使试验结果可靠,重复性强,量取发酵液前应充分搅拌,以消除取样不均匀导致的误差。
3.2 色谱条件的选择考察了不同的流动相组成(甲醇-水、乙腈-水、甲醇-0.1%甲酸水和乙腈-0.1%甲酸水),不同的检测波长(228、266 nm),不同的流速(0.8、1.0 mL·mim-1)以及不同的柱温(室温、40 ℃)对非达霉素含量测定的影响,最终确定本研究的色谱条件,该方法分离度好,峰形对称,响应较强,适合于非达霉素含量测定。
3.3 小结目前,非达霉素产生菌的来源包括指孢囊菌属(Dactylosporangium)、游动放线菌属(Actinoplanes)、小单孢菌属(Micromonospora)和链孢菌属(Catellatospora)[12-14]。福建省微生物研究所新药筛选实验室通过基因筛选体系分离到1株非达霉素的产生菌,由于发酵液中存在各种微生物初级、次级代谢产物以及培养基组分,含量分析一直是个亟待解决的问题,本研究针对该菌株建立发酵液中非达霉素含量测定方法,简便高效、准确性和重复性良好,利于高产菌株筛选和发酵过程产物监测,为该菌株后续开发奠定基础。同时,鉴于微生物中非达霉素的生物合成基本都是通过7个关键的合成酶实现[15],本研究也可以为其他非达霉素产生菌的含量检测提供指导和参考。
| [1] |
ZHANEL GG, WALKTY AJ, KARLOWSKY JA. Fidaxomicin:a novel agent for the treatment of Clostridium difficile infection[J]. Can J Infect Dis Med Microbiol, 2015, 26(6): 305. |
| [2] |
MICHAEL G, GRIT A. OPT-80, a macrocyclic antimicrobial agent for the treatment of clostridium difficile infection:a review[J]. Expert Opin Investig Drugs, 2008, 17(4): 547. DOI:10.1517/13543784.17.4.547 |
| [3] |
姜春梅, 刘洋, 王京晶, 等. 抗感染新药非达霉素的药理作用与临床评价[J]. 中国新药杂志, 2011, 20(23): 2283. JIANG CM, LIU Y, WANG JJ, et al. Pharmacology and clinical evaluation of the new anti-infective drug fidaxomicin[J]. Chin New Drugs J, 2011, 20(23): 2283. |
| [4] |
CRUZ MP. Fidaxomicin(Dificid), a novel oral macrocyclic antibacterial agent for the treatment of Clostridium difficile-associated diarrhea in adults[J]. Pharm Ther, 2012, 37(5): 278. |
| [5] |
MANTHEY CF, ECKMANN L, FUHRMANN V. Therapy for Clostridium difficile infection:any news beyond metronidazole and vancomycin[J]. Expert Rev Clin Pharmacol, 2017, 10(11): 1239. DOI:10.1080/17512433.2017.1362978 |
| [6] |
SHUE YK, FRANK CJ, CHIOU MH, et al. Tiacumicin Production: US, 2006/0257981 A1[P]. 2006-11-16
|
| [7] |
THERIAULT RJ, KARWOWSKI JP, JACKSON M, et al. Tiacumicins, a novel complex of 18-membered macrolide antibiotics.Ⅰ.Taxonomy, fermentation and antibacterial activity[J]. J Antibiot, 1987, 40(5): 567. DOI:10.7164/antibiotics.40.567 |
| [8] |
SANGHVI S, ROACH M, ZHOU JF, et al. Compositions of Stable Tiacumicins: US, 2008/0176927 A1[P]. 2008-07-24
|
| [9] |
肖毅, 李苏梅, 马亮, 等. 台勾霉素产生菌指孢囊菌NRRL 18085遗传操作体系的建立[J]. 微生物学报, 2010, 50(8): 1014. XIAO Y, LI SM, MA L, et al. Genetic manipulation system for tiacumicin producer Dactylosporangium aurantiacum NRRL 18085[J]. Acta Microbiol Sin, 2010, 50(8): 1014. |
| [10] |
江宏磊, 方志锴, 陈名洪, 等. 大环内酯类抗生素产生菌的基因筛选及其代谢产物研究[J]. 天然产物研究与开发, 2017, 29(11): 1895. JIANG HL, FANG ZK, CHEN MH, et al. Gene screening of macrolide-producing strain and its metabolites[J]. Nat Prod Res Dev, 2017, 29(11): 1895. |
| [11] |
SHUE YK, HWANG CK, CHIU YH, et al. 18-Membered Macrocycles and Analogs Thereof: US, 2010/0009925 A1[P]. 2010-02-14
|
| [12] |
KURABACHEW M, LU SH, KRASTEL P, et al. Lipiarmycin targets RNA polymerase and has good activity against multidrug-resistant strains of Mycobacterium tuberculosis[J]. J Antimicrob Chemoth, 2008, 62(4): 713. DOI:10.1093/jac/dkn269 |
| [13] |
HOCHLOWSKI JE, SWANSON SJ, RANFRANZ LM, et al. Tiacumicins, a novel complex of 18-membered macrolide antibiotics.Ⅱ.Isolation and structure determination[J]. J Antibiot, 1987, 40(5): 575. DOI:10.7164/antibiotics.40.575 |
| [14] |
CORONELLI G, WHITE RJ, LANCINI GC, et al. Lipiarmycin, a new antibiotic from Actinoplanes.Ⅱ.Isolation, chemical, biological and biochemical characterization[J]. J Antibiot, 1975, 28(4): 253. DOI:10.7164/antibiotics.28.253 |
| [15] |
XIAO Y, LI SM, NIU SW, et al. Characterization of tiacumicin B biosynthetic gene cluster affording diversified tiacumicin analogues and revealing a tailoring dihalogenase[J]. J Am Chem Soc, 2011, 133: 1092. DOI:10.1021/ja109445q |
 2018, Vol. 38
2018, Vol. 38 